Extracción asistida por ultrasonidos de antocianinas y compuestos polifenólicos en lías tintas
Introducción
La industria vitivinícola es uno de los sectores más importantes, con una producción de 279 millones de hectolitros de vino (OIV, 2018). Solamente en España, esta industria genera entre 2 y 3 millones de subproductos, donde el 14% corresponde a la producción de lías. Estas lías están formadas principalmente por microorganismos (levaduras en su mayoría), acido tartárico, coloides y materia inorgánica (Pérez-Serradilla et al., 2008). Tradicionalmente, las lías de vinificación se han empleado como alimento para el ganado, nutriente para procesos de fermentación alcohólica o substrato para la obtención de ácido tartárico. No obstante, en muchos casos, las lías se vierten al medio ambiente, causando así un problema ambiental dado su bajo pH y elevada demanda biológica y química de oxígeno (Bustamante et al., 2008).
Durante los últimos años, las lías han sido sujeto de distintas investigaciones. Por un lado, se han investigado durante el proceso de vinificación, con la intención de extraer las proteínas y carbohidratos, para intentar mejorar las propiedades sensoriales del vino final (Del Fresno et al., 2018). Por otro lado, las lías se han estudiado como subproducto dada la presencia de compuestos bioactivos en su composición (Tao et al., 2016). De este modo, estudios realizados con distintos procesos de extracción han clasificado las lías como un subproducto capaz de mostrar potencial en la industria alimentaria, farmacéutica o cosmética dadas las propiedades antiinflamatorias, antioxidantes y antimicrobianas que presentan los polifenoles de su composición.

En cuanto al proceso de extracción de las lías, el proceso de Extracción Asistida por Ultrasonidos (en adelante, EAU) ha ganado relevancia durante los últimos años dada su capacidad para extraer polifenoles de distintas matrices orgánicas. Además, se ha comprobado que dicha metodología presenta ventajas, entre otras, el bajo consumo de disolventes. No obstante, el rendimiento de esta metodología de extracción puede verse afectada por distintos factores tales como el tipo de disolvente, el pH y la temperatura del proceso de extracción. Dados estos precedentes, en esta investigación se ha empleado un Diseño de experimento Box-Behnken (DBB) (3 niveles, 6 factores) en combinación con la metodología de superficie de respuesta, para optimizar el proceso y reducir el número de experimentos necesarios para ello.
En vista de los hechos enumerados anteriormente, esta investigación pretende poner en valor las lías de vinificación mediante el diseño y la optimización simultánea de seis variables (factores) de extracción durante el proceso de EAU, con el objetivo de maximizar la obtención de compuestos bioactivos de interés como son las antocianinas o el conjunto de sus polifenoles.
Material y Métodos
Material: Lías tintas resultantes de la vinificación de la variedad Tempranillo fueron recolectadas de una bodega privada del municipio de Jerez de la Frontera (Cádiz, España). Posteriormente se centrifugaron y liofilizaron durante 72 horas. Una vez liofilizadas se homogeneizaron y conservaron en condiciones de sequedad y oscuridad hasta su utilización para la extracción.
Proceso de extracción: Para llevar a cabo las extracciones de Antocianinas Totales (AT) y Compuestos Polifenólicos Totales (CPT) se empleó una sonda ultrasonidos acoplada a un regulador de ciclo y amplitud junto con un baño termostatizado para el control de la temperatura. Se estudiaron tres niveles distintos para cada parámetro a optimizar (bajo, medio y alto) y fueron los siguientes: porcentaje de metanol (0-25-50% para AT y 25-50-75% para CPT), temperatura (10-35-60 °C), pH (2-4,5-7), ratio disolvente:lías (10:0,5-15:0,5:20:0,5), amplitud de la onda (30-45-70%) y ciclo de la onda (0,2-0,45-0,7 s). Para cada extracción se emplearon 0,5 gramos de lías y se extrajeron en las condiciones fijadas por la metodología durante 10 minutos. Posteriormente se centrifugaron a 5.900 g durante 5 minutos y el sobrenadante se conservó a -20 °C.
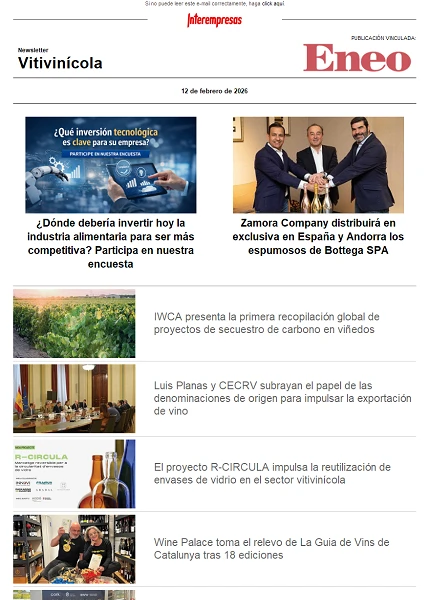
Metodología: La identificación de las 14 antocianinas diferentes encontradas en los extractos se llevó a cabo mediante UHPLC-QToF-MS siguiendo la metodología propuesta por González de Peredo et al., (2019). Una vez identificadas se cuantificaron las AT mediante UHPLC-UV-Vis siguiendo las indicaciones de Pereira et al., (2019) (Figura 1). Por último, la cuantificación de CPT se llevó a cabo siguiendo el método propuesto por Singleton et al., (1999) y el procedimiento propuesto por Espada-Bellido et al., (2017).
Resultados y Discusión
En la presente investigación, se empleó un DBB de seis factores y tres niveles para establecer las condiciones óptimas del proceso de EAU para obtener el mayor rendimiento posible AT y CPT. Todas las extracciones se optimizaron para seis variables diferentes: porcentaje de metanol en el disolvente (X1), temperatura (X2), amplitud de onda ultrasónica (X3), ciclo de onda ultrasónica (X4), pH del disolvente (X5) y relación disolvente:masa (X6). Todo el diseño consistió en 54 extracciones con seis repeticiones en el punto central realizadas en orden aleatorio. Las seis variables se estudiaron en tres niveles diferentes; -1 (bajo), 0 (medio) y +1 (alto). Los resultados de AT (RTA, mg/g lías) y CPT (RTP, mg/g lías) y todo el diseño experimental se muestran en el Anexo I. Para correlacionar las relaciones entre las variables, los resultados obtenidos después del análisis se introdujeron en la siguiente ecuación polinómica de segundo orden:
R = β0 + β1X1+ β2X2 + β3X3 + β4X4 + β5X5 + β6X6 + β11X12 + β12X1X2 + β13X1X3 – β14X1X4 + β15X1X5 + β16X1X6 + β22X22 + β23X2X3 + β24X2X4 + β25X2X5 + β26X2X6 + β33X32 + β34X3X4 + β35X3X5 + β36X3X6 + β44X42 + β45X4X5+ β46X4X6 + β55X52 + β56X5X6 + β66X62
Donde R es la respuesta de las extracciones, β0 es la constante del modelo, βi son los coeficientes lineares, βij son la interacción de los coeficientes, βii son los coeficientes cuadráticos y, Xi y Xj son las variables independientes.
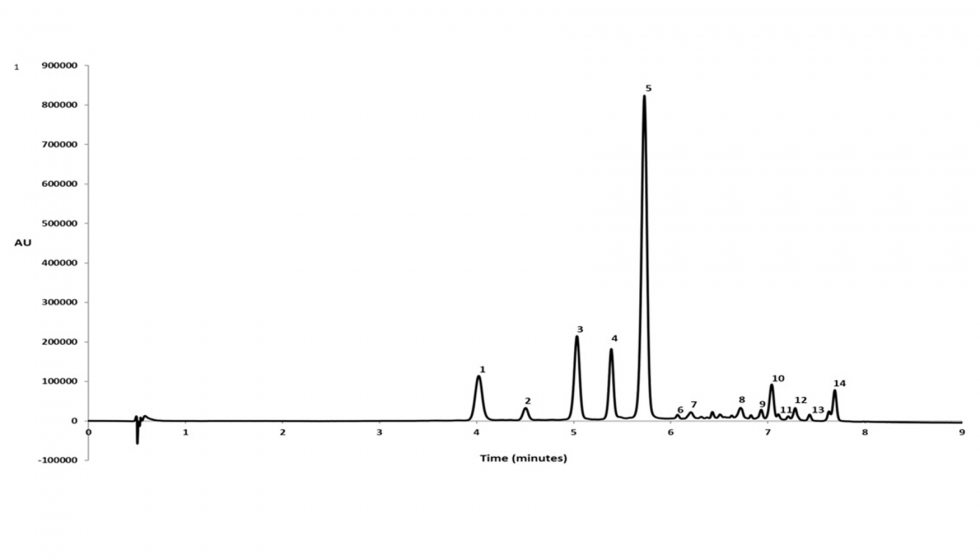
Para optimizar las seis variables estudiadas, un análisis de la varianza (ANOVA, Anexo II, Anexo III) se llevó a cabo para evaluar el efecto de las distintas variables estudiadas y sus interacciones. El análisis del modelo mostró claramente que, para la extracción de AT, el porcentaje de metanol, el pH y el ciclo de la onda fueron los factores más significativos. El porcentaje de metanol y el ciclo de la onda tuvieron un efecto positivo, lo que significa que un incremento en estos valores favorece la extracción de las antocianinas. Al contrario ocurrió con el pH, donde un aumento de este produce un descenso en el rendimiento de extracción. En cuanto a la extracción de CPT, las variables más influyentes fueron el porcentaje de metanol, la amplitud de la onda y algunas interacciones cuadráticas del metanol con otros factores. Ambos factores presentaron un efecto positivo, lo cual indica que un aumento en la concentración del disolvente y la amplitud de la onda ultrasónica, favorece la extracción.
Con el fin de eliminar aquellos factores que no fueron significativos en el proceso de extracción, así como su combinación con otros, se dispusieron los resultados del ANOVA en diagramas de Pareto para CPT (Figura 2) y AT (Figura 3). En estos diagramas se observan los factores para cada variable respuesta (AT o bien CPT) en orden decreciente de significancia con una línea vertical que marca el p valor <0,05.
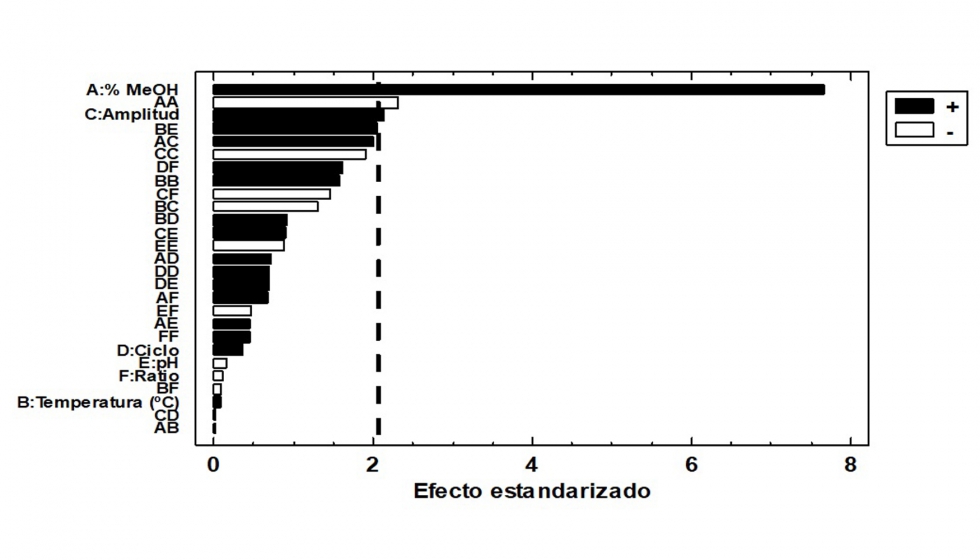
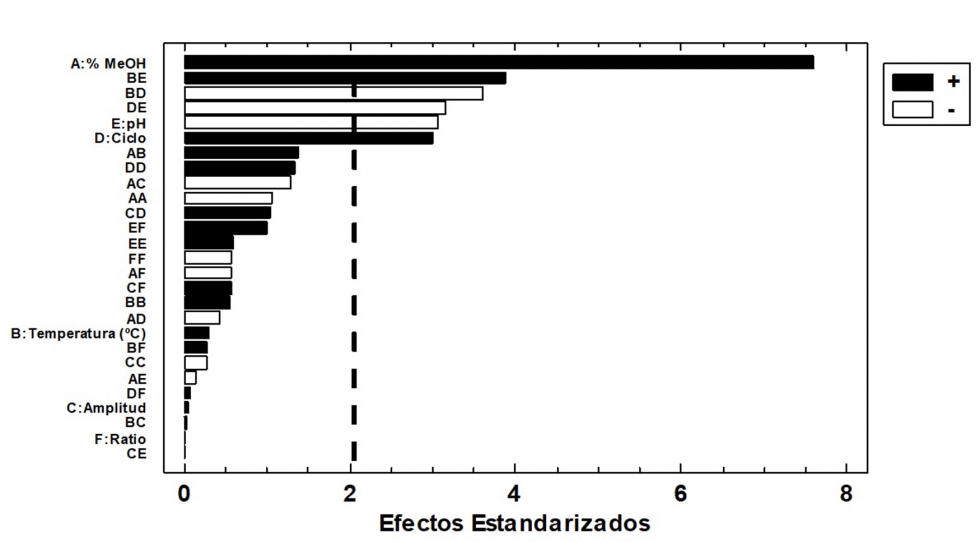
Una vez identificadas aquellas variables que no son significativas para el modelo de extracción propuesto, dado que su p-valor >0,05, y que por lo tanto pueden no considerarse en la ecuación polinómica del modelo, los polinomios de segundo orden para la extracción de CPT y AT fueron los siguientes:
RCPT = 53.215 + 22.920·X1 + 6.337·X3 – 10.532·X12
RAT = 5.26 + 2.464·X1 + 0.975·X4 – 0.997·X5 – 2.027·X2X4 + 1.539·X2X5 -1.77·X4X5
De este modo, de acuerdo con el diseño experimental para la extracción de AT y CPT, y una vez se terminó el estudio de optimización del proceso de extracción, se establecieron las condiciones óptimas de extracción para el modelo ajustado (Tabla 1).
| AT | CPT | |
|
Composición del disolvente (% MeOH) |
49.2 |
73.38 |
|
Temperatura (ºC) |
10.2 |
10.3 |
|
Amplitud (%) |
51.1 |
67.68 |
|
Ciclo (s) |
0.69 |
0.69 |
| pH |
6.94 |
4.33 |
|
Ratio (ml:g Lías) |
10.8:0.5 |
19.8:0.5 |
En cuanto a los resultados óptimos propuestos, se observa como la concentración de metanol se encuentra en el límite superior de los valores testados (50 y 75% respectivamente). Se ha observado también como las temperaturas bajas aseguran una buena conservación de las antocianinas, dado que estos compuestos son termosensibles. Además, las temperaturas bajas podrían prever la evaporación del disolvente durante el proceso de extracción. Por lo referente a la amplitud de la onda, los valores elevados de ésta facilitan la cavitación y por lo tanto la extracción. En cuanto al ciclo, los valores más altos propuestos se han alcanzado en ambos casos (0,7). Este hecho puede deberse a que una mayor compresión y refracción de la onda ultrasónica facilita la extracción de los compuestos. Con respecto a los valores de pH se ha observado como los mayores rendimientos se obtienen en pH comprendidos en el rango de 3-7, resultados que coinciden con los observados en la bibliografía en los que las formas polifenólicas más estables se generan a pH.
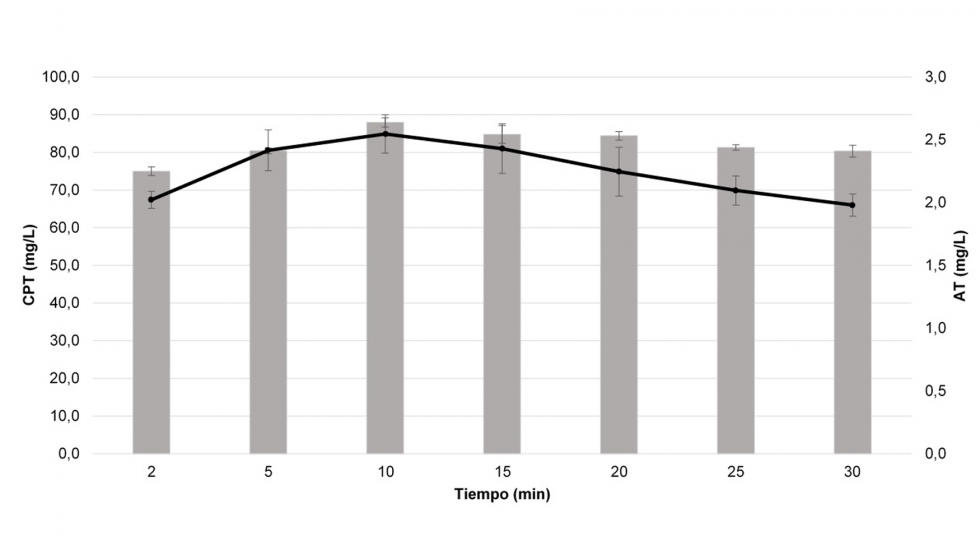
Una vez optimizadas de forma simultánea las condiciones de extracción, se procedió a optimizar el tiempo de extracción (Figura 4). Como se puede observar, las extracciones para CPT y TA fueron similares en el tiempo, siendo la extracción a 2 minutos la que presentó mayores diferencias con el resto. En ambos casos, se obtuvo un máximo de rendimiento en la extracción empleando un tiempo de 10 minutos. En vista de los resultados, el modelo propuesto presenta una disminución significativa en el tiempo de extracción con aquellas metodologías de EAU presentes en la bibliografía (Tao et al., 2016).
Tras optimizar el método de EAU de AT y CPT, éste se analizó en términos de repetibilidad (precisión de la EAU el mismo día, n=12) y precisión intermedia (precisión de la EAU en distintos días, n=18) siguiendo las indicaciones propuestas por Espada-Bellido et al., (2017). Los resultados de repetibilidad del método, expresados como coeficiente de variación, fueron de 4,19 y 4,47% para AT y CPT respectivamente. En cuanto a la precisión intermedia, los valores obtenidos fueron de 4,42 y 4,89%. En todos los casos los valores de coeficiente de variación obtenidos fueron buenos (<5%) encontrándose en todo momento en los valores aceptables propuestos por la AOAC (± 10%).
Conclusiones
En este trabajo se ha creado una metodología analítica rápida y eficiente para maximizar la extracción de TA y TPC en lías tintas. El estudio que aquí se reporta es el primero en el que seis variables del proceso de EAU han sido modeladas y optimizadas simultáneamente para la extracción de cualquiera de los dos compuestos. Las condiciones óptimas para la extracción de CPT fueron las siguientes: 73% MeOH en disolvente de agua con un pH de 4, 10 °C de temperatura de extracción, 20:0,5 mL:g de relación disolvente:masa y ondas ultrasónicas a 0,7 s de ciclo y 68% de amplitud. En cuanto a la extracción de AT, las condiciones óptimas de la EAU fueron las siguientes: 49% de contenido de metanol, con 6,9 de pH, 10 °C de temperatura, 11:0,5 mL:g de relación disolvente:masa, ciclo de ultrasonidos de 0,7 s y 51% de amplitud. Ambos métodos mostraron una alta repetibilidad y niveles de precisión intermedios, ya sea para AT o CPT. De este modo, la creación de estos dos métodos permitirá evaluar el contenido en AT y CPT en lías de vinificación de una forma más precisa.
Bibliografía
- Bustamante, M. A.; Moral, R.; Paredes, C.; Pérez-Espinosa, A.; Moreno-Caselles, J.; Pérez-Murcia, M. D.; 2008: Agrochemical characterisation of the solid by-products and residues from the winery and distillery industry. Waste Management 28(2), 372–380. https://doi.org/10.1016/j.wasman.2007.01.013
- Espada-Bellido, E.; Ferreiro-González, M.; Carrera, C.; Palma, M.; Barroso, C.G.; Barbero, G.F.; 2017: Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp. Food Chemistry 219, 23–32. https://doi.org/10.1016/j.foodchem.2016.09.122
- Del Fresno, J. M.; Loira, I.; Morata, A.; González, C.; Suárez-Lepe, J. A.; Cuerda, R.; 2018: Application of ultrasound to improve lees ageing processes in red wines. Food Chemistry 261, 157-163. https://doi.org/10.1016/j.foodchem.2018.04.041
- González de Peredo, A.V.; Vázquez-Espinosa, M.; Espada-Bellido, E.; Ferreiro-González, M.; Amores-Arrocha, A.; Palma, M.; Barbero, G. F; Jiménez-Cantizano, A.; 2019: Alternative Ultrasound-Assisted Method for the Extraction of the Bioactive Compounds Present in Myrtle (Myrtus communis L.). Molecules 24(5), 882. https://doi.org/10.3390/molecules24050882
- Pereira, D.T.V.; Tarone, A.G.; Cazarin, C. B. B.; Barbero, G. F.; Martínez, J.; 2019: Pressurized liquid extraction of bioactive compounds from grape marc. Journal of Food Engineering 240, 105-113. https://doi.org/10.1016/j.jfoodeng.2018.07.019
- Pérez-Serradilla, J.A.; Luque de Castro, M.D.; 2008: Role of lees in wine production: a review. Food Chemistry 111, 447–456. https://doi.org/10.1016/j.foodchem.2008.04.019
- Singleton, V.L.; Orthofer, R.; Lamuela-Raventós, R.M.; 1999: Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. In: Methods in Enzymology; Academic Press: Cambridge, MA, United States; 152–178.
- Tao, Y.; Wu, D.; Zhang, Q. A.; Sun, D. W.; 2014: Ultrasound-assisted extraction of phenolics from wine lees: Modeling, optimization and stability of extracts during storage. Ultrasonics Sonochemistry 21(2), 706–715. https://doi.org/10.1016/j.ultsonch.2013.09.005