Magnaporthe oryzae, un hongo de difícil control y de efectos devastadores en nuestros cultivos de arroz
Magnaporthe oryzae es un hongo patógeno de arroz que produce la enfermedad denominada piriculariosis. Es el patógeno de plantas que mayores pérdidas produce mundialmente. El control de la enfermedad es altamente compleja y requiere la búsqueda de nuevas estrategias. Actualmente solo la prevención y el uso de variedades resistentes han conseguido reducir las pérdidas económicas que ocasiona la enfermedad. Recientemente está afectando a cultivos de trigo en algunas regiones y no podemos descartar que en un futuro lleguen a ser un problema global. En España varios proyectos de investigación relacionados con la patogénesis de M. oryzae se llevan a cabo en el CBGP donde varios investigadores esperamos entender en mayor profundidad la biología del hongo y la enfermedad que produce. Gracias a estas investigaciones esperamos poder encontrar vías sólidas con el fin de solucionar en un futuro próximo el problema real que ocasiona a los agricultores este devastador hongo.
El hongo Magnaporthe oryzae (anamorfo Pyricularia oryzae) que fue considerado en 2012 por los expertos como el hongo patógeno más importante en cuanto a los efectos económicos y sociales ocasionados (Dean et al., 2012). Tenemos que tener en cuenta que es el cultivo más importante para la mitad de la población mundial. Países del mundo como China, India, Pakistán y otras regiones altamente pobladas, dependen del arroz como alimento principal. Por todo ello y debido a la amplia distribución de estos cultivos podemos decir que este patógeno y la enfermedad (denominada piriculariosis, quemazón, el ‘fallat de l’arròs’, el ‘cucat’ o añublo) tienen unos efectos devastadores en la producción de arroz mundial. Por ejemplo, cálculos recientes estiman que la pérdida anual producida por M. oryzae son equivalentes a las necesidades calóricas de entre 212 y 742 millones de personas (Fisher et al., 2012).

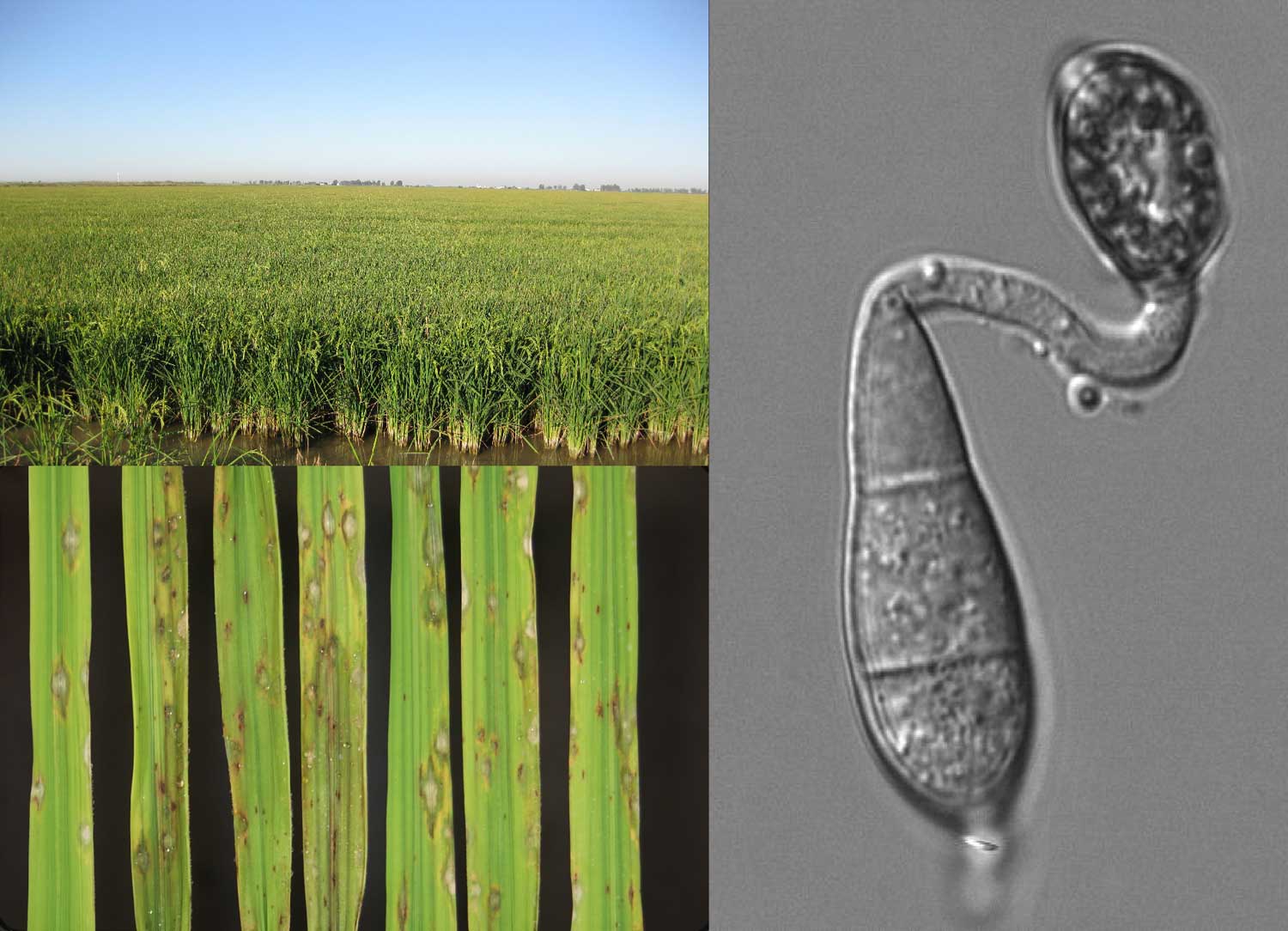
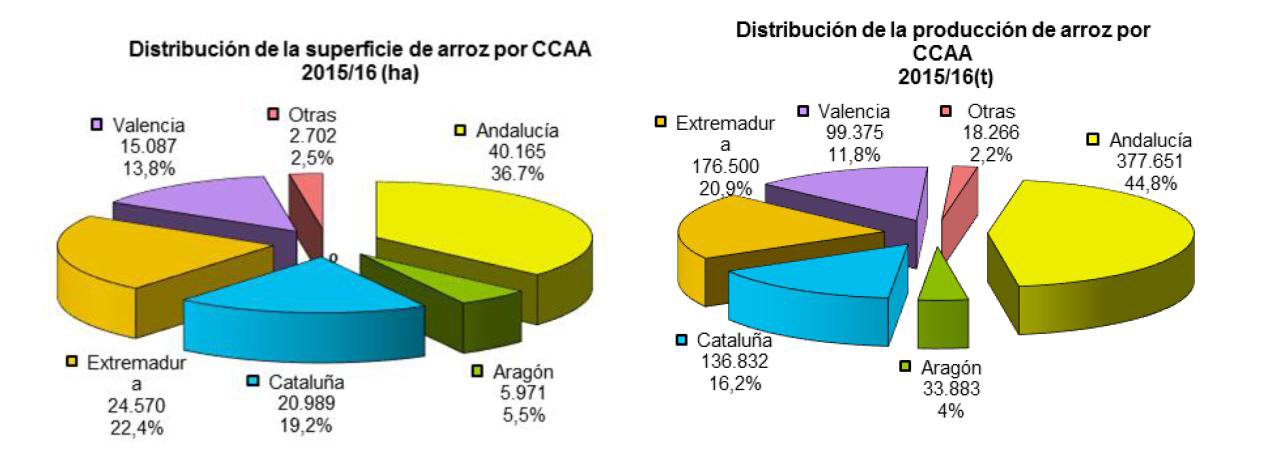
A su vez M. oryzae se ha convertido en los últimos años en un organismo modelo donde estudiar mecanismos generales de las interacciones planta-patógeno. Numerosos grupos de investigadores en todo el mundo (especialmente en Asia) estudian cómo el hongo infecta a la planta y cómo es capaz de evitar los sistemas de protección basal de la planta. Si hablamos de Europa, Italia y España producen un 80% del total de arroz de la Unión Europea (50% Italia y un 30% España). En España hay aproximadamente 115.000 hectáreas dedicadas a la producción de arroz y tienen un rendimiento de 7,75 toneladas/hectáreas (a partir de datos de la SGCHI1). Andalucía es la región con una mayor producción de arroz seguida de Extremadura y Cataluña (ver grafica). En la última década, las infecciones por piricularia se han originado en casi todas las regiones productoras españolas (Cataluña, Valencia, Extremadura, Andalucía, etc.).
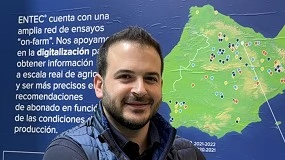
El hongo Magnaporthe oryzae tiene un ciclo de vida corto en la planta y por tanto múltiples infecciones se pueden llevar a cabo en un campo infectado por este patógeno (Illana et al., 2013). El hongo penetra por la hoja gracias a una estructura de forma semiesférica denominada apresorio (en la foto se observa una espora germinada formando un apresorio). Debido a una gran presión (aproximadamente 8 Mpa) ejercida sobre la superficie de la hoja, el hongo es capaz de penetrar en la planta (ver foto). Una vez dentro crece de una manera biotrófica, es decir, sin afectar demasiado al crecimiento de la planta y sin matar a las células vegetales. Al cabo de unos tres días los efectos del hongo sobre la hoja comienzan a ser visibles y a generar lesiones debido a la necrosis o muerte de las células de la hoja (ver foto). En ese punto, realmente podemos decir que el hongo empieza a matar a la planta y se alimenta de los restos de las células vegetales muertas.
Este estadío de crecimiento se denomina necrotrófico. Finalmente a los seis o siete días, el hongo emerge del tejido vegetal y de cada lesión se generan miles de esporas al día durante dos semanas. Las esporas se diseminan por viento o agua y están listas para iniciar un nuevo ciclo de infección. Durante todo este proceso se produce una merma importante en el cultivo pudiendo afectar severamente la producción de los granos de arroz. Dependiendo en la época o parte de la planta donde se produce el ataque la severidad puede ser variable. Las lesiones que produce el hongo en las hojas son de forma alargada, de color marrón uniforme. Más adelante presenta centros grisáceos y bordes de color marrón (se pueden observar en las fotos las lesiones de hojas de arroz infectadas con M. oryzae). También puede producir daños en los nudos, en diferentes partes de la panícula y en los granos. En muchas ocasiones, los granos terminan vacíos o deficientemente llenos y grisáceos. Dependiendo de la variedad y las condiciones predisponentes, las pérdidas ocasionadas por la infección pueden llegar a reducir en más de un 65% los rendimientos en la producción de granos de arroz.
Existen variedades de arroz más resistentes a la infección por Magnaporthe (piricularia) pero en su mayoría el hongo al cabo de unos años vuelve a tener la capacidad de infectar a estas variedades 'resistentes'. Esto es debido a que el hongo tiene gran capacidad de modificarse genéticamente y con ello adaptarse a infectar de nuevo a variedades anteriormente resistentes. Es por eso que está considerada como una enfermedad criptogámica compleja debido a la variabilidad patogénica y la rapidez con la que este hongo consigue evadir las defensas basales del arroz.
Sabemos adicionalmente que ciertas condiciones ambientales favorecen la infección de los campos. Cuando la temperatura oscila entre 22-29 °C y cuando hay una humedad relativa muy elevada (sobre un 90%) podemos decir que, con mucha probabilidad, el hongo es capaz de infectar y posiblemente lo hará si no se toman las medidas oportunas. Los cultivos que están cerca del mar cumplen con estas condiciones de humedad más habitualmente, por lo tanto estos campos tienen una probabilidad alta de infección. Asimismo sabemos que una elevada concentración de nitrógeno en el agua de riego favorece la infección. Por lo tanto, un exceso de abonado favorece en muchas ocasiones la piricurialosis. Es conveniente por parte de los arroceros controlar estos factores que favorecen la infección. Cultivos de arroz con poca variabilidad genética también favorece los ataques por el patógeno. Por consiguiente es importante hacer rotaciones de las variedades de arroz que se cultivan en las distintas temporadas.
En cuanto a formulaciones fitosanitarias que controlen el hongo, actualmente sólo un fungicida, el triciclazol, puede controlar la infección. El uso del triciclazol está actualmente prohibido por la Unión Europea. Aunque excepcionalmente la UE y MAGRAMA está autorizando su uso al no existir muchas alternativas viables. Por todo esto se cuantifican pérdidas económicas importantes al disponer pocas materias activas efectivas contra la piricularia.
Para poder encontrar vías efectivas para combatir el hongo necesitamos conocer más acerca de la biología del hongo y de la planta. A su vez necesitamos tener nociones claras a nivel molecular de las distintas fases de los mecanismos de la enfermedad. Desde el punto de vista de la planta, la mejor estrategia de manejo y control están basadas en el empleo de variedades de arroz con resistencia piramidal (una sola variedad incluye los genes de resistencia completa más importantes contra la piriculariosis). Al final de los años 60, ya se estableció un sistema diferencial de cultivares de arroz con distintos genes de resistencia que permitía distinguir las razas del hongo presentes en un determinado lugar (Atkins et al., 1967). Ello permitió que se pudieran empezar a realizar estudios sistemáticos sobre el tipo de razas del hongo predominantes en un lugar y qué genes de resistencia se podían utilizar. Normalmente, la resistencia completa frente a M. oryzae sigue la ley de Flor de gene-a-gen y se les llama genes Pi. En 1965 se identificaron los dos primeros genes de resistencia completa a M. oryzae en arroz y los llamaron Pi1 y Pi6(t) (Atkins & Johnston, 1965). Esta resistencia completa conferida por genes 'mayores' en dos a tres años es superada fácilmente por el hongo en condiciones de campo. Por ello, se está empezando a tener en cuenta la resistencia incompleta o parcial, que permite cierto grado de tolerancia frente al patógeno reduciendo la presión ambiental al que éste se ve sometido. Esto permite la presencia de unos niveles tolerantes de patógeno sin que provoque grandes daños en la producción. Hoy día las técnicas de secuenciación masiva están permitiendo de forma más rápida y precisa caracterizar las poblaciones de aislados del hongo presentes en una determinada zona geográfica del cultivo.
Desde el punto de vista del hongo y a nivel molecular ya conocemos algunos de los mecanismos por los que penetra la planta y produce la infección (Illana et al., 2013). Gracias a estos conocimientos, las búsquedas de nuevos tratamientos pueden llevarse a cabo de una manera más efectiva. Actualmente en España no hay muchos grupos de investigación que estudien a nivel molecular la biología de Magnaporthe oryzae. El Centro de biotecnología y genómica de plantas (CBGP) es un centro mixto de la Universidad politécnica de Madrid (UPM) y del Instituto Nacional de Investigación de Tecnología Agraria y Alimentaria (INIA). En el CBGP, actualmente se desarrollan varios proyectos de investigación con M. oryzae. Concretamente el grupo de la Dra. Ane Sesma lleva a cabo varios proyectos enfocados en entender la infección de Magnaporthe y también de las respuestas del arroz a diferentes tipos de estrés (salinidad, infección por del hongo, etc.) (Foto del grupo de investigación). También en este mismo centro desde septiembre del 2015 estoy desarrollando un proyecto financiado por el Programa Estatal de Investigación, Desarrollo e Innovación Orientada a los Retos de la Sociedad y cofinanciado con fondos FEDER.
El proyecto cuenta también con la tutela de la Dra. Sesma y lo llevo a cabo asociado al mismo laboratorio. El reto de la investigación es identificar nuevas proteínas implicadas en la adaptación del hongo Magnaporthe oryzae al medio externo. Este es un proceso esencial para que el hongo sea capaz de infectar. También estoy analizando cómo se modulan, la expresión de genes implicados en la ruta de señalización de TOR (componente esencial de las rutas de censado de nutrientes de todas las células eucariotas) a nivel post-transcripcional. Este novedoso trabajo espero identificar los vínculos existentes entre el procesamiento de pre-mRNA en su extremo 3’ y la ruta TOR. Además analizaré cómo estos dos procesos regulan la expresión y función de genes del hongo relacionados con la infección (Franceschetti et al., 2011; Loewith & Hall, 2011; Rodriguez-Romero et al., 2014; Yu et al., 2014). En resumen, espero encontrar nuevas conexiones en la ruta TOR y otras vías de señalización en Magnaporthe oryzae. Dado el importante papel que desempeña esta ruta en el crecimiento del hongo, los nuevos genes identificados como resultado de mi proyecto podrían ser claramente dianas para el desarrollo de moléculas inhibidoras y de control de este devastador patógeno. Evidentemente, todos los conocimientos a nivel molecular que nos ayuden a entender como el hongo se desarrolla y dispersa, nos pueden servir para buscar nuevas estrategias para combatir esta grave enfermedad del arroz, que como hemos dicho produce grandes pérdidas económicas.
La piricularia no solo afecta al arroz. En el año 1985 se detectó en el estado de Paraná (Brasil) el primer caso de epidemia de esta enfermedad en trigo. También han surgido casos en Paraguay, Bolivia e incluso en Bangladesh. Recientes casos de infección de campos de trigo en estas regiones nos da una idea del riesgo de Magnaporthe si empieza a infectar, de forma común, a estos cultivos de cereales. Debido a la separación genética entre las estirpes que infectan trigo y arroz se propuso el cambio de nombre a Pyricularia tritici para aquellas estirpes que infectan trigo (Zhang et al., 2011). Por supuesto no existen tratamientos efectivos y de cultivares resistentes en trigo. Sabemos que M. oryzae también puede infectar otros cereales como centeno, cebada y triticale.
El pasado 26 de abril la prestigiosa revista científica 'Nature' publicó en su sección de noticias el devastador efecto de Magnaporthe sobre los campos de trigo en Bangladesh (Callaway, 2016). En distintas regiones de Bangladesh 15.500 hectáreas de trigo han sido infectadas por Pyricularia tritici. Actualmente existe una preocupación mundial por la posibilidad de la expansión de este patógeno a otras áreas geográficas donde el trigo tiene mucha más importancia económica que el arroz, como por ejemplo, Europa o Rusia.

Finalmente, ¿cuáles son las vías actuales para intentar atajar este problema? En una reciente reunión de investigadores de M. oryzae que se llevó a cabo en Paris el pasado abril los investigadores debatimos esta cuestión importante. En dicha reunión los investigadores nos preguntamos “¿Qué hacemos para que la investigación que llevamos a cabo con el patógeno realmente les sea útil a los agricultores?” Hubo diferentes opiniones pero llegamos a la conclusión que no hay una única vía. Actualmente, las principales vías son las búsquedas de variedades resistentes y el control de las poblaciones de M. oryzae que se encuentran durante los procesos de infección. Los investigadores necesitamos conocer bien los diferentes ‘patotipos’ para buscar estrategias más duraderas que lleven al control del patógeno. Otras estrategias se basan en la búsqueda de inhibidores específicos del hongo, que impidan la infección y la posterior esporulación y diseminación de la infección. Las esporas son la fuente más importante de inóculo. El inicio de esta enfermedad se produce posiblemente desde los restos de cosecha de la campaña anterior. Las esporas resistentes en estos restos sirven de inicio de la infección para la siguiente temporada. Por tanto, para evitar que se produzca esta esporulación, hay que adoptar estrategias que la impidan. Una estrategia sería la buena limpieza de restos de campañas anteriores. También encontrar nuevos principios y formulaciones contra el hongo ayudarían a prevenir y a 'curar' las infecciones.
Un primer paso a nivel nacional e internacional seria unificar bases de datos y catalogar todas las infecciones que se produzcan en las distintas regiones. Tener datos más exactos de las condiciones del cultivo y de las variedades de arroz infectadas. A su vez, hacer estudios genéticos tanto con los ‘patotipos’ de los distintos aislados como con las variedades de arroz. Por supuesto un incremento en el apoyo de las instituciones y de las cooperativas de agricultores para llevar a cabo más proyectos de I+D+i dentro de esta área ayudaría enormemente a encontrar soluciones a más corto plazo. Como siempre en investigación, la inversión económica es fundamental para mantener proyectos a largo plazo y que den resultados palpables. Esperemos que gracias a los avances en las investigaciones encontremos una solución duradera y un control más efectivo de la piriculariosis. Nuestros arroceros nos lo agradecerán.
Bibliografía
- Atkins, J. G., Robert, A. L., Adair, C. R., Goto, K., Kozaka, T., Yanagida, R., Yamada, M. & S, M. (1967). An international set of rice varieties for differentiating races of Piricularia oryzae. Phytopathology 57, 297. article, Amer Phytopathological SOC 3340 Pilot Knob Road, St Paul, MN 55121.
- Atkins, J. G. & Johnston, T. H. (1965). Inheritance in rice of reaction to races 1 and 6 of Piricularia oryzae. Phytopathology 55, 993. article, Amer Phytopathological SOC 3340 Pilot Knob Road, St Paul, MN 55121.
- Callaway, E. (2016). Devastating wheat fungus appears in Asia for first time. Nature 532, 421–422.
- Dean, R., Van Kan, J. A. L., Pretorius, Z. A., Hammond-Kosack, K. E., Di Pietro, A., Spanu, P. D., Rudd, J. J., Dickman, M., Kahmann, R. & other authors. (2012). The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol 13, 414–430.
- Fisher, M. C., Henk, D. a, Briggs, C. J., Brownstein, J. S., Madoff, L. C., McCraw, S. L. & Gurr, S. J. (2012). Emerging fungal threats to animal, plant and ecosystem health. Nature 484, 186–94. Nature Publishing Group.
- Franceschetti, M., Bueno, E., Wilson, R. A., Tucker, S. L., Gómez-Mena, C., Calder, G. & Sesma, A. (2011). Fungal virulence and development is regulated by alternative pre-mRNA 3’end processing in Magnaporthe oryzae. PLoS Pathog 7, e1002441. Journal Article, United States: Public Library of Science.
- Illana, A., Rodriguez-Romero, J. & Sesma, A. (2013). Major Plant Pathogens of the Magnaporthaceae Family. In Genomics of Soil-and Plant-Associated Fungi, pp. 45–88. incollection, Springer.
- Loewith, R. & Hall, M. N. (2011). Target of rapamycin (TOR) in nutrient signaling and growth control. Genetics 189, 1177–201.
- Rodriguez-Romero, J., Franceschetti, M., Bueno, E., Sesma, A. & Rodríguez-Romero, J. (2014). Multilayer Regulatory Mechanisms Control Cleavage Factor I Proteins in Filamentous Fungi. Nucleic Acid Res 43, 179–95. JOUR, .
- Sesma, A. & Osbourn, A. E. (2004). The rice leaf blast pathogen undergoes developmental processes typical of root-infecting fungi. Nature 431, 582–6.
- Yu, F., Gu, Q., Yun, Y., Yin, Y., Xu, J.-R., Shim, W.-B. & Ma, Z. (2014). The TOR signaling pathway regulates vegetative development and virulence in Fusarium graminearum. New Phytol 203, 219–32.
- Zhang, N., Zhao, S. & Shen, Q. (2011). A six-gene phylogeny reveals the evolution of mode of infection in the rice blast fungus and allied species. Mycologia 103, 1267–76.