Tratamientos con ácido oxálico en campo reducen las podredumbres causadas por Botrytis cinerea en uva de mesa 'Crimson'
aMaría E. García-Pastor, aMaría J. Giménez, bMaría Serrano, aSalvador Castillo, aDaniel Valero, aFabián Guillén, aPedro J. Zapata
aDep. de Tecnología Agroalimentaria, EPSO, Universidad Miguel Hernández
bDepartamento de Biología Aplicada, EPSO, Universidad Miguel Hernández
23/06/2020La cadena de comercialización de la uva (Vitis vinifera L.) es muy exigente en términos de preservar la calidad de la fruta. La uva de mesa se somete a largos períodos de almacenamiento antes de llegar a su destino final, y existen riesgos de importantes pérdidas postcosecha (Champa, 2015). En concreto, se estima un promedio para dichas pérdidas del 25 y el 50% de la producción total en países industrializados y en desarrollo, respectivamente. Una de las enfermedades postcosecha más importantes que afectan a la uva de mesa es la aparición del moho gris causado por Botrytis cinerea (Martínez-Romero et al., 2007), que tiene un impacto negativo en la calidad de las uvas debido a las pérdidas de peso, desvanecimiento del color, ablandamiento acelerado y reducción de la vida útil, provocando graves pérdidas económicas. El control de esta enfermedad es muy difícil ya que los tratamientos postcosecha con fungicidas sintéticos o SO2 no están permitidos en varios países (Youssef et al., 2015).

La variedad ‘Crimson’ se encuentra clasificada como una de las variedades de piel roja sin semillas que a pesar de tener muy buen sabor y aroma tienen un escaso desarrollo del color, así como presentan un racimo compuesto, principalmente, por bayas heterogéneas que conduce a la depreciación de su valor de mercado (García-Pastor et al., 2019). Estos problemas se han atribuido a las altas temperaturas en el sudeste español durante la maduración de las bayas, que impiden un desarrollo adecuado del color (Ferrara et al., 2015). Para mejorar la coloración de las bayas, se han aplicado en campo compuestos como el etefón (un compuesto liberador de etileno) y ácido abscísico (ABA). Sin embargo, estos tratamientos tienen efectos secundarios disminuyendo la firmeza del fruto y acelerando la abscisión de la baya, lo que facilitan la aparición de desordenes microbiológicos en la cadena de comercialización. Además, en los últimos años, existe una preocupación constante del consumidor acerca de la utilización de productos de síntesis química, que desencadenan la necesidad de encontrar compuestos naturales que permitan aumentar su calidad en la cosecha, así como mantenerla durante la cadena de comercialización. El ácido oxálico (AO) es un producto metabólico final de las plantas con muchas funciones fisiológicas, siendo la más importante el incremento de la resistencia sistémica contra enfermedades causadas por hongos, bacterias y virus (Tian et al., 2006; Zheng et al., 2012a). Existen muchas publicaciones que evidencian el papel del AO en la mejora de la resistencia contra patógenos y la muerte celular programada (Toal y Jones, 1999 y Kim et al., 2008) en distintos frutos; en peras y mangos (Tian et al., 2006, Zheng et al., 2007b, Zheng et al., 2007c y Zheng et al., 2012b), en jínjol (Wang et al., 2009) y en melón (Deng et al., 2015). Sin embargo, la información sobre la aplicación de AO como tratamiento precosecha es muy limitada. El objetivo de esta investigación fue evaluar los efectos del tratamiento en campo con AO en la variedad de uva de mesa, 'Crimson', enfocado principalmente para reducir la incidencia del moho gris en postcosecha.

Materiales y métodos
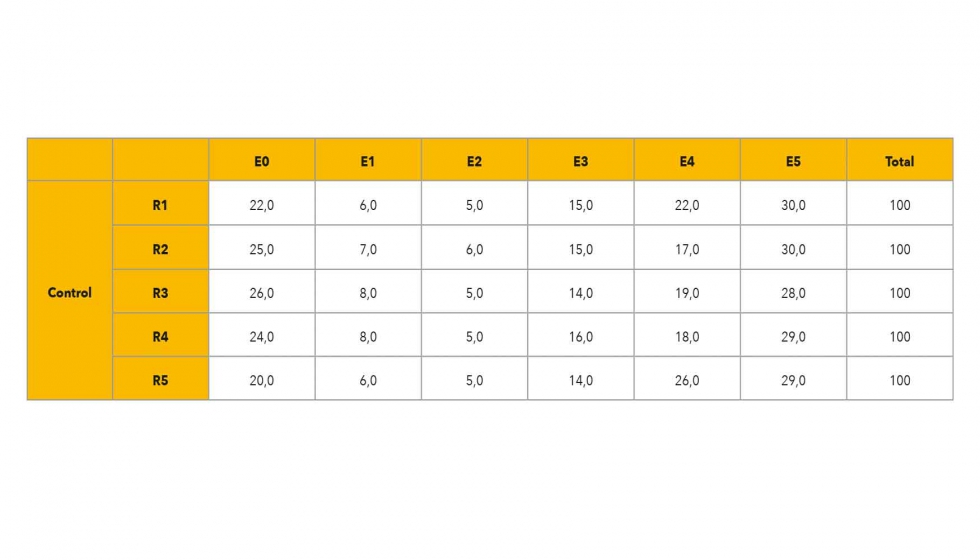
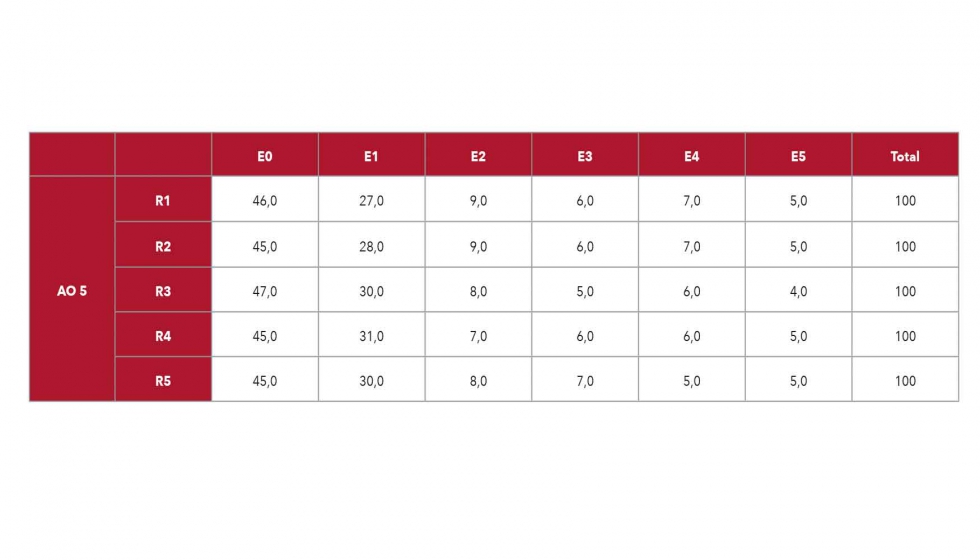
El experimento se realizó en la campaña de producción de 2018, en una finca comercial situada en Jumilla, utilizando parras de la variedad ‘Crimson’ de 10 años que se trataron el 26 de junio (T1), el 13 de julio (T2, envero) y el 6 de agosto (T3). El tratamiento de ácido oxálico (AO) se aplicó a la dosis de 5 mM, seleccionada en base a ensayos de campañas anteriores, en cinco repeticiones de tres parras por tratamiento. Se usó 1 mL L-1 de Tween-20 como surfactante y los árboles control se pulverizaron sólo con él. Los frutos se cosecharon según los criterios comerciales, basados en tamaño y color característico de esta variedad. En el laboratorio, se evaluó la incidencia en la pudrición causada por B. cinerea realizando un ensayo de inoculación mediante pulverización con 7500 UFC mL-1 del hongo. Para ello, se cortaron con tijeras 100 bayas de los racimos de cada una de las 5 repeticiones de campo, sin dañar el pedúnculo, y se colocaron en cajas de plástico para inocularlas. Estas muestras fueron desinfectadas previamente en un baño de agua con 100 ppm de cloro durante 1 minuto, secadas sobre papel de filtro y dañadas con una lanceta estéril (herida de 6 mm de dimensión). La inoculación se realizó mediante pulverización de una suspensión de esperas del hongo sobre la muestra y se evaluó a los 5 días mediante una escala visual de daños por podredumbre. Seis puntos hedónicos componían dicha escala: E0 (sin daños), E1 (herida pardeada), E2 (crecimiento microbiano cubre la herida), E3 (crecimiento microbiano cubre una cuarta parte de la baya y aparece micelio), E4 (crecimiento microbiano cubre la mitad de la baya y aparece micelio y ablandamiento) y E5 (crecimiento microbiano cubre toda la baya y aparece micelio y ablandamiento).

Resultados y discusión
Incidencia de Botrytis cinerea
A los 5 días de la inoculación, la incidencia y severidad de la enfermedad fúngica fueron evaluadas en una escala hedónica de seis puntos (Figura 1). La menor incidencia (P < 0.05) fue observada en las uvas tratadas en campo con AO 5 mM, ya que el porcentaje medio con ausencia de daños (E0) fue de un 45,60% del total de uvas en comparación con un 23,40% observado para las bayas no tratadas en campo (Tablas 1 y 2). Por otro lado, este tratamiento mostró el porcentaje más bajo de bayas en un estado de pudrición severa (E4 y E5) con valores medios de 6,20 y 4,80% del total, respectivamente. Las bayas controles habían alcanzado en torno a un 20,40 y 29,20 % promedio para dichos estados, es decir, mostraban síntomas más severos que las uvas que habían sido previamente tratadas en campo. Además, el porcentaje medio más bajo fue obtenido para los controles en E1 y E2, sin apenas daños, (6,76 y 4,91%, respectivamente) cuando este se observó en los tratados para E3 y E4, con síntomas avanzados de pudrición, (6,04 y 6,29%, respectivamente). Esto respalda que las bayas controles estaban significativamente más afectadas por la inoculación de B. cinerea frente a las uvas tratadas (Figura 2).

Estos resultados demuestran que el tratamiento precosecha con ácido oxálico puede inducir resistencia en uva de mesa cuando es colonizada por B. cinerea. No hay literatura acerca de este efecto del compuesto en precosecha, aunque si existen varias evidencias cuando es aplicado en postcosecha. El tratamiento con AO en peras y mangos inoculados con patógenos fúngicos disminuyó la expansión de la lesión y redujo la incidencia de decaimiento, lo cual se asoció con el aumento de la actividad de enzimas relacionadas con la defensa, acumulación de compuestos fenólicos y retraso en la maduración del fruto (Tian et al., 2006, Zheng et al., 2007b, Zheng et al., 2007c y Zheng et al., 2012b). Además, también se ha observado que el AO aumentó la protección contra Penicillium expansum durante el almacenamiento de jínjol, regulando varias proteínas relacionadas con el estrés y la defensa (Wang et al., 2009). En melón, el AO fue efectivo en reducir la pudrición rosa causada por Trichothecium roseum aumentando los mecanismos de defensa del fruto (Deng et al., 2015).
Conclusiones
El tratamiento con AO 5 mM de las parras indujo resistencia de las uvas a ser colonizadas con B. cinerea. El posible mecanismo de acción debería ser ampliamente estudiado. Este tratamiento podría ser una herramienta eficaz para reducir la pudrición de la uva durante su almacenamiento postcosecha.
Agradecimientos
Este trabajo ha sido financiado por el Ministerio de Economía y Competitividad de España a través del Proyecto AGL2015-63986R y la Comisión Europea con fondos FEDER. Los autores agradecen a la Universidad Miguel Hernández por la beca de doctorado de M.E. García-Pastor.
Referencias bibliográficas
- Champa H, Pre and postharvest practices for quality improvement of table grapes (Vitis vinifera L.). J National Sci Foundat 43:3-9 (2015).
- Deng J, Bi Y, Zhang Z, Xie D, Ge Y, Li W, Wang J and Wang Y, Postharvest oxalic acid treatment induces resistance against pink rot by priming in muskmelon (Cucumis melon L.) fruit. Postharvest Biol and Technol 106:53-61 (2015).
- Ferrara G, Mazzeo A, Matarrese AMS, Pacucci C, Punzi R, Faccia M, Trani A and Gambacorta G, Application of abscisic acid (S-ABA) and sucrose to improve color, anthocyanin content and antioxidant activity of cv. ‘Crimson Seedless’ grapes berries. Aust J Grape Wine Res 21:18–29 (2015).
- García-Pastor ME, Serrano M, Guillén F, Castillo S, Martínez-Romero D, Valero D and Zapata PJ, Methyl jasmonate effects on table grape ripening, vine yield, berry quality and bioactive compounds depend on applied concentration. Sci Hortic 247:380-389 (2019).
- Kim KS, Min JY and Dickman MB, Oxalic acid is an elicitor of plant programmed cell death during Sclerotinia sclerotiorum disease development. Mol Plant-Microbe Interact 21:605-612 (2008).
- Martínez-Romero D, Guillén F, Valverde JM, Bailén G, Zapata P, Serrano M, Castillo S and Valero D, Influence of carvacrol on survival of Botrytis cinerea inoculated in table grapes. Intl J Food Microbiol 115:144-148 (2007).
- Tian S, Wan Y, Qin G and Xu Y, Induction of defense responses against Alternaria rot by different elicitors in harvested pear fruit. Applied Microbiol and Biotechnol 70:729-734 (2006).
- Toal E and Jones P, Induction of systemic resistance to Sclerotinia sclerotiorum by oxalic acid in oilseed rape. Plant Pathol, 48:759-767 (1999).
- Wang Q, Lai T, Qin G and Tian S, Response of jujube fruits to exogenous oxalic acid treatment based on proteomic analysis. Plant & Cell Physiol 50:230-242 (2009).
- Youssef K, Roberto SR, Chiarotti F, Koyama R, Hussain I and Souza RT, Control of Botrytis mold of the new seedless grape ‘BRS Vitoria’ during cold storage. Sci Hortic 193:316-321 (2015).
- Zheng X, Jing G, Liu Y, Jiang T, Jiang Y and Li J, Expression of expansin gene, MiExpA1, and activity of galactosidase and polygalacturonase in mango fruit as affected by oxalic acid during storage at room temperature. Food Chem 132:849-854 (2012b).
- Zheng X, Tian S, Gidley MJ, Yue H and Li B, Effects of exogenous oxalic acid on ripening and decay incidence in mango fruit during storage at room temperature. Postharvest Biol and Technol 45:281-284 (2007b).
- Zheng X, Tian SP, Gidley MJ, Yue H, Li BQ and Xu Y, Slowing the deterioration of mango fruit during cold storage by pre-storage application of oxalic acid. J Hortic Sci Biotechnol 82:707–714 (2007c).
- Zheng X, Ye L, Jiang T, Jing G and Li J, Limiting the deterioration of mango fruit during storage at room temperature by oxalate treatment. Food Chem 130:279-285 (2012a).