Nos enfrentamos a un enemigo del girasol que, aunque momentáneamente se encuentre controlado, tiene una gran facilidad para evolucionar a formas más virulentas, con un potencial efecto devastador sobre el cultivo
Situación actual del jopo del girasol en España
Leonardo Velasco, Belén Fernández-Melero, Lidia del Moral, Begoña Pérez-Vich
Instituto de Agricultura Sostenible (IAS-CSIC). Campus Alameda del Obispo, Córdoba.
lvelasco@ias.csic.es; bperez@ias.csic.es
03/06/2024El jopo del girasol (Orobanche cumana Wallr.) es una planta holoparásita que no produce clorofila y depende de una planta huésped para adquirir el agua y los nutrientes minerales y orgánicos requeridos para completar su ciclo vital. En la Península Ibérica, el jopo del girasol no está presente en la flora silvestre, sino que se encuentra únicamente en cultivos de girasol, la única especie cultivada a la que parasita. Es importante señalar que en ocasiones se ha confundido la especie O. cumana con la especie O. cernua, que sí se encuentra presente de forma silvestre en España, una confusión muy extendida en la literatura científica del siglo pasado. Aclaramos por tanto que en España encontramos O. cumana únicamente en campos de girasol, y O. cernua de forma silvestre (Pujadas-Salvà y Velasco, 2000).
Introducción
El jopo del girasol se distribuye de forma silvestre principalmente en el sudeste de Europa y sudoeste de Asia, alrededor del Mar Negro y el Mar Caspio, parasitando a algunas especies de la familia Asteraceae, principalmente del género Artemisia (Figura 1). Tras la introducción del cultivo de girasol en Rusia en la segunda mitad del siglo XIX, fue en 1890 cuando se observaron los primeros ataques de jopo en ese país, extendiéndose el parásito de forma paralela a la extensión del cultivo del girasol a países cercanos. Actualmente, el jopo del girasol está presente en casi todos los países de Europa y Asia donde se cultiva girasol, habiéndose extendido recientemente también al norte de África (Nabloussi y col., 2023). En el continente americano, esta planta parásita fue observada por primera vez en 2023, aunque su extensión es actualmente muy limitada.
En España, el jopo del girasol se detectó por primera vez en 1958 en la provincia de Toledo, sobre girasol de pipa blanca (González-Torres y col., 1982), extendiéndose a continuación por la zona girasolera de Castilla La Mancha, principalmente la provincia de Cuenca (CU). Posteriormente, en la década de 1970 comenzó a observarse en el Valle del Guadalquivir (VG).
Durante muchos años se pensó que el jopo se había movido desde CU al VG al iniciarse el cultivo de girasol de pipa blanca en la provincia de Sevilla, si bien nuestros datos apuntan a que no fue así, como veremos más adelante. Actualmente, se puede considerar que el jopo del girasol está bajo control en nuestro país gracias al cultivo de híbridos resistentes a jopo y/o resistentes a herbicidas, pero sigue siendo una amenaza latente que no puede perderse de vista debido a su gran potencial de dañar al girasol y mermar drásticamente la cosecha en los casos de fuertes ataques (Figura 2).
Un aspecto que resulta esencial para entender la evolución del jopo del girasol es que la interacción entre el girasol y el jopo responde en general a un modelo “gen a gen”, es decir, que la resistencia a jopo en el girasol suele estar determinada por un único gen dominante que interacciona con un gen de avirulencia, también dominante, en el parásisto. A este tipo de resistencia se le denomina cualitativa o vertical. Este sistema es diferente a las interacciones que se dan con otros tipos de jopo en cultivos como leguminosas, hortícolas, tabaco, o colza, en las que la resistencia suele estar controlada por varios genes, un tipo de resistencia denominada cuantitativa u horizontal. La resistencia de tipo vertical es más sencilla de manejar en los programas de mejora genética, pero tiene el inconveniente de que el parásito la supera con mayor facilidad.
La existencia de resistencia de tipo vertical frente al jopo del girasol determina también la existencia de razas fisiológicas del parásito. Por convención, estas se han denominado con una letra, desde “raza A” a la primera población que parasitó sobre girasol en Rusia en 1890, hasta “raza H” a las razas más agresivas existentes actualmente en los países del este de Europa. Este sistema de clasificación ya ha quedado algo obsoleto, aunque no hay aún acuerdo para sustituirlo. Para facilitar la nomenclatura, se ha empezado recientemente a añadir un subíndice para indicar la zona geográfica en la que está presente una determinada raza.

Figura 1. Planta de jopo del girasol (Orobanche cumana) creciendo silvestre sobre Artemisia marítima en la zona del Mar Negro de Bulgaria.
Evolución geográfica y racial de las poblaciones de jopo en España
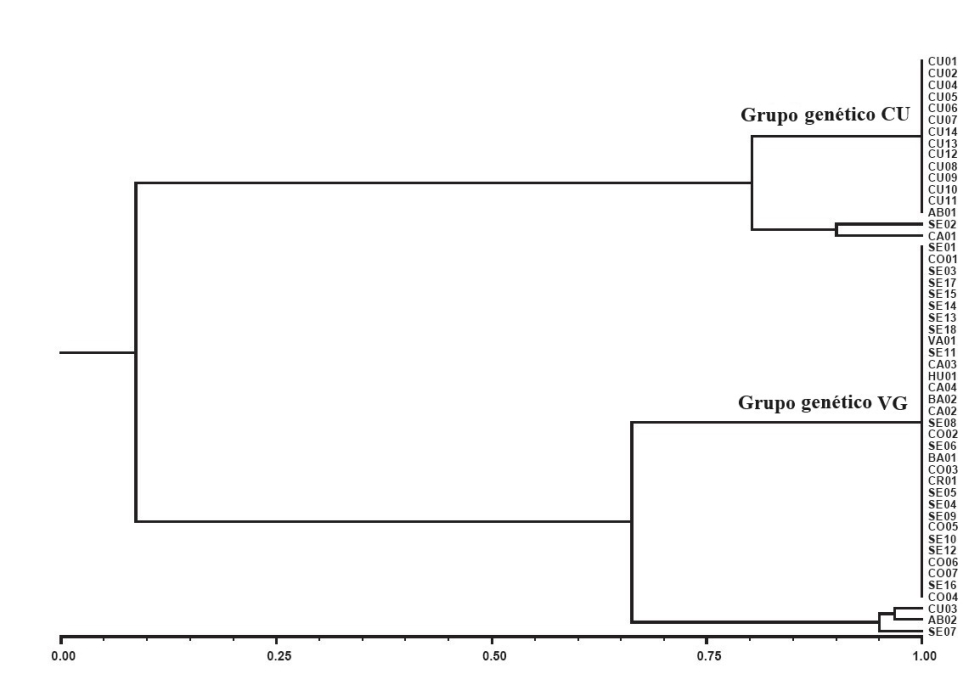
Como se ha indicado anteriormente, el jopo del girasol se identificó inicialmente en Castilla La Mancha y, unos años después, en el VG. Un estudio realizado en 2013 mostró que las poblaciones de ambas zonas eran muy diferentes genéticamente entre sí, y que dentro de cada zona las poblaciones eran extremadamente uniformes, constituyendo dos grupos genéticos diferenciados y con muy escasa variabilidad en cada uno de ellos. Estos datos apuntaban a dos introducciones independientes de semillas de jopo en nuestro país (Pineda-Martos y col., 2013). La Figura 3 muestra una gráfica tipo dendrograma en la que se aprecia la distancia genética existente entre las poblaciones con muy baja diversidad genética de los grupos genéticos de CU y del VG.
Los primeros estudios realizados a finales de los años 80 en poblaciones de CU y VG indicaron la presencia de poblaciones de razas C y D. Es a partir de 1992 cuando se empiezan a observar poblaciones de raza E en ambos grupos genéticos, y poblaciones de raza F a partir de 1994 (Alonso, 1998). A partir de entonces, la raza F se expande en ambas zonas, pero no se produce ninguna evolución racial adicional en las siguientes dos décadas. Debemos incidir en que, cuando hablamos de raza F del VG (FVG) y de CU (FCU), nos referimos a razas de poblaciones muy distantes genéticamente, aunque la correspondiente raza sea denominada con la misma letra. En el estudio mencionado de Pineda-Martos y col. (2013), todas las poblaciones analizadas pertenecía a las razas E y F. El hecho de que las poblaciones de raza F no mostraran mayor variabilidad intrapoblacional que las poblaciones de raza E, indicó que el cambio de virulencia de E a F en ambos grupos genéticos se debió muy probablemente a mutaciones puntuales en poblaciones de raza E.
Es en 2014 cuando se detectan por primerta vez en el VG poblaciones con capacidad de atacar a híbridos de girasol resistentes a la raza F. Para estudiar las causas de este incremento de virulencia, recolectamos cuatro poblaciones con estas características y analizamos su diversidad genética con marcadores moleculares de tipo SNP. Los resultados sugirieron que estas poblaciones eran el resultado de la mezcla y posterior recombinación genética entre individuos del grupo genético del VG e individuos del grupo genético de CU (Martín-Sanz y col., 2016).
Este fenómeno ya se había observado a pequeña escala en el estudio de Pineda-Martos y col. (2013), aunque sin consecuencias para la virulencia de las poblaciones (véanse las poblaciones SE02 y CA01 en la Figura 3). El estudio de Martín y col. (2016) sugirió que fue la recombinación genética de los alelos virulentos de las razas FVG y FCU lo que dio como resultado una mayor virulencia, que denominamos nueva raza GVG.
Si miran de nuevo la Figura 3, observarán la presencia de unas pocas poblaciones con mayor diversidad genética identificadas en el estudio de Pineda-Martos et al. (2013), no solo en el grupo genético del VG como hemos comentado antes, sino también en el grupo genético de CU. ¿Había ocurrido allí también el mismo proceso de incremento de virulencia asociado con la recombinación genética entre individuos de ambos grupos genéticos? Para responder a esta pregunta, analizamos recientemente diez poblaciones recolectadas en CU, tanto a nivel de diversidad genética como de virulencia (Fernández-Melero y col., 2023). Los resultados confirmaron que el proceso de recombinación ocurrido en el VG se está produciendo también en CU a gran escala en estos momentos, y que este proceso está dando lugar a poblaciones con similar virulencia a la de las poblaciones GVG identificadas unos años atrás.
Pero, adicionalmente, identificamos poblaciones que, sin haber visto incrementada su diversidad genética, mostraban un nuevo tipo de virulencia caracterizada por sobrepasar la resistencia de la fuente de resistencia “Deb2”, de la que hablaremos más adelante. Estas poblaciones no se pueden clasificar como raza G, ya que no sobrepasan la resistencia de los híbridos resistentes a raza F presentes en el mercado, que en general contienen el gen de resistencia Or7, pero sí sobrepasan la resistencia del gen OrDeb2. En consecuencia, a esa nueva forma de virulencia, no descrita hasta la fecha en ninguna otra zona del mundo y no asociada con un incremento de diversidad genética, se le ha denominado F+CU.
Llegados a este punto, los lectores de Castilla y León (CyL), principal zona girasolera de España en la actualidad, se estarán preguntando por la situación en su zona, en la que el jopo tardó bastante más tiempo en aparecer y que, posiblemente por las particularidades agroclimáticas de la región, no se percibe en la actualidad como una amenaza seria para el cultivo del girasol. Hemos de indicar que el estudio que realizamos en 2017 sobre seis poblaciones recolectadas en CyL (Malek y col., 2017) mostró que todas ellas pertenecían al grupo genético del VG, y que su virulencia correspondía a raza E (tres poblaciones) o raza F (tres poblaciones).
Aún así, una de las poblaciones, recolectada en el término municipal de Cantalejo (Segovia), mostraba recombinación genética con individuos del grupo genético de CU, algo que ya hemos visto que puede ser un mecanismo de incremento de virulencia. Resulta por tanto imprescindible hacer un seguimiento de las poblaciones de jopo de CyL para determinar la escala a la que se está produciendo la introducción de individuos desde el grupo genético de CU, así como su posible recombinación genética con individuos del VG.

El ciclo de vida del jopo del girasol
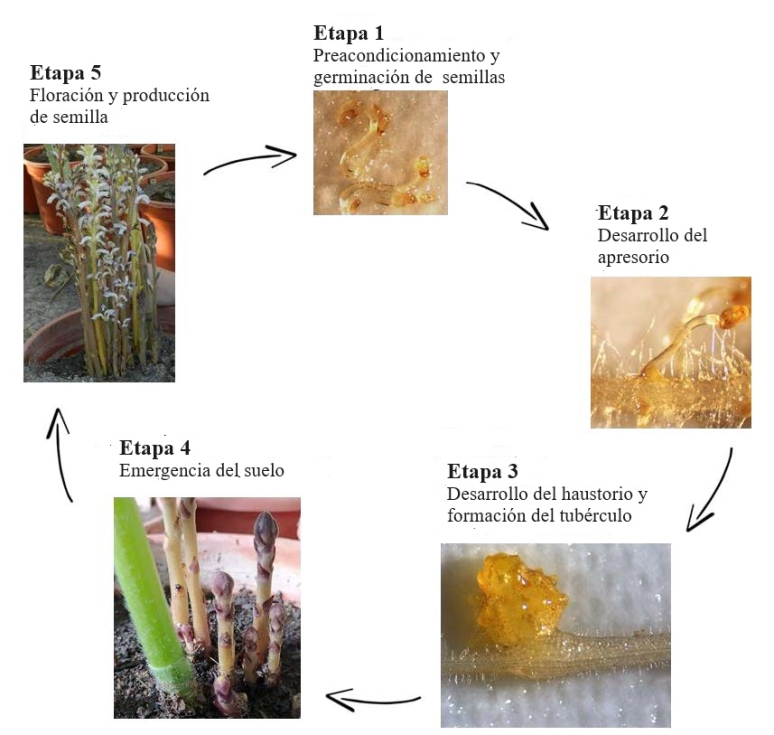
Las semillas de jopo se encuentran en el suelo y únicamente germinan si son inducidas a ello por sustancias que segregan las raíces del girasol. Una vez germinadas (Etapa 1; Figura 4), el tubo germinativo o procauloma contacta con la raíz del girasol, donde forma una estructura especializada denominada apresorio, que es la responsable de degradar la epidermis de la raíz para facilitar la penetración (Etapa 2). Tras la penetración, se forma el haustorio, que es la estructura parasitaria especializada en establecer las conexiones vasculares con el girasol para tomar de él agua y nutrientes, dando lugar a la formación del característico nódulo o tubérculo que se observa en las raíces del girasol en la etapas iniciales de la infección (Etapa 3).
Posteriormente, el tubérculo crece y se diferencian yemas, a partir de las que se forman los tallos que emergen a la superficie (Etapa 4). Estos tallos florecen y producen un nuevo lote de semillas que se acumulan en el suelo (Etapa 5), cerrando de esta forma el ciclo. Las semillas del jopo son minúsculas, y se producen por miles en cada planta, de ahí la gran capacidad de mutación en esta especie y, en consecuencia, de sobrepasar los mecanismos de resistencia en el girasol.
Nuevas fuentes de resistencia genética
Aunque existen tecnologías para controlar el jopo mediante el empleo de híbridos de girasol resistentes a herbicidas, no se debe perder de vista que la resistencia genética es el método más sostenible para controlar esta planta parásita. Si bien existen mecanismos de resistencia a jopo en girasol de tipo cuantitativo u horizontal, controlados por varios genes, vamos a centrarnos en esta breve exposición en los mecanismos de resistencia disponibles de tipo cualitativo o vertical, controlados por un único gen, que han sido caracterizados con mayor detalle.
El primer gen de resistencia que se estudió en profundidad fue el gen Or5, que ofrece resistencia a la raza E de jopo. Este gen está localizado en el cromosoma 3 del genoma del girasol. Un segundo gen, que ofrece resistencia a poblaciones de raza F de jopo, es el gen Or7, situado en el cromosoma 7. Tras la aparición de poblaciones de raza G, que superaban a los genes Or5 y Or7, nuestro grupo de investigación identificó un nuevo gen de resistencia en la especie silvestre de girasol H. debilis subsp. tardiflorus, denominado OrDeb2. Este gen proporciona resistencia a las poblaciones de raza G identificadas hasta la fecha, y está localizado en el cromosoma 4 del genoma del girasol (Fernández-Aparicio y col., 2022).
En la misma zona del genoma se encuentra otro gen, OrAnom1, recientemente identificado en la especie silvestre H. anomalus, que presenta un mecanismo de resistencia diferente comparado con OrDeb2 (Fernández-Melero et al., 2024), así como el gen OrSII, con un tipo de resistencia incompleta que detiene el crecimiento del jopo después de haberse establecido una conexión vascular efectiva entre el jopo y el girasol (Martín-Sanz et al., 2020). A esta batería de genes de resistencia hay que sumar otros, procedentes en su mayoría de especies silvestres de girasol, que se están estudiando en la actualidad.
Perspectivas futuras
Estamos observando que la dinámica de las poblaciones de jopo ha aumentado en los últimos años, con introducciones masivas de semillas de unas zonas en otras. Este proceso ya ha tenido como consecuencia el desarrollo de una nueva raza G en el VG, proceso que hemos observado que se está produciendo actualmente también en CU. No podemos descartar que el mismo proceso esté ocurriendo también en CyL, aunque carecemos de información al respecto. Este movimiento masivo de semillas de unas zonas a otras indica que no se están siguiendo las prácticas recomendadas de contención del parásito, por ejemplo la desinfestación de la maquinaria que se desplaza de unas zonas a otras. La identificación reciente de dos nuevas razas de jopo en España, GVG y F+CU, puede complicar la situación en los próximos años si se produce recombinación genética entre ambas.
Afortunadamente, las empresas de semillas disponen de genes de resistencia, tales como Or5, Or7, y OrDeb2, que permitirán controlar el jopo en los próximos años. Nuestro grupo de investigación, que ha contribuido de forma muy significativa a la lucha contra este parásito mediante la identificación y puesta a disposición de las empresas del gen OrDeb2, sigue trabajando activamente para identificar nuevos genes que permitan disponer de herramientas de defensa ante la eventualidad de la aparición de nuevas razas. El gen OrAnom1 acaba de ser caracterizado y puesto a disposición del sector, y trabajamos activamente para poner en valor fuentes de resistencia adicionales. En paralelo, desarrollamos una línea de investigación muy novedosa enfocada a estudiar los mecanismos que emplea el parásito para atacar al girasol y sobrepasar su resistencia.
Nos enfrentamos, en resumen, a un enemigo del girasol que, aunque momentáneamente se encuentre controlado, tiene una gran facilidad para evolucionar a formas más virulentas, con un potencial efecto devastador sobre el cultivo. Por este motivo, tanto las empresas de semillas como los organismos públicos de investigación estamos obligados a no bajar la guardia en busca de herramientas que permitan controlar esta mala hierba parásita a medio y largo plazo. De esta forma, aseguraremos la continuidad de un cultivo como el girasol, esencial para garantizar la sostenibilidad de nuestra agricultura.
Agradecimientos
Los estudios propios que citamos en este artículo se han desarrollado en su mayoría a través de numerosas colaboraciones nacionales e internacionales. Debemos expresar muy especialmente nuestro agradecimiento a Luis Carlos Alonso, Juan Fernández Escobar, y Alberto Martín Sanz, de Syngenta, y Stéphane Muños, del INRAE de Toulouse, Francia.
Literatura citada
Consultar con los autores