Nutripop: mejora de variedades ancestrales de leguminosas y cereales para el desarrollo de snacks

En el contexto actual se desarrolla el proyecto Nutripop, financiado por el Ministerio de Economía, Industria y Competitividad, y en el que participan dos empresas muy reconocidas en el ámbito agroalimentario, a saber, Grefusa S.L., Ramiro Arnedo, S.A., e investigadores de dos grupos expertos en biotecnología y mejora genética de plantas de la Universidad de Almería y la Misión Biológica de Galicia (MBG-CSIC). A nivel global, el objetivo primordial de este proyecto no es otro que desarrollar nuevos snacks basados en granos nutritivos de variedades ancestrales de leguminosas y cereales, una apuesta novedosa en el sector agroalimentario, cada vez más preocupado por la calidad nutricional de los alimentos y el carácter saludable de los mismos. En este artículo se reúnen algunos aspectos principales de la investigación reciente llevada a cabo en NUTRIPOP y algunos resultados relativos a la mejora de las variedades ancestrales de cereales y leguminosas utilizadas, y los productos alimenticios tipo snack que se están desarrollando.
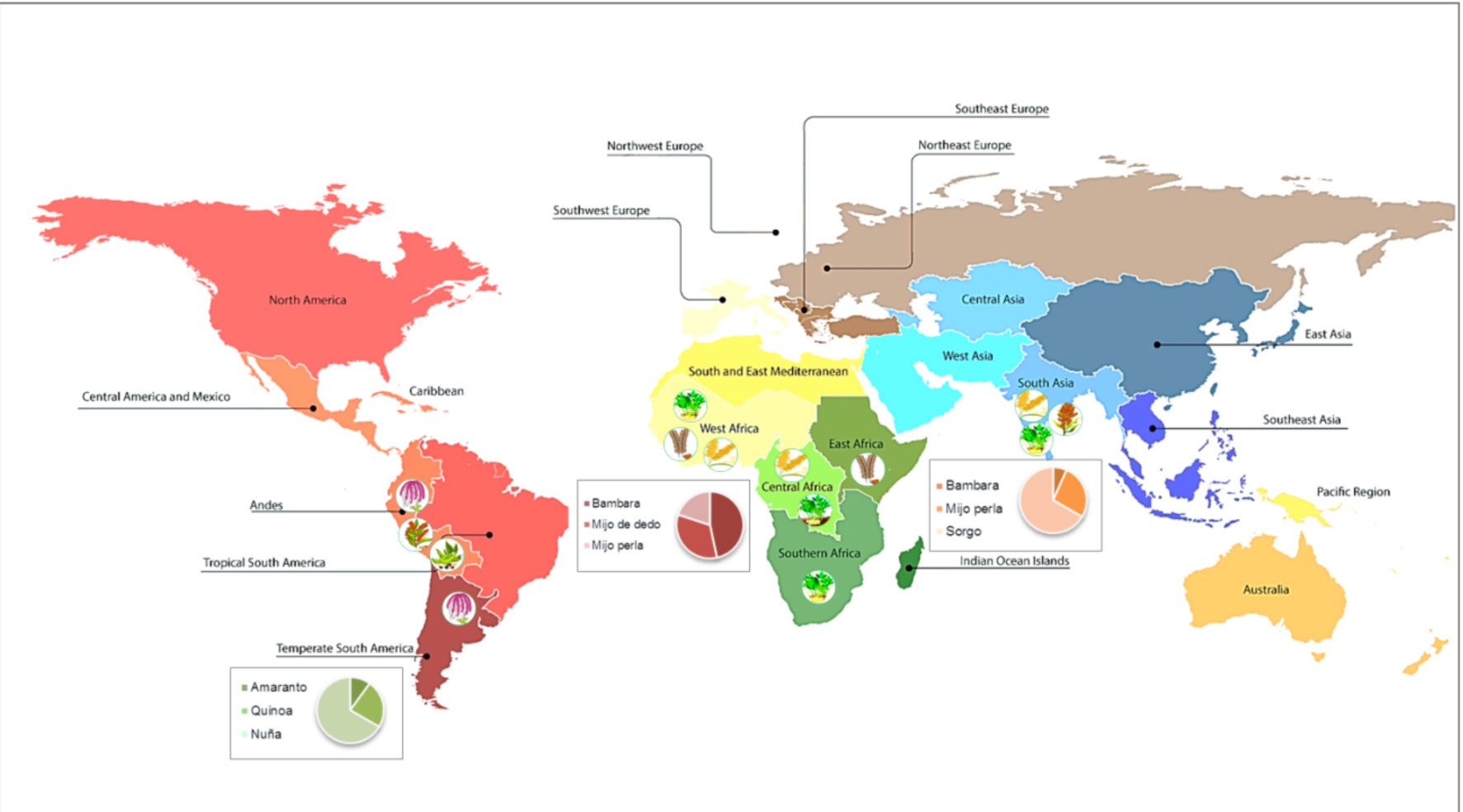
Agrodiversidad y dinámica de la expansión global de los cultivos ancestrales de leguminosas y cereales
Los granos de leguminosas y cereales en los que se ha centrado la investigación de NUTRIPOP proceden de cultivares muy antiguos, que ahora han irrumpido en el mercado como integrantes de una dieta saludable. A continuación se describen algunas de sus características.
Quínoa (Chenopodium quinoa). Es un cultivo andino que se cree fue domesticado a más de 3.500 metros sobre el nivel del mar en el interior del lago Titicaca. Su diversidad se asocia con cinco ecotipos o grupos de cultivares principales: altiplano (Perú y Bolivia), valles interandinos (Colombia, Ecuador y Perú), salare (Bolivia, Chile y Argentina), yunga (Bolivia) y costa (Chile). El germoplasma existente en cada ecotipo y los subcentros de diversidad se asume que ha descendido de un grupo central de cultivares locales domesticadas en el lago Titicaca (Risi y Galwey, 1984). Sin embargo, desde el punto de vista genético, estudios recientes afirman que existen dos acervos genéticos de germoplasma, a saber, el acervo andino y el central-sur de Chile (Jellen et al., 2011), siendo probablemente su grado de sensibilidad al fotoperiodo el factor más destacado que caracteriza a cada grupo.

Amaranto (Amaranthus hypochondriacus, A. cruentus y A. caudatus). Las tres especies de amaranto difieren en su distribución geográfica. Amaranthus hypochondriacus y A. cruentus son originarias de América Central, México y Guatemala, mientras que A. caudatus procede de Sudamérica, Perú y otros países andinos como Bolivia, Ecuador y Argentina, donde recibe el nombre de “kiwicha”. Al igual que sucedió con la quínoa, su cultivo disminuyó fuertemente después de la conquista española (Brenner et al., 2010).
Judía nuña (Phaseolus vulgaris). El cultivo de esta leguminosa se originó en las tierras altas andinas de Sudamérica, Perú y Bolivia principalmente, entre 2.000 y 3.000 m sobre el nivel del mar (Tohme et al., 1995), y algunos cultivares se consumen tradicionalmente como snack después del reventado del grano, proceso que se realiza mediante tostado a altas temperaturas (carácter denominado “pop”).
Sorgo (Sorghum bicolor). Este cereal parece que fue domesticado en el noreste de África, al norte del Ecuador, aproximadamente hace 5.000 años. Posteriormente, su cultivo se extendió a través de África y Asia, en una amplia gama de ambientes. El sorgo bicolor engloba a tres subespecies: S. bicolor subsp. bicolor, S. bicolor subsp. drummondii y S. bicolor subsp. verticilliflorum. El sorgo que se cultiva hoy día pertenece a la subespecie bicolor e incluye varios tipos agronómicos, entre ellos sorgo de grano, sorgo dulce, forraje y palomita.
Mijo perla (Pennisetum glaucum) y Mijo dedo (Eleucine coracana). El mijo perla fue domesticado hace más de 4.000 años, probablemente en lo que ahora es el corazón del desierto del Sahara, y se extendió hasta el este de África y la India (Oumar et al., 2008). Por su parte, la domesticación del mijo dedo comenzó hace unos 5.000 años en el oeste de Uganda y las tierras altas de Etiopía, y el cultivo se propagó a la India alrededor del año 3.000 aC (Hilu y de Wet, 1976; Hilu et al., 1979).
Bambara groundnut (Vigna subterránea). El maní bambara se cultiva en muchos países africanos semiáridos, como Ghana, Nigeria y Sudáfrica, con un centro de cultivo secundario en el sudeste asiático (Massawe et al., 2002; Basu et al., 2007).
La conservación de semillas ancestrales de las zonas de origen
Adaptación de los cultivos ancestrales de leguminosas y cereales a las condiciones edafo-climáticas europeas
El amaranto se ha cultivado tradicionalmente en regiones comprendidas entre el ecuador y los 30º de latitud norte, aunque puede ser cultivado en latitudes mayores, utilizando materiales que no sean sensibles al fotoperiodo y florezcan en días cortos (Brenner et al., 2010). A nivel mundial, China es el principal productor de amaranto, y le siguen India, Perú, México y Estados Unidos.
El sorgo se cultiva ampliamente en todo el mundo y ocupa el quinto lugar entre los principales cultivos de cereales en términos de producción y superficie cultivada (Faostat, 2015). Al igual que el arroz y el maíz, el sorgo suele madurar en aproximadamente cuatro meses.
Aunque el cultivo de judía común se ha extendido por todos los continentes durante los últimos siglos, lo que ha dado lugar a una compleja estructura genética fuera de sus áreas de origen y domesticación (Mesoamérica y Sudamérica), la falta de germoplasma de judía nuña insensible a la duración del día es probablemente uno de los factores biológicos que ha restringido su producción y comercialización en las regiones templadas (Kmiecik y Nienhuis 1997; Ogg et al., 1998).
Aunque infrautilizado, el cultivo de mijo es importante en regiones tropicales y semiáridas del mundo, al combinar caracteres favorables como la resistencia a plagas y enfermedades, una buena adaptación a un amplio rango de ambientes, un rendimiento aceptable, cierta tolerancia a salinidad y sequía, ciclos cortos de crecimiento, y menor requerimiento de insumos durante el crecimiento. En el mundo, el mijo dedo ocupa el cuarto lugar en importancia después del sorgo, el mijo perla y el mijo de cola de zorra. Se cultivan ampliamente en África y el sur de Asia, en condiciones agroclimáticas diferentes, y se estima que alrededor del 10% de los 30 millones de toneladas de mijo que se producen en el mundo es mijo dedo (Upadhyaya et al., 2007; Dida et al., 2008).
El cultivo de bambara, más allá de sus dos centros de cultivo actuales, presenta potencial para ser cultivado en otros ambientes con un clima mediterráneo, y principalmente en países como Italia, Portugal, España y Grecia (Azam-Ali et al. 2001). Además, el cultivo puede desarrollarse en suelos pobres en nutrientes donde la mayoría de los cultivos no prosperarían. El control del fotoperiodo es esencial para un crecimiento adecuado, ya que afecta principalmente al establecimiento y llenado de la vaina (Brink, 1997; Kendabie et al., 2012).
Requerimientos ambientales en diferentes zonas de producción españolas

Calidad nutricional, procesos tradicionales e innovaciones tecnológicas
En este sentido, el desarrollo de snacks, que constituye una de las áreas importantes de la industria alimentaria, debe adaptarse a estas preferencias cambiantes de los consumidores, donde el uso de diferentes tecnologías y productos (granos de leguminosas y cereales) permite incorporar caracteres nutritivos y saludables propiciando con ello alimentos innovadores tipo snack.
Los procesos de reventado e inflado de los granos secos obedecen a métodos convencionales de procesamiento de alimentos utilizados para la preparación de palomitas de maíz, arroz reventado e inflado, sorgo reventado, soja tostada y otras leguminosas, y son muy populares en todo el mundo (Anderson, 1971; Jaybhaye et al., 2014). La expansión y el reventado es un proceso en el cual los granos secos se calientan hasta que la humedad interna promueve la expansión del grano, lo que a su vez permite la salida del poco de agua (vapor) que contiene, a través de la capa exterior (Arkhipov et al., 2005). Por su parte, durante el inflado tiene lugar la liberación repentina de vapor de agua y expansión del núcleo pregelatinizado (Sullivan y Craig 1984; Hoke et al., 2007). Sin embargo, en estos procesos, no todos los granos revientan bien, y entre los factores que influyen se encuentran los de naturaleza genética (el cultivar) y el procedimiento tecnológico utilizado (Mirza et al., 2014).
Estudio de la calidad nutricional de los diferentes granos de cereales y leguminosas
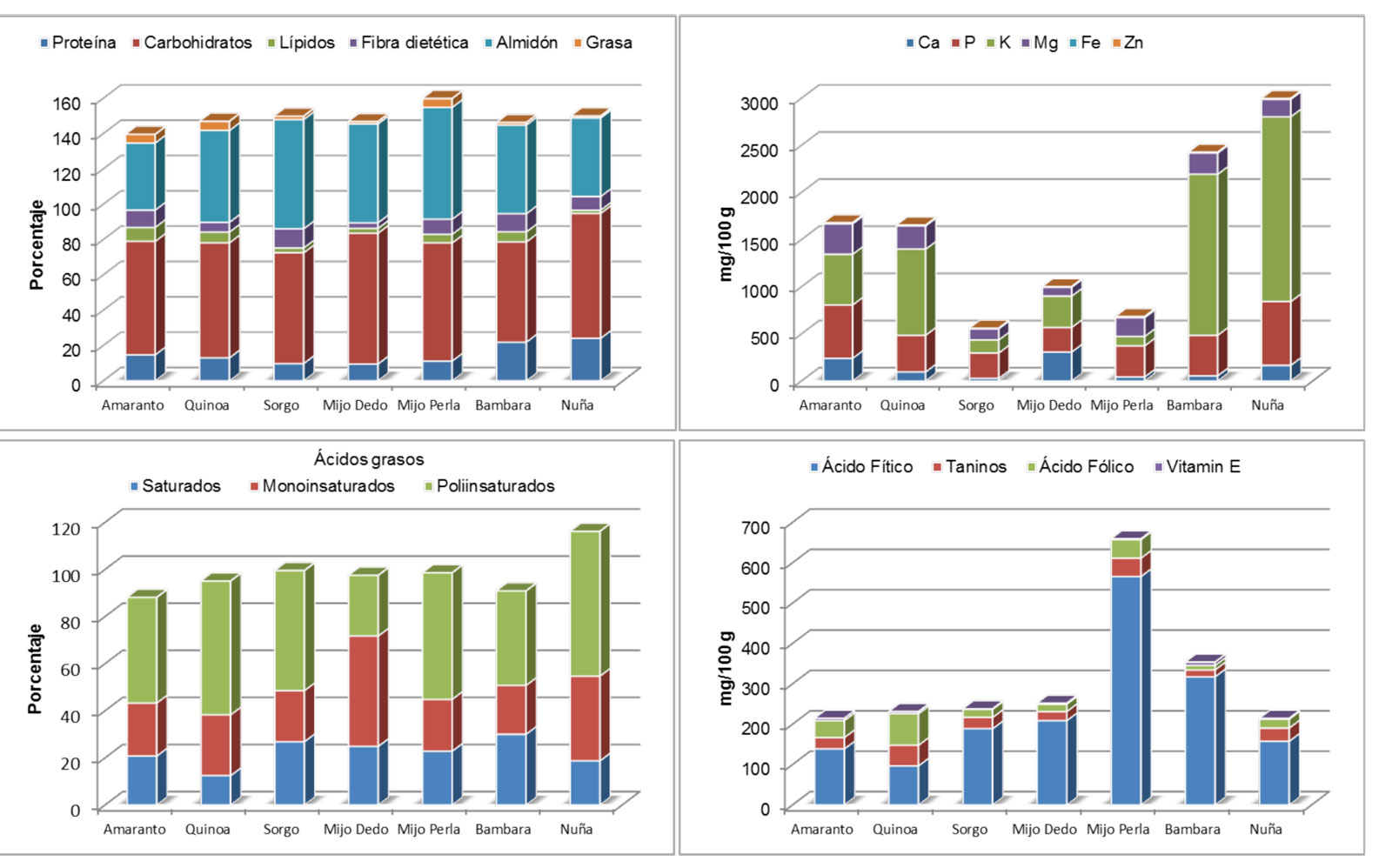

Cabe esperar que la investigación llevada a cabo en NUTRIPOP permita el desarrollo de nuevos productos snack a partir de la utilización de variedades mejoradas de los cultivos de leguminosas y cereales en zonas de producción españolas, lo que a su vez abriría la puerta a nuevos mercados en el sector agroalimentario.
Agradecimientos
Este trabajo fue financiado por el Ministerio de Economía, Industria y Competitividad (proyecto RTC2016-4941- NUTRIPOP) y el programa UE-FEDER. Los autores agradecen al Campus de Excelencia Internacional Agroalimentario - CeiA3 y al Contrato-Programa de la Xunta de Galicia el apoyo en actividades de I+D+i.
Referencias bibliográficas
- Anderson, W.T. 1971. Identifying the convenience oriented consumer. J. Mark. Res., 8: 179-183.
- Arkhipov, A., Becker, C., Bergamo, D., Demtchouk, V., Freddo, A., Kreider, E., Lee, M., Montalbano, J., Richards, D., So, E., Wang, J. 2005. Accessed from http://depts.drew.edu/govsch1/NJGSS.2005/journal /Team Paper/T3-popcorn.pdf.
- Azam-Ali, S.N., Sesay, A, Karikari, S.K, Massawe, F.J., Anguilar-Manjarrez, J., Bannayan, M., Hampson, K.J. 2001. Assessing the potential of under-utilized crop – A case study using Bambara groundnut. Exp. Agric., 37: 433-472.
- Basu, S., Mayes, S., Davey, M., Roberts, J.A., Azam-Ali, S.N., Mithen, R., Pasquet, R.S. 2007. Inheritance of ‘domestication’ traits in Bambara groundnut (Vigna subterranea (L.) Verdc.). Euphytica, 157: 59–68. doi: 10.1007/s10681-007-9396-4.
- Bazile, D. et al. (Editores), 2014. Estado del arte de la quinua en el mundo en 2013: FAO (Santiago de Chile) y CIRAD, (Montpellier, Francia), 724 pp.
- Brenner, D. M., Baltensperger, D. D., Kulakow, P. A., Lehmann, J. W., Myers, R. L., Slabbert, M. M., et al. 2010. Genetic resources and breeding of Amaranthus. In Plant Breeding Reviews, Vol. 19 (New York, NY: John Wiley & Sons, Inc.), 227–285. doi: 10.1002/9780470650172.ch7.
- Brink, M. 1997. Rates of progress towards flowering and podding in bambara groundnut (Vigna subterranea) as a function of temperature and photoperiod. Ann. Bot., 80: 505-513. doi: 10.1006/anbo.1997.0479.
- Cusack, D.F. 1984. Quinoa: grain of the Incas. Ecologist, 14: 21-31.
- Dida, M.M., Wanyera, N., Dunn, M.L.H., Bennetzen, J.L., Devos, K.M. 2008. Population structure and diversity in finger millet (Eleusine coracana) germplasm. Trop. Plant Biol., 1 (2): 131-141. doi: 10.1007/s12042-008-9012-3
- Food and Agriculture Organization of the United Nations (FAOSTAT). Rome, 2015. http://www.fao.org/3/a-i4691e.pdf
- Gómez, L., Aguilar, E. (Ed). 2016. Guía de cultivo de la quinua. Lima (Perú) http://www.fao.org/3/a-i5374s.pdf.
- Hilu, K.W, de Wet, J.M.J. 1976. Domestication of Eleusine coracana. Econ. Bot. 30(3): 199–208.
- Hilu, K.W., de Wet, J.M.J., Harlan, J.R. 1979. Archaeobotanical studies of Eleusine corocana ssp. corocana (finger millet). Am. J. Bot., 66(3): 330-333.
- Hoke, K., Houska, M., Jirina, P., Gabrovska, D., Vaculova, K., Paulickova, I. 2007. Optimization of puffing naked barley. J. Food Eng., 80: 1016-1022. doi:10.1111/ijfs.13011.
- Jacobsen, S.E., 2003. The Worldwide Potential for Quinoa (Chenopodium quinoa Willd.). Food Rev. Int., 19(1-2): 167-177. doi.org/10.1081/FRI-120018883.
- Jaybhaye, R.V., Pardeshi, I.L., Vengaiah, P.C., Srivastav, P.P. 2014. Processing and technology for millet based food products: a review. J. Ready Eat Food, 1(2): 32-48.
- Jellen, E.N., Kolano, B.A., Sederberg, M.C., Bonifacio, A., Maughan, P.J. 2011. Chenopodium. En C. Kole, ed. Wild Crop Relatives: Genomic and Breeding Resources. p. 35-61. Berlin, Springer.
- Kendabie, P., Holdsworth, M., Mayes, S. 2012. Understanding photoperiod requirements for reproductive development in bambara groundnut (Vigna subterranea). Poster presentation 2012 World Food Congress.
- Kmiecik, K., Nienhuis, J. 1997. Development of nuña beans with temperate zone adaptation. Annu. Rpt. Bean Improv. Coop., 40: 36–37.
- Massawe, F.J., Dickinson, M., Roberts, J.A., Azam-Ali, S.N. 2002. Genetic diversity in bambara groundnut (Vigna subterranea (L.) Verdc) landraces revealed by AFLP markers. Genome, 45: 1175-1180. doi:10.1139/g02-093.
- Mirza, N., Sharma, N., Srivastava, S., Kuma, A. 2014. Variation in popping quality related to physical, biochemical and nutritional properties of Finger Millet genotypes. Proc. Natl. Acad. Sci., India Section B: Biological Sciences, 1-9.doi:10.1007/s400011-014-0384-x.
- National Research Council (NRC). 1989. Lost Crops of the Incas: Little Known Plants of the Andes with Promise for Worldwide Cultivation. Washington D.C., Natl. Acad. Press.
- Ogg, B., Brick, M.A., Pearson, C. 1998. Introgression of popping ability into dry beans adapted to Colorado. Annu. Rpt. Bean Improv. Coop., 41:35–36.
- Oumar, I., Mariac, C., Pham, J.L., Vigouroux, Y. 2008. Phylogeny and origin of pearl millet (Pennisetum glaucum [L.] R. Br) as revealed by microsatellite loci. Theor Appl Genet. 117(4):489-97. doi: 10.1007/s00122-008-0793-4.
- Risi, J.C., Galwey, N.W. 1984. The Chenopodium grains of the Andes: Inca crops for modern agriculture. Adv. Appl. Biol., 10: 145-216.
- Sullivan, J.F., Craig, J.D. 1984. The development of explosion puffing. Food Technol., 38(2): 52-55.
- Tohme, J., Toro, O.C., Vargas, J., Debouck, D. 1995. Variability in Andean nuña common beans (Phaseolus vulgaris, Fabaceae). Econ. Bot., 49 (1): 78–95. doi: 10.1007/BF02862280.
- Upadhyaya, H.D., Gowda, C.L.L., Reddy, V.G. 2007. Morphological diversity in finger millet germplasm introduced from Southern and Eastern Africa. J. SAT Agric. Res., 3 (1): 1-3.

























