Un estudio europeo constata que el nivel de acceso a los nuevos medicamentos en España es inferior al de los países de nuestro entorno
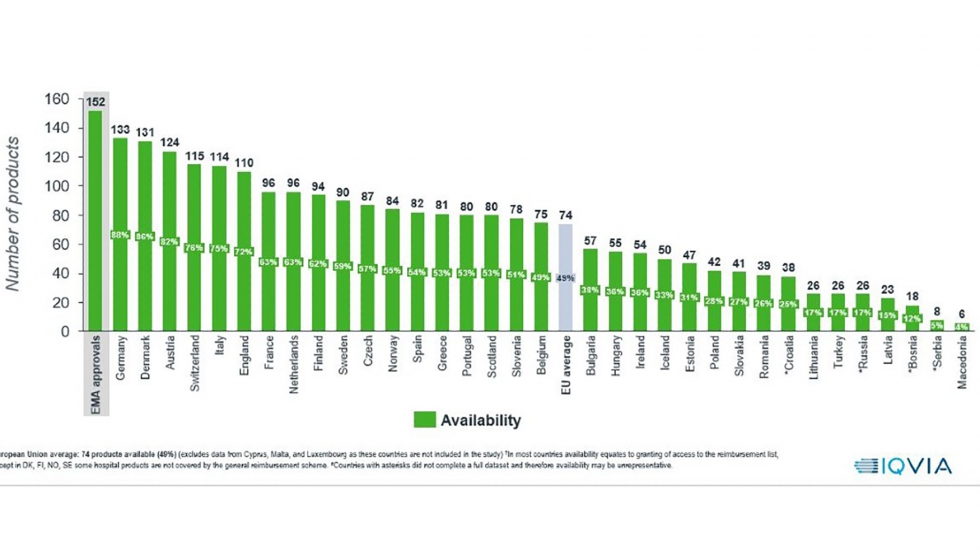
El nivel acceso de los pacientes españoles a los nuevos medicamentos está en la media europea, pero es inferior al de los grandes países de la UE, según el informe anual Indicadores de acceso a terapias innovadoras en Europa (W.A.I.T. Indicator), elaborado por la consultora Iqvia para la Federación Europea de Asociaciones de la Industria Farmacéutica (Efpia), que hoy se ha hecho público y que observa una distancia notable entre España y el resto de los grandes países europeos.
Así, la disponibilidad, es decir, el momento en que un nuevo medicamento es incluido en la financiación pública y a disposición de los pacientes, es la más baja de los grandes mercados: a 31 de diciembre de 2020 estaban disponibles en España 82 medicamentos de los 152 autorizados en Europa en el periodo 2016-2019. Son el 54%, frente al 88% en Alemania, el 75% en Italia, el 73% en Francia y el 72% en el Reino Unido. La media de los 34 países europeos se sitúa en el 49%. En los datos publicados se refleja también la peor situación de España en áreas significativas como los medicamentos oncológicos y huérfanos.
Algo parecido ocurre con los tiempos de aprobación, que son los días que transcurren desde que el medicamento recibe la autorización de comercialización en la Unión Europea hasta que se incluye en la lista de reembolso (financiación pública) en cada país. En España, el tiempo medio de aprobación es de 453 días, frente a los 120 de Alemania, los 257 días de Francia, los 335 del Reino Unido y los 418 de Italia. La media de los 34 países europeos se sitúa en 504 días.
Con respecto al informe publicado en 2019, los indicadores de disponibilidad en nuestro país empeoran en 2020, mientras que, salvo en Francia, en los grandes países europeos (UE-5) y el vecino Portugal mejoran.
“De nada sirve desarrollar el mejor medicamento si éste no llega al paciente que lo necesita”, afirma Humberto Arnés, director general de Farmaindustria. “Después de los largos procesos de I+D de los nuevos medicamentos que suponen una mejora en el tratamiento de las enfermedades, es responsabilidad de todos ponerlos a disposición de los pacientes en el plazo más corto posible”, señala, y recuerda la colaboración constante del sector con la Administración a lo largo de los años para conciliar el acceso al medicamento con la sostenibilidad financiera del sistema sanitario. “España debe aspirar a estar entre los países que mejor acceso proporcionan a estas nuevas terapias -sostiene- y debemos trabajar con el Ministerio de Sanidad para conseguir este objetivo común, superando los cuellos de botella actuales”.
Los datos del informe europeo muestran también las grandes diferencias que hay entre los países. Así, los tiempos de aprobación van de los 120 días de Alemania a los 883 de Rumanía. Desde la Efpia se insiste en que “la industria comparte la preocupación por los retrasos, que dañan a los pacientes” y se apuntan razones multifactoriales, que solo pueden resolverse con la colaboración de todos los stakeholders.

































