Pacientes y médicos perciben mejor que reguladores y administraciones públicas el valor añadido que aporta la innovación incremental en medicamentos
Diferencias de evaluación
El informe, que propone un cambio terminológico para comenzar a hablar de innovación terapéutica centrada en las personas en lugar de incremental, analiza cómo ha sido contemplado históricamente en Europa el valor de estos nuevos fármacos desde una perspectiva integral, no sólo clínica, por las administraciones públicas y otros agentes decisores en materia de precio y reembolso. Y lo hace considerando las diferencias de evaluación entre distintos productos, áreas terapéuticas y países.
Entre los productos analizados por Iqvia hay varios casos paradigmáticos de innovación incremental: un inhalador que combina dos fármacos de administración conjunta; un tratamiento de cuatro moléculas concentrado en una sola pastilla diaria; un antidiarreico que, una vez aprobado, se muestra efectivo contra la encefalopatía hepática, o la combinación de tramadol y paracetamol en un solo comprimido para mejorar la adherencia al tratamiento contra el dolor.
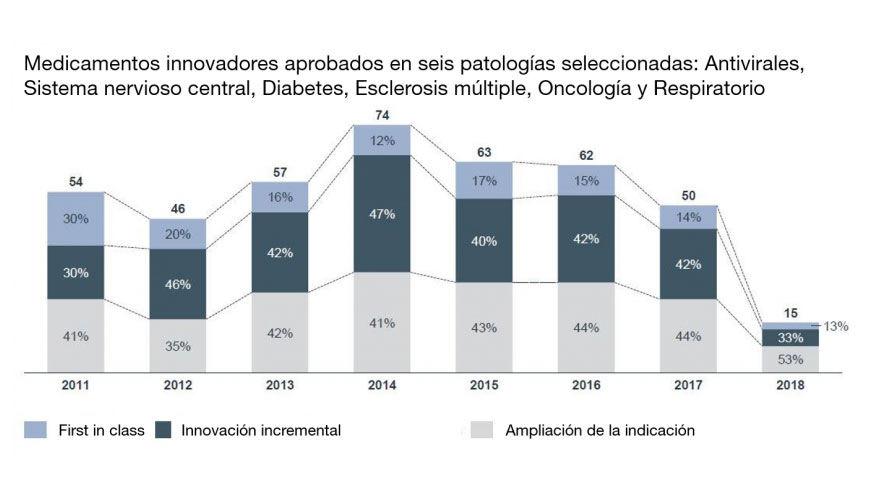
En general, según explica el informe, médicos y pacientes reconocen la notable aportación terapéutica de estas innovaciones y las sitúan al mismo nivel en términos de valor añadido que a los fármacos que presentan mecanismos de acción completamente nuevos. En cambio, como puede observarse en el siguiente gráfico, reguladores y pagadores, mientras sí reconocen el valor añadido a esos medicamentos radicalmente innovadores, se resisten a hacerlo con las distintas fórmulas de mejora que se agrupan bajo el concepto de innovación incremental.

La baja estima que pagadores y reguladores tienen de estos fármacos impacta directamente en los procesos de aprobación y fijación de precio. La media de las decisiones de las agencias nacionales al respecto es siempre inferior al precio fijado para el medicamento de referencia en esa indicación, llegando a reducciones de entre el 15% y el 20% en países como Italia, España, Suecia y Holanda.
En consecuencia, la falta de consideración de todos los beneficios reales, no sólo clínicos, que genera la innovación incremental supone un obstáculo para el acceso de los pacientes a estos medicamentos que, al final del proceso de aprobación y fijación de precio, o no son incluidos en la prestación farmacéutica pública o, si lo son, es a precios tan bajos que su lanzamiento y producción no resulta de interés para la compañía farmacéutica que ha invertido tiempo y dinero en su desarrollo.
Ante esta realidad, el estudio propone que pacientes y profesionales sanitarios participen en los procesos de evaluación de tecnologías sanitarias, incluir en esa evaluación información sobre la experiencia de uso del producto, incorporar información adicional de un fármaco tras su lanzamiento que permita reevaluarlo y considerar mejor el valor global que aporta, junto a la consideración por parte de los reguladores y pagadores de la opinión de otros agentes del sector (pacientes, profesionales sanitarios, etcétera) para la fijación del precio más justo.

































