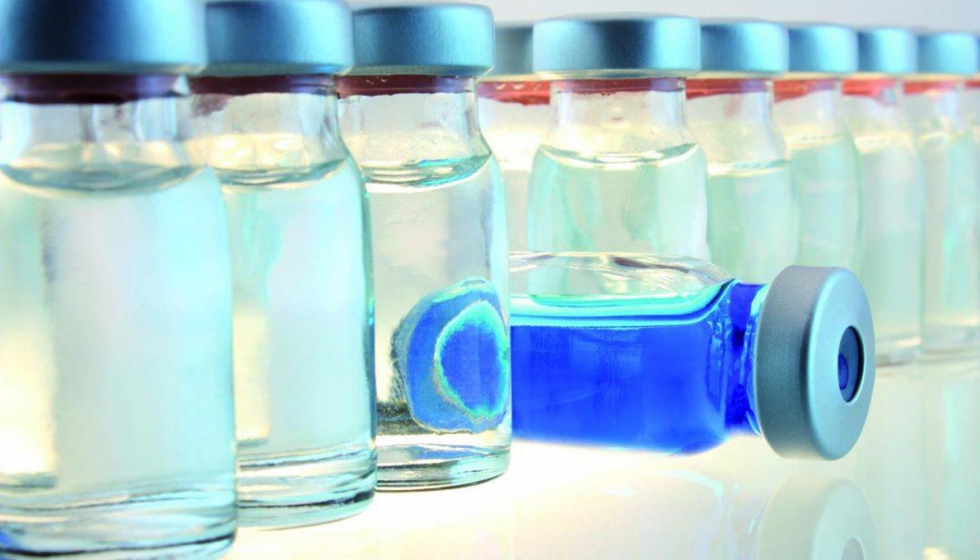
Assi está en constante contacto con las nuevas actualizaciones de la monografía de la Farmacopea Europea sobre WFI
Cambios de normativa de la EMA: Agua para inyección (WFI)
Estas actualizaciones referentes al agua para inyectables se encuentran en el documento ‘Concept paper on the need for revisión of note for guidance on quality of water for pharmaceutical use’, en la nueva versión de la Farmacopea 9.1 de abril de 2017 y en el apartado 5.1.10 'Guidelines for using the test for bacterial endotoxins', publicado en la Farmacopea Europea 26.4.
Los cambios en el proceso de fabricación de este tipo de agua son de vital importancia debido a que el agua es la materia prima mayoritaria utilizada en la Industria Farmacéutica para medicamentos administrados por vía parenteral.
¿Qué cambios ha llevado a cabo la EMA para la fabricación del agua para inyectables?
La principal novedad en esta nueva normativa es la incorporación de la producción de agua para inyectables por osmosis inversa, en un paso o en varios, combinada con otras técnicas de purificación como pueden ser la electrodesionización, la ultrafiltración o la nanofiltración dependiendo del proceso productivo. En Europa, anteriormente, solo se podía producir el agua para inyectables por destilación.
Este proceso de producción de agua para inyectables por osmosis inversa no es desconocido en la Industria Farmacéutica puesto que las farmacopeas de Estados Unidos y de Japón ya contemplaban este proceso de producción como se observa en la Figura 1.
|
Normativas |
Agua para inyectables |
|
Obtención |
|
|
Farmacopea Europea (Ph.Eur) |
Destilación.Las superficies de contacto con el agua son de vidrio neutro (borosilicato), de cuarzo o de metal. La primera fracción de destilado debe rechazarse. |
|
Farmacopea Americana (USP) |
Destilación u ósmosis inversa. |
|
Farmacopea Japonesa (JP) |
Destilación u ósmosis inversa. |
|
Usos |
|
|
Usos en la Industria Farmacéutica |
En el lavado de equipos de utilización para preparados estériles Como excipiente de los preparados estériles destinados a administración por vía parenteral En la preparación de alguno productos químicos de utilización en la industria farmacéutica |
Estos cambios se han incorporado en la Farmacopea Europea en abril del 2017 en la publicación de la nueva versión de la Farmacopea 9.1 donde ya se indica el cambio en el método de producción del agua para inyectables.
Esta nueva modificación en la producción de agua para inyectables sigue manteniendo la necesidad de tener validados los distintos sistemas de producción de agua para inyectables como se establece en la Industria Farmacéutica.
¿Qué ventajas e inconvenientes implican el cambio en el método de fabricación del agua para inyectables?
En primer lugar, fabricar agua para inyectables por osmosis inversa unido a un proceso de purificación tiene costes inferiores de instalación y mantenimiento frente a los costes de fabricar el agua para inyectables mediante destilación debido a que las membranas son más baratas.
También hay que considerar que los sistemas de producción de agua a través de la osmosis inversa tienen un volumen más pequeño que los sistemas de producción de agua a través de la destilación. Esta ventaja permite ahorrar espacio en las zonas técnicas de las fábricas y utilizar este espacio con otras instalaciones que pudiesen ser necesarias.
Aunque el sistema de producción por osmosis inversa presenta múltiples ventajas, hay que tener presente que producir agua para inyectables por este método no asegura el cumplimento de los límites microbiológicos y de endotoxinas. Por tanto, implica un mayor control por parte de los fabricantes tanto en los análisis microbiológicos como en los análisis de Conductividad y TOC (Total Organic Carbon) del agua para inyectables para asegurar su correcta producción. Este mayor control del agua provoca la necesidad de generar más documentación y se debe justificar mucho mejor la validación y la operativa habitual a las autoridades competentes.
Nueva política en el test de endotoxinas
La nueva política de endotoxinas ha introducido cambios de vital importancia para la producción del agua para inyectables debido a que es necesario tomar medidas estrictas para el control microbiológico en las formas farmacéuticas que se administran por vía parenteral.
En el capítulo de la monografía 5.1.10 'Guidelines for using the test for bacterial endotoxins' de la Farmacopea Europea se indica que los fabricantes tienen la responsabilidad de fijar los límites de endotoxinas basándose en las diferentes vías de administración y en las distintas poblaciones de pacientes.
El cálculo de límite de endotoxinas para principios activos que se administran por vía parenteral se realiza a través de la fórmula expresada a continuación en la Figura 2.
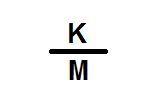
Figura 2: Cálculo del límite de endotoxinas para principios activos administrados por vía parenteral.
K: Límite de dosis pirogénica de endotoxina por kilogramo de masa corporal.
M: Máxima dosis recomendada de producto por kilogramo de masa corporal.
Los valores de la constante K para las distintas vías de administración se pueden observar en la siguiente tabla, Figura 3.
|
Ruta de Administración |
K |
|
Intravenosa |
5.0 IU de endotoxinas por Kilogramo de masa corporal |
|
Intravenosa por radiofármacos |
2.5 IU de endotoxinas por Kilogramo de masa corporal |
|
Intratecal |
0.2 IU de endotoxinas por Kilogramo de masa corporal |
|
Formulaciones parenterales administradas por metro cuadrado de superficie de cuerpo. |
100 IU / m2 |
Para otras vías de administración, el criterio aceptable en el test de endotoxinas está determinado por la base de resultados obtenidos durante el desarrollo de la preparación.
El resultado de estos límites de endotoxinas expresados en las distintas monografías puede ser menor a los fijados por los fabricantes. En cualquier caso, los fabricantes tienen la posibilidad de modificar los límites siempre cuando los justifiquen a través de los cálculos especificados en la monografía.
Otro factor importante para el cálculo del límite de endotoxinas es la formulación del producto debido a que tendremos distintos límites de endotoxinas. El límite de endotoxinas debe tener en cuenta el aporte de endotoxinas por parte de cualquier otro componente utilizado para la reconstitución o dilución del producto o introducido por materiales de partida o materias primas.
Por último, también se incluye el uso de posibles métodos alternativos para la realización del test de endotoxinas bacterianas donde no se usen animales vivos. Uno de estos métodos es el ensayo con el factor C recombinante frente al que se hacía anteriormente del Lisado de Amebocitos de Limulus (LAL).