Seguimiento microbiológico en industrias del sector cárnico
Rodríguez1 E., Reina1, E., Alonso2, J.L. y Salvadó, H.3
1Grupo Bioindicación de Sevilla (GBS). gbs@asociaciongbs.com
2Universitat Poliècnica de València. jalonso@ihdr.upv.es
3Universidad de Barcelona. hsalvado@ub.edu
28/05/2020Introducción
Los mataderos son una actividad inherente al desarrollo humano, donde abundan fábricas de pequeño tamaño con gran impacto ambiental. El sacrificio, despiece y manufactura de los productos cárnicos genera caudales elevados de aguas residuales, procedentes de la limpieza de los equipos, escaldado, lavados de los animales, y aguas de servicio, de composición muy diversa y compleja (Carrasquero et al., 2015) y con elevados niveles de carga orgánica biodegradable, ricas en grasas, sangre y nutrientes (Caldera et al., 2010; Jia et al., 2012; Bustillo-Lecompte y Menvar, 2015; Pedrazani et al., 2016) que deben ser tratadas de manera correcta antes de su vertido a cauce público.
Por otra parte, hay diversos factores que repercuten directamente en la carga orgánica afluente:
- La variabilidad asociada a la estacionalidad o a las diversas fases de producción puede generar desviaciones temporales importantes que dificultan su tratamiento.
- El grado de recuperación de subproductos, como es el caso de sangre o grasas, van a ser factores determinantes que van a repercutir en variaciones importantes en las cargas de demanda química de oxígeno (DQO). Según Carrasquero et al., 2015 la recuperación de sangre reduce la carga contaminante en un 42%.
- El nivel de temperatura del vertido que puede suele ser elevada. Se mejora la eficiencia del proceso a temperaturas de 30 °C (Jiu et al., 2012)
- El uso o no de detergentes y desinfectantes en el procesado que pueden generar problemas de biodegradabilidad y toxicidad
Para conseguir los niveles de depuración exigibles que pueden incluir la eliminación de nitrógeno y fósforo, las estaciones depuradoras de aguas residuales industriales (EDARI), deben de estar adecuadas al vertido concreto de este tipo de industrias, disponiendo de sistemas flexibles y adaptativos a los cambios ya comentados y con capacidad para trabajar con altos niveles de carga orgánica fácilmente biodegradable. Muchas de estas explotaciones son tratadas con Fangos Activos, con sistemas anaerobios (UASB), con Reactores Biológicos Secuenciales (SBR) e incluso con Reactores Biológicos de Membranas (MBR).
La elevada heterogeneidad de estas aguas, hace que se produzca también una gran diversidad entre la fisiología y ecología de los microorganismos implicados en el proceso de depuración biológica.
Se trata por lo tanto de un vertido de color oscuro, influenciado en muchos casos por la oxidación de la sangre, altamente biodegradable, pero que también presenta una fracción lentamente biodegradable, como grasas, proteínas, detergentes, fibras…, desequilibrio de nutrientes y fuertes variaciones de caudal, carga y pH.
El proceso de depuración de estos vertidos cuenta, en general, con las siguientes fases: desbaste de residuos gruesos, depósito regulador, neutralización, tratamiento físico-químico, desengrasado y tratamiento biológico que puede ser aerobio, anóxico, anaerobio o combinación de ellos y secado de los fangos generados.
Contando que la aplicación de los índices biológicos es de gran interés para describir la calidad del lodo y mejorar los procesos de operación en este tipo de planta (Pedrazani et al., 2016), en este trabajo, se expone el seguimiento de la biomasa de cinco EDARI aeróbicas con cultivo en suspensión del sector cárnico procedentes dos de ellas de fangos activos (FA1 y FA2), dos de SBR (SBR1 y SBR2) y una de MBR.
Material y método
La metodología de trabajo ha consistido en la valoración del Índice del Fango (IF) (Rodríguez. et al., 2004). Este índice plantea la posibilidad de realizar un estudio simplificado del fango activo en función de las características macroscópicas y microscópicas. El valor del IF guarda relación con los porcentajes de reducción de Sólidos en Suspensión, DQO, Nitrógeno y Fósforo.
El análisis macroscópico se lleva a cabo mediante la prueba de la V30, estudiándose cuatro parámetros del proceso de decantación: turbidez, flóculos en suspensión del clarificado, sedimentabilidad y olor.
Para el análisis microscópico, se ha utilizado un microscopio óptico, visualizando a través del objetivo de 10x, sobre 25 microlitros de muestra. Se ha realizado un análisis de las características del flóculo y a continuación se ha estudiado la población protozoaria presentes en las diferentes muestras analizadas.
Los parámetros utilizados que constituyen el IF, agrupados en características macroscópicas y microscópicas, se reflejan en la siguiente figura 1:
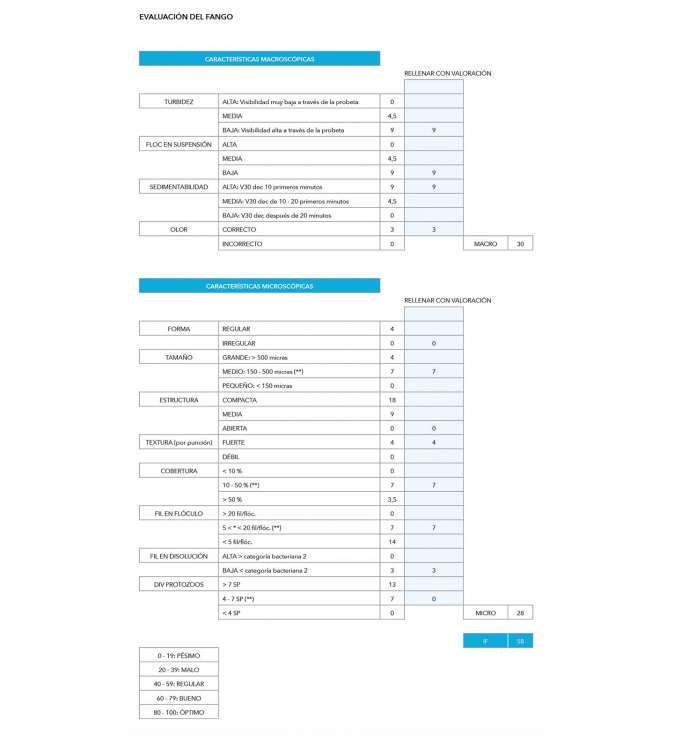
La suma de puntuaciones de ambos grupos de características se traduce en un valor final de IF comprendido entre 0-100, del que se definen cinco categorías, cada una de las cuales alude a una calidad distinta del fango activo (pésima, mala, regular, buena y óptima), como puede apreciarse en la figura 1.
Igualmente, se ha analizado la presencia de protistas, micrometazoos y bacterias filamentosas mediante una observación de la muestra al microscopio in vivo a 20x, 40x y 100x.
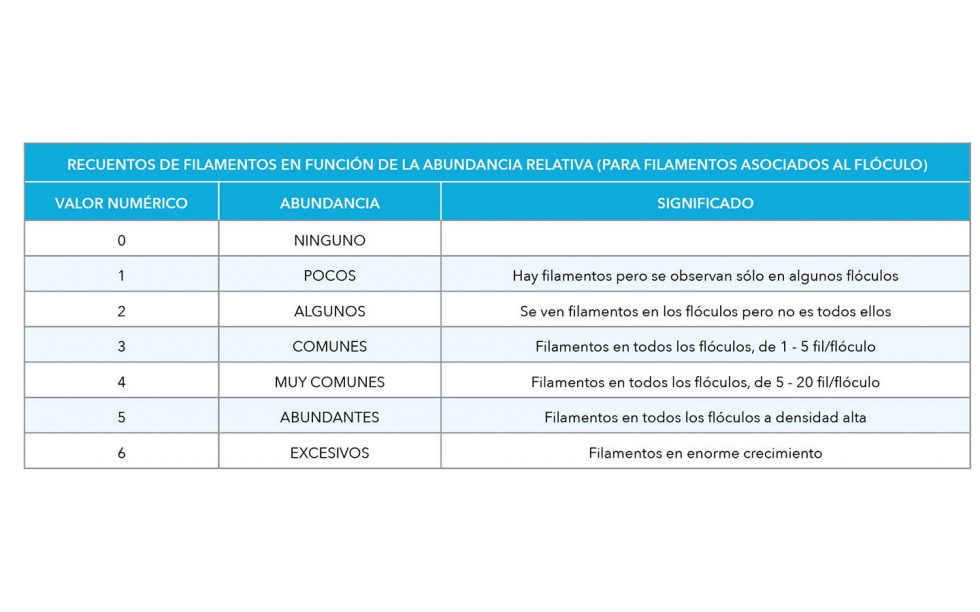
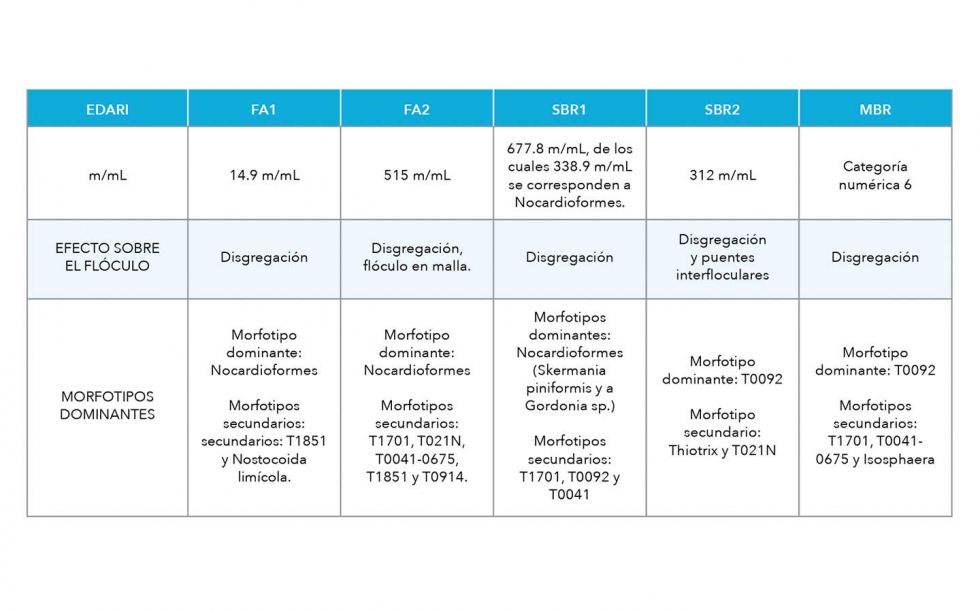
Las identificaciones bacterianas se han realizado con muestras teñidas con Gram, Neisser y PHB a 100x, para identificar y cuantificar las especies más usuales en función de sus diferentes características morfológicas (Jenkins et al., 2004; Eikelboom, 2006), realizándose el conteo de m/mL de filamentos según la técnica descrita por Salvadó (2016), salvo al MBR que presenta un nivel de bacterias filamentosas muy elevado y se ha valorado de forma cualitativa en rango de 0 a 6 (Tabla 1).
El análisis de viabilidad celular de las bacterias del flóculo y filamentosas se ha realizado con el empleo de fluoróforos específicos (Yoduro de propidio y Syto 9) y observación con microscopía de epifluorescencia. Análisis de imagen con el software BioImageL versión 2.1
Los análisis físico-químicos se han realizado según los Métodos Normalizados (APHA, AWWA, WPCF; 1998).
Resultados
Las cinco muestras procedentes de EDARI cárnica se han analizado evaluando sus características macro y microscópicas, microbiota y bacterias filamentosas presentes.
Valoración Macroscópica:
En la Figura 2, se representa el proceso de decantación de las cinco muestras de fango activo una vez transcurrido el ensayo de la V30. Ambos SBR comparten clarificados de muy buena calidad, pero con fangos esponjados mientras que entre los dos fangos activos testeados la variación es sustancial, presentando el FA1 una buena decantación con un clarificado correcto que desnitrifica a las 24 horas, mientras que el FA2, prácticamente no hay generación de clarificado, si bien al mantener la decantación durante 24 horas, se produce una separación de fases correcta llegando a un valor de fango decantado de 600 mL.
Por su parte en el MBR no existe separación de fases debido a la alta concentración de sólidos con los que se suele trabajar en estos sistemas. Del orden de 10000 mg/L en esta muestra. A este tipo de procesos no es posible aplicar el Índice de fango (IF) ni el índice volumétrico del fango (IVF).

Las características macroscópicas asignadas a cada una de las muestras analizadas quedan recogidas en la tabla 2, presentando todos valores correctos, salvo el FA2.
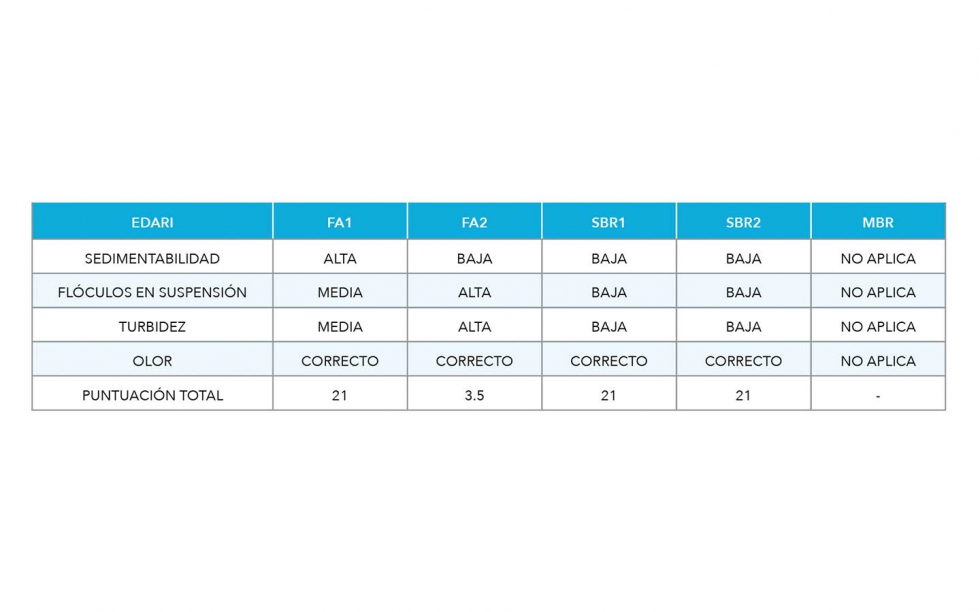
Tabla 2: Resumen y puntuación de las características macroscópicas del IF para las cinco EDARI estudiadas.
Por su parte, el IVF, no aplicable al MBR, marca un primer grupo de EDARI con valores correctos; muestras FA1, con 2.300 mg/L de sólidos en suspensión (MLSS) y SBR 2, con 4.800 mg/L MLSS. En el otro grupo se encontraría el FA2, en zona de riesgo de esponjamiento, con 5.000 mg/L de MLSS y por último el SBR1 que excede de forma importante los valores de riesgo del IVF, con 3.200 mg/L, tal como puede observarse en la figura 3.
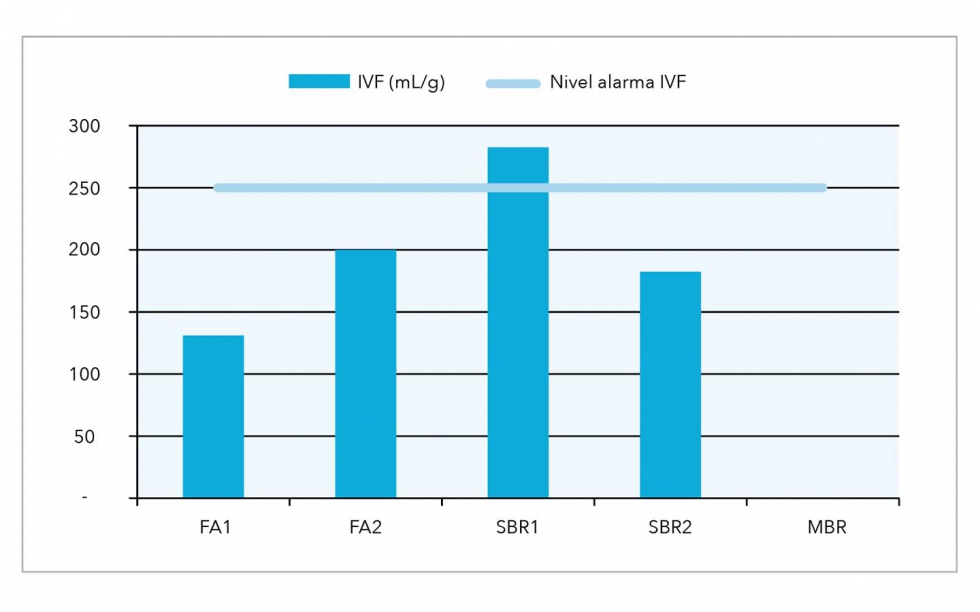
Esta situación en la decantación está relacionada con la formación flocular observada, que se desarrolla de forma más detallada en la valoración microscópica.
En resumen, macroscópicamente se ha observado una cierta semejanza en la valoración macroscópica entre las muestras FA1, SBR1 y SBR2, si bien el IVF marca diferencias entre ambas, por el contrario, la muestra FA2 es la que ha obtenido la puntuación macroscópica más baja, debido a la falta de separación de fases obtenida en la V30.
Es llamativo, que salvo la muestra FA1, el resto presenta niveles de sólidos en suspensión elevados, con porcentajes de volátiles que van desde un 87 a un 94%.
La fracción compleja de los vertidos de la industria cárnica está formada por grasas, proteínas y celulosas, las cuales son difíciles de degradar (Jia et al., 2012). Mantener altas concentraciones de MLSS y altas edades de fango permite a estas EDARI degradar material lentamente biodegradable y asumir cambios de carga importantes.
Valoración Microscópica:
La variabilidad flocular puede apreciarse en la figura 4 y guarda clara relación con el aspecto macroscópico visto anteriormente.
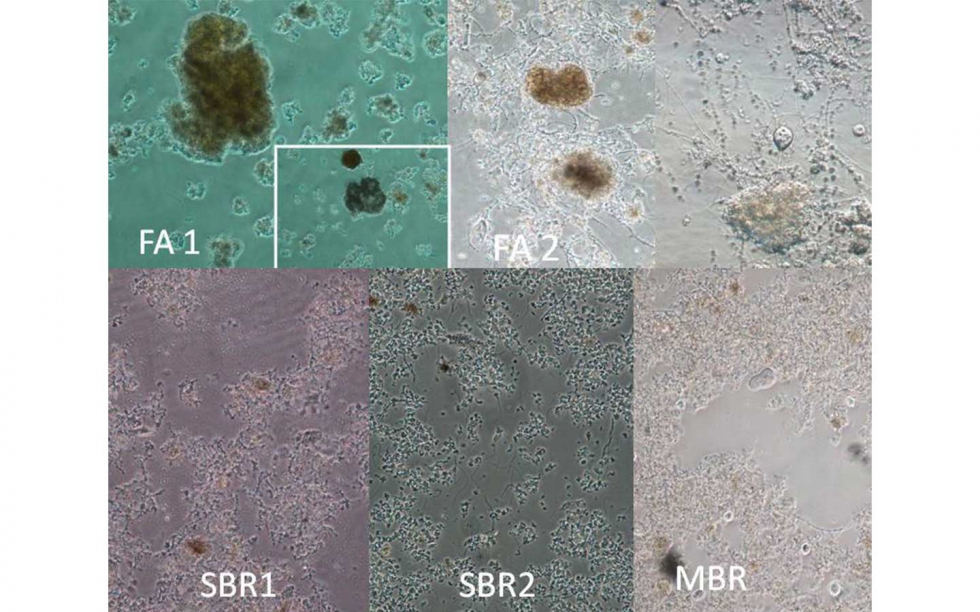
La muestra FA1 destaca sobre el resto al utilizarse en la EDARI un agente floculante para ayudar a la agregación. Sus flóculos son de tamaño pequeño-medio, forma irregular, compactación alta, de textura fuerte y con bajo nivel de bacterias filamentosas y crecimiento disperso.
El resto de muestras presentan flóculos más abiertos, de tamaño medio-grande con un nivel de bacterias filamentosas que oscila entre los 5-20 filamentos por flóculo en los SBR1 y SBR2, hasta más de 20 filamentos por flóculo en FA2 y MBR.
El efecto de estos filamentos sobre los flóculos fundamentalmente es la disgregación, liberando microflóculos, aunque también se producen puentes interfloculares, aumentando el tamaño flocular y dificultando la decantación.
Los ensayos de viabilidad realizados a estas muestras marcan un rango de células no viables que van desde el 1-3%, valores que indican que no existen agentes dañinos en los vertidos de estas EDARI, como detergentes o bactericidas usados en los procesos de higienización.
Valoración de la microbiota:
Aunque Pedrazani et al., (2016), encontraron 25 taxones de ciliados en la muestra analizada por ellos y dos de amebas testáceas (Arcella y Euglypha), en las muestras visualizadas en el presente estudio, se ha observado (Tabla 3) una diversidad de la microbiota mayoritariamente baja, salvo el MBR que presenta diversidades medias y el FA2 donde se han llegado a determinar hasta 12 géneros de protistas, todas con unos niveles de densidades medio/bajos.
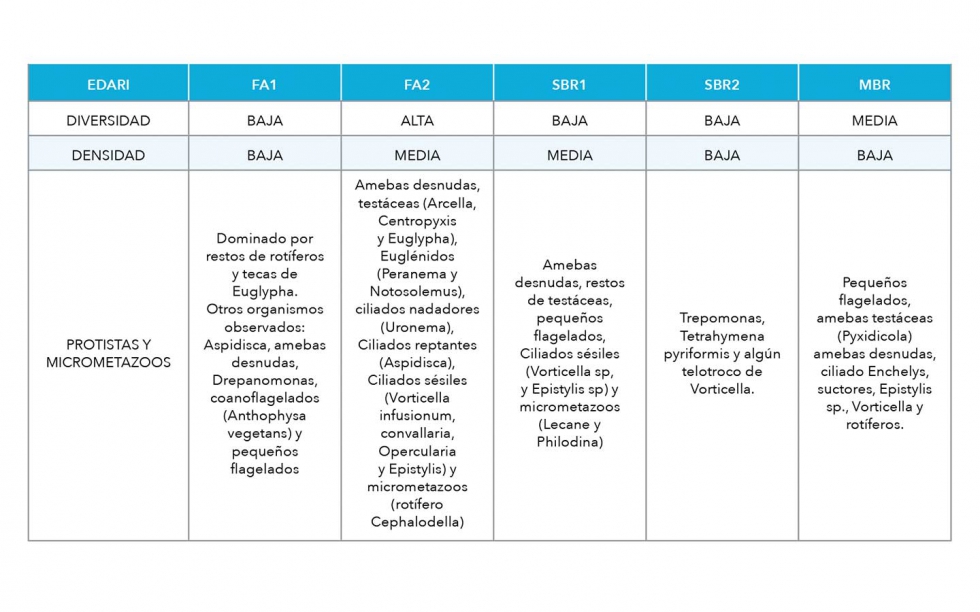
Dentro de los protistas encontrados cabe destacar la aparición de amebas desnudas en todas las muestras, relacionadas con la presencia de material lentamente biodegradable, la aparición de Peranema y Notosolemus en el FA2, del prostómido Enchelys en el MBR y de la alta diversidad de amebas testáceas encontradas (Arcella, Centropyxis, Euglypha y Pyxidicola) en FA2, todos ellos asociados a procesos de nitrificación.
Como contrapartida, la comunidad presente en SBR2 está vinculada a procesos de sobrecarga (Trepanomonas y Tetrahymena pyriformis), al igual que Antophysa vegetans y el ciliado Drepanomonas observado en FA1, relacionado tanto con sobrecarga como con posible toxicidad.
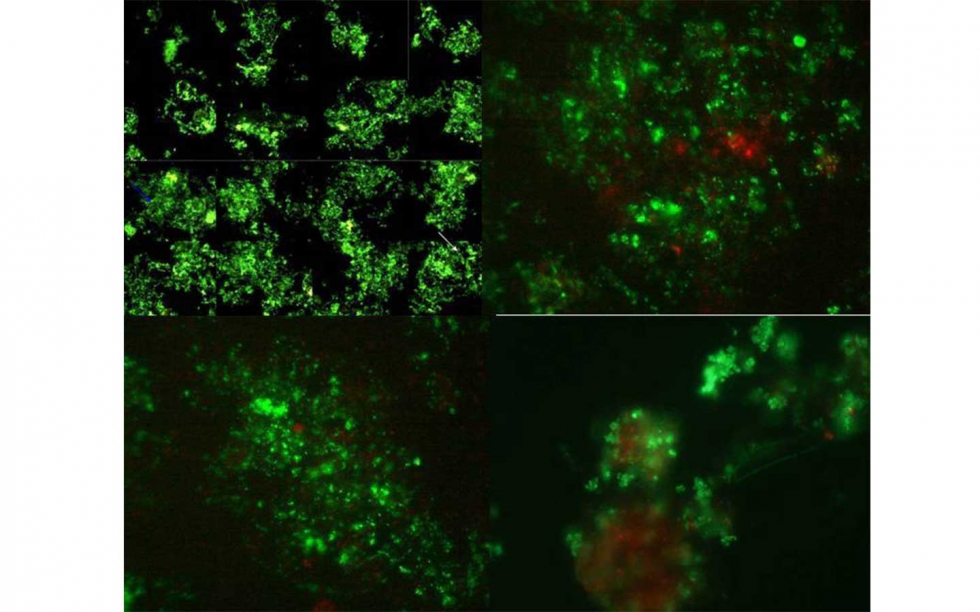
Algunos de estos organismos se han recogido en la figura 6.
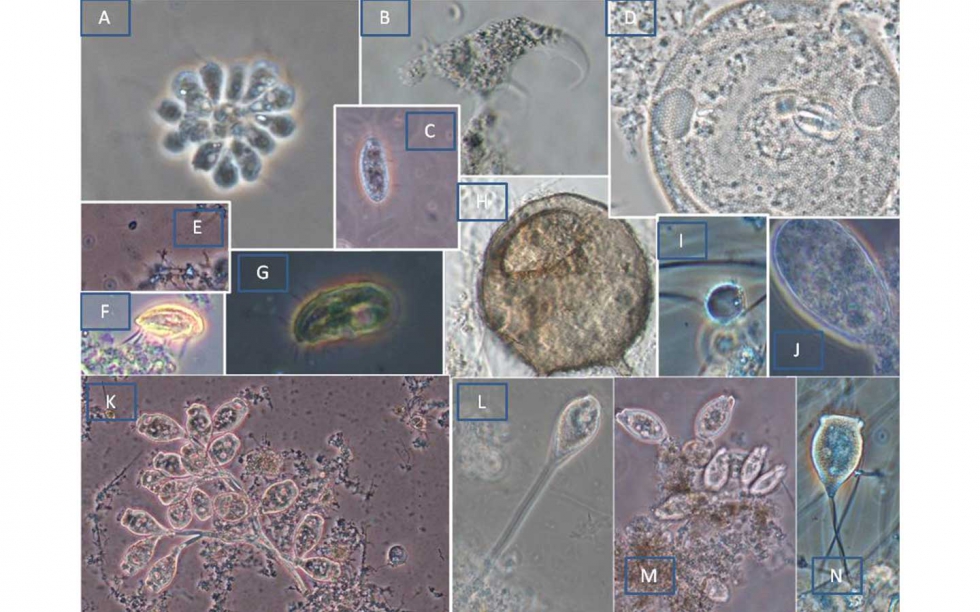
CF: Contraste de fases. N: Nomarsky
A: Anthophysa vegetans. CF. 1000x
B: Ameba desnuda. N. 400x
C: escuticociliado: CF: 200x
D: Arcella sp. CF. 1000x
E: Pequeño flagelado. CF. 100x
F: Aspidisca cicada. CF. 400x
G: Drepanoonas sp. CF: 400x
H: Centropyxys sp. CF: 400x
I: Pyxidicola CF. 400x
J: Euglypha. CF. 400x
K: Epistylis sp. CF. 100x
L: Vorticella infusionum. CF. 200x
M: Opercularia sp. CF: 200x
N: Vorticella convallaria. CF. 200x
El estudio de la microbiota presente en estas muestras, marca una clara diferencia entre el sistema de comunidades biológicas establecidos en el FA1 y SBR 2 relacionado con sobrecarga y deficiencia de oxígeno, frente al resto que presenta comunidades vinculadas con distintos grados de nitrificación.
La presencia de rotíferos en FA2, SBR1 y MBR, aportan información sobre la elevada edad de fango de estas muestras, mientras que en FA1 la presencia de tecas y de restos de rotíferos guarda relación con falta de retiradas de lodos en exceso.
Valoración de la presencia de bacterias filamentosas:
El nivel de incidencia de las bacterias filamentosas sobre las muestras estudiadas es muy variable, presentándose valores de desarrollo que van desde apenas 15 m/mL, en FA1, hasta concentraciones de casi 700 m/mL en la muestra SBR1 o prácticamente incontables en el MBR.
El efecto general es de disgregación flocular, lo que genera un flóculo abierto de gran tamaño con mala sedimentabilidad, como ya se ha comentado anteriormente.
Los principales morfotipos responsables de este esponjamiento y probable presencia de espumas son los Nocardioformes y T0092, aunque también se han detectado T0041-0675, T1851, Isosphaera, T1701, T021N, Thiothrix y T0914 (figura 8), todos ellos encontrados por otros autores en EDARI del sector: Cammarota y Freire (2006), Milobedzka y Muszynski (2015), Amanatidou et al., (2015) y Pedrazani et al. (2016).
Microthrix parvicella citado por Cammarota y Freire (2006) y Milobedzka y Muszynski (2015), como muy abundante en su estudio, no han sido detectados en ninguna de las muestras analizadas. Según Pedrazani et al. (2016), este filamento no suele aparecer cuando los ratios C/N/P son correctos.
A modo recopilatorio, han quedado registrados en la tabla 4, junto con su nivel de incidencia en m/mL, salvo para el MBR cuya concentración de bacterias filamentosas es muy elevada, los morfotipos encontrados detallados por muestras.
La estructura flocular de este sistema está totalmente relacionada con las condiciones alta concentración de sólidos típicos de estos procesos, que no permiten discernir la diferencia entre un flóculo y otro. Evidentemente un MBR no se va a ver afectado por el crecimiento de bacterias filamentosas e igualmente la estructura flocular no va a ser determinante de la calidad del agua de salida. Sin embargo el análisis realizado pone de maniefiesto un ecosistema donde existe una fuerte limitación de carga orgánica que genera el crecimiento de organismos indicadores de deficiencia nutricional. Esta deficiencia nutricional, provoca adaptaciones en el metabolismo y conlleva la liberación de material extracelular, con el consiguiente ensuciamiento de las membranas. Por lo tanto seria necesario ajustar la carga orgánica al sistema para evitar procesos graves de fouling.
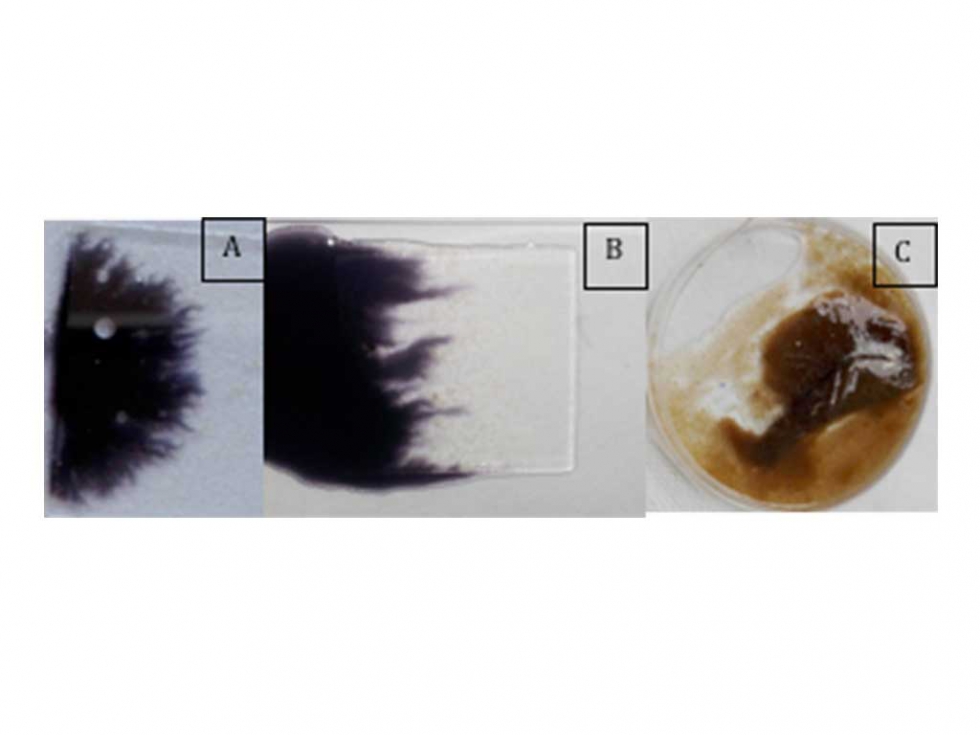
Si bien en todas las muestras se detecta un grado elevado de viscosidad, esta adquiere mayor relevancia en las muestras FA1 y FA2, valoradas por el test de Nigrosina (Figura 7), llegando a aparecer en el fondo de la probeta de la muestra FA1 una importante masa mucosa (gracias a los agentes floculantes añadidos a este proceso, se consigue una estructura flocular forzada que aglomera la viscosidad de la misma).
Esta viscosidad generalizada en todas las muestras, guarda una estrecha relación con la DQO fácilmente biodegradable que representan en estos vertidos del orden del 40-60% de la DQO total (Jiu et al., 2012; Carrasquero et al., 2015).
Respecto a los filamentos dominantes se definen dos grupos en los que por una parte dominan los Nocardioformes en las muestras FA1, FA2 y SBR1 y por otro es T0092 el filamento dominante en SBR2 y MBR.
Probablemente, aunque no se disponen de datos analíticos de los afluentes de estas plantas, las tres primeras tengan un sistema de desengrasado deficiente lo que aprovechan los Nocardioformes para su desarrollo. Por su parte, cargas másicas (CM) muy bajas permiten el desarrollo masivo de T0092.
Como dato curioso, el SBR1, ha desarrollado Nocardioformes de dos géneros distintos Skermania piniformis, citada en plantas de este tipo por Miłobędzka y Muszyński (2015), y Gordonia sp. lo que indica la entrada de distintos sustratos grasos que permite el desarrollo de ambos organismos.
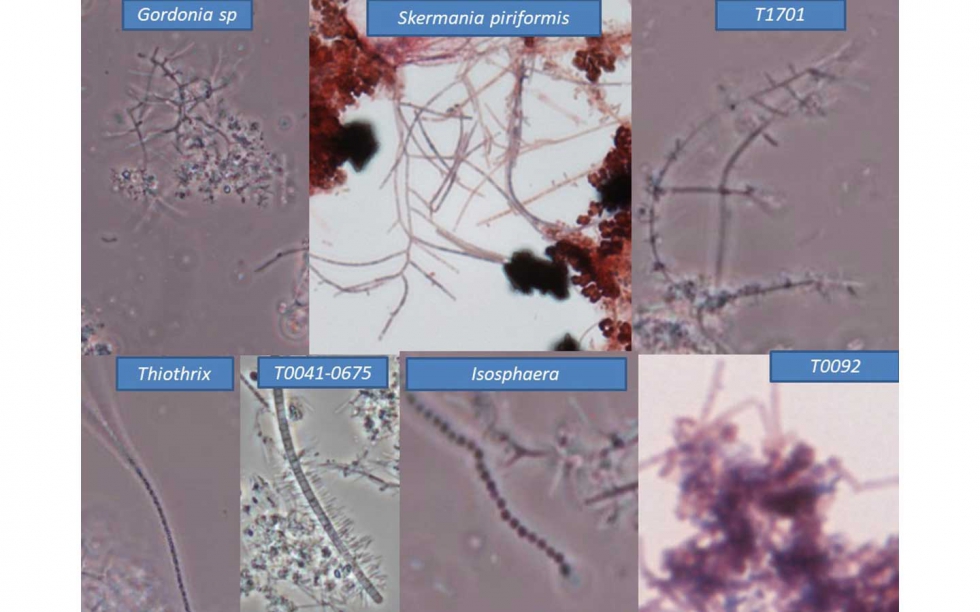
Godornia sp, Thiothrix, T0041-0675, T1701 y Isosphaera. In vivo. Contraste de fases. 1000x.
Skermania piriformis Campo claro. Tinción Gram. 1000x
T0092, Campo claro. Tinción Neisser. 1000x
Corroborando las apreciaciones realizadas anteriormente las bacterias filamentosas halladas están asociadas a bajas CM. Elevadas edades de fango (abundancia de crecimiento epifítico en muchos de los filamentos observados). Amanatidou et al., (2015), comprobaron que los ratios C/N/P eran insuficientes con 13 días de edad de fango y se favorecía el desarrollo de T021N y Thiothrix.
La deficiencia nutricional (coloración fuertemente morada del flóculo en la tinción de Neisser) ha sido más patente en SBR2 y MBR.
Se han observado posibles colonias nitrificantes en FA2 y MBR confirmando las condiciones de nitrificación. En SBR2 se ha encontrado azufre In situ, en concordancia con la falta de oxígeno detectada en esta muestra.
También se han observado en prácticamente todas las muestras:
- Bacterias tipo PAO
- Bacterias GAO, lo cual indica altas entradas de AGV en relación al fósforo disponible (Ratio AGV/P>10) (Figura 9), lo que concuerda con los altos niveles de PHB presentes
- Importante actividad gránulo N+ y reactiva positiva a la tinción de polifosfatos.
Lo cual da idea de la potencialidad de estos sistemas para eliminar tanto formas carbonosas, como nitrógeno y fósforo (Merzouki et al, 2005).
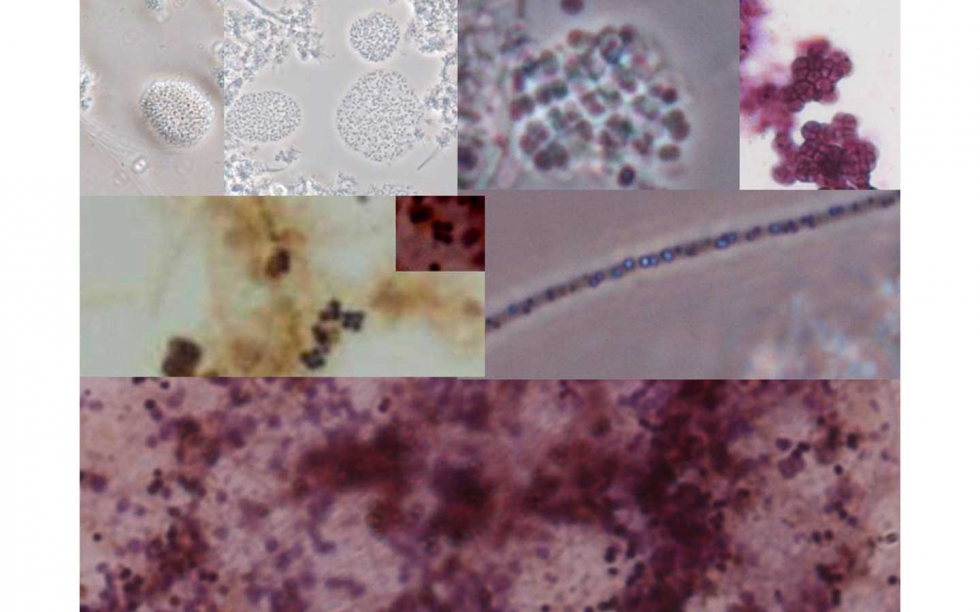
A y B: Posibles colonias nitrificantes. In vivo. Contraste fases
C: Posibles Gao. In vivo. CF.
D: Posibles GAO. Tinción Neisser. Campo claro
E: Posibles PAO. Tinción Neisser. Campo claro
F: Posibles PAO. Tinción PHB. Campo claro
G: Azufre In situ. Contraste fases
H: Tinción morada del flóculo. Deficiencia nutricional. Tinción Neisser. Campo claro
Conclusiones
Dentro del sector de las EDARI cárnicas y en función de los resultados obtenidos en el presente estudio, se plantea un escenario general de riesgo de bulking filamentoso o viscoso, debido a la alta biodegradabilidad de estos vertidos.
Las variaciones afluentes y el modo de explotación hacen que proliferen filamentos adaptados específicamente como ha sido en caso de FA1, FA2 y SBR1 con dominancia de los Nocardioforme y nitrificaciones en descenso, frente a SBR2 y MBR donde domina T0092, vinculado a elevadas edades de fango, nitrificación consistente e incluso eliminación biológica de fósforo, salvo en el SBR2 donde se han encontrado indicadores de sobrecarga y septicidad.
Para conseguir la eliminación biológica de nutrientes, estas plantas (ya sean por sistemas de fangos activos, SBR o MBR) han trabajado con ciclos anoxicos/anaerobios y aerobios que permiten consumir los elevados niveles de DQO soluble, con elevados niveles de MLSS salvo en el FA1, lo que ha desencadenado en situaciones de estrés nutricional, más o menos graves.
En general la situación ecológica descrita por la microfauna permite agrupar las muestras en dos grandes bloques: El primero de ellos relacionado con procesos de sobrecarga, FA1 y SBR2, frente a un segundo grupo relacionados con bajas cargas másica, alta edades del fango y desequilibrio nutricional en FA2, SBR2 y MBR.
La alta disponibilidad de DQO fácilmente biodegradable dificulta por una parte la explotación por los riesgos comentados anteriormente, pero por otra permite disponer de carbono soluble, clave para la eliminación de nitrógeno y fósforo. Por ello todos estos procesos gestionados correctamente van a permitir unas calidades de agua tratada aceptables.
Es necesario corregir problemáticas típicas de estas EDARI como son: malos tamizados y desengrasados, fallos en la neutralización de los pH en el tratamiento físico-químico, problemas en la homogenización, falta de oxígeno o cargas excesivas para las capacidades de diseño, mala extracción de fangos o fallos en las rectificaciones de los nutrientes y gestionar de manera correcta el balance C/N/P para evitar procesos de crecimiento filamentos recurrentes en estas instalaciones y vertidos a cauce publico fuera de rangos admisibles.
Por último, el IF aplicado a estos estudios está diseñado para EDAR urbana y necesitaría una adaptación a cada tipo de industria a la vez que habría que valorar comunidades de microorganismos como bioindicadores de tipos específicos industriales.
Bibliografía
Amanatidou, E., Samiotis, G., Trikoilidou, E., Tzelios, D., y Michilidis, A. (2015). Influence of Wastewater Treatment Plants’ Operational Conditions on Activated Sludge Microbiological and Morphological Characteristics. Environmental Technology · July 2015.
APHA, AWWA, WEF. Standard methods for the examination of water and wastewater. Washington DC, USA: American Public Health Association/ American Water Works Association/Water Environment Federation; 1998.
Bustillo-Lecompte, C.F. y Mehrvar; M. (2015). Slaughterhouse wastewater characteristics, treatment, and management in the meat processing industry: A review on trends and advances. Journal of Environmental Management 161.
Caldera, Y., Gutiérrez, E., Luengo, M., Chávez, J., y Ruesga. L (2010). evaluación del sistema de tratamiento de aguas residuales de industria avícola. Revista Científica, FCV-LUZ / Vol. XX, Nº 4, 409 - 416, 2010
Cammarota, M. C. y Freire, D.m.G. (2006). A review on hydrolytic enzymes in the treatment of wastewater with high oil and grease content. Bioresource Technology 97. 2195-2210.
Carrasquero F., Sedolfo J., Marquina G., Daniela C., Soto L., John, G. Rincón, S., Viloria, p., Sierra, M. C., Díaz, M. y Altamira, R. (2015). Remoción de nutrientes en aguas residuales de un matadero de reses usando un reactor biológico secuencial. Ciencia e Ingeniería Neogranadina, vol. 25, núm. 2, 43-60.
Eikelboom, D. (2006). Identification and Control of Filamentous Micro-organisms in Industrial Wastewater Treatment Plants. IWA Publishing. London
Jenkins, D., Richard, M. G., Daigger, G. T. (2004). Manual on the Causes and Control of Actived Sludge Bulking and Foaming. Lewis publishers. Michigan.
Jia1, Y., Gao, C., Zhang, L., y Jiang, G. (2012). Effects of Pre-fermentation and Influent Temperature on the Removal Efficiency of COD, NH -N and PO3 -P in Slaughterhouse Wastewater by Using SBR. Energy Procedia. 1964-1971.
Merzouki, M., Bernet, N., Delgene`s, J. P., y Benlemlih, M. (2005). Effect of prefermentation on denitrifying phosphorus removal in slaughterhouse wastewater. Bioresource Technology 96 1317–1322.
Milobedzka, A. y Muszynski, A. (2015) Population dynamics of filamentous bacteria identified in Polish full-scale wastewater treatment plants with nutrients removal. Water Sciense Technology. 71 (5): 675–684.
Pedrazzani, R., Menoni, L., Nembrini, S., Manili, L. y Bertanza, G. (2016). Suitability of Sludge Biotic Index (SBI), Sludge Index (SI) and filamentous bacteria analysis for assessing activated sludge process performance: the case of piggery slaughterhouse wastewater. Journal of Industrial Microbiology · April 2016.
Rodríguez, E., Isac, L., Fernández, N. y Salas, M.D. (2004). “Manual de Trabajo para Análisis Biológicos en Fangos Activados”. Jornada de Transferencia de Tecnología sobre “Ejercicios interlaboratorios en fangos activos como sistema de control de calidad en la EDAR” (Sevilla, Octubre de 2004). I.S.B.N. 978-608-0189-4.
Salvadó H. 2016. Improvement of the intersection method for the quantification of filamentous organisms: basis and practice for bulking and foaming bioindication purposes. Water Sci Technol. 74:1274–82.