Entrevista a María Vallet, catedrática emérita de Química Inorgánica
María Vallet-Regí es catedrática emérita de Química Inorgánica y jefa del Grupo de Investigación en Biomateriales Inteligentes del Departamento de Química en Ciencias Farmacéuticas de la Universidad Complutense de Madrid. Su equipo multidisciplinario trabaja con materiales inteligentes —biocerámica, sílice y nanopartículas— que están llevando los tratamientos médicos personalizados a un nivel completamente nuevo.
¿Qué son los biomateriales inteligentes y cómo y cuándo se interesó por ellos?
Un biomaterial es un material que ha sido diseñado para interactuar con organismos vivos para un objetivo clínico. El adjetivo "inteligente" se refiere a la capacidad de responder al ambiente para adaptar su comportamiento. Por ejemplo, un biomaterial inteligente es capaz de liberar fármacos o agentes trazadores en respuesta al propio proceso patológico con el fin de adaptar la dosificación administrada.
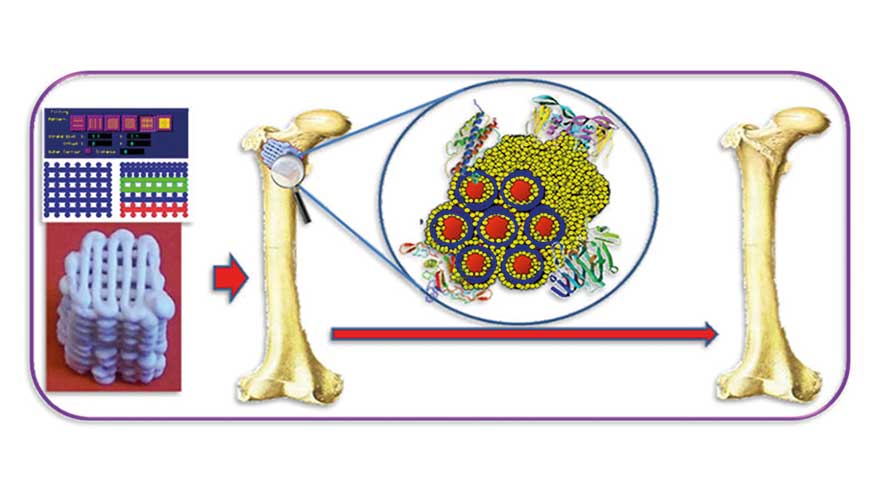
Uno de sus principales campos de investigación es la biocerámica avanzada para la regeneración del tejido óseo y los andamiajes. ¿Cuál es el objetivo principal de este enfoque?
El alto impacto sanitario, social y económico de las patologías óseas ha hecho que mi grupo de investigación dedique mucho esfuerzo de investigación a la biocerámica para terapias de regeneración ósea y andamiajes. La evolución de la biocerámica ha experimentado una notable evolución en las últimas décadas en tres etapas. La primera generación tenía como objetivo sustituir el hueso dañado, la segunda generación incluía el diseño de materiales bioactivos y biodegradables, y en la tercera generación se puso énfasis en la regeneración del tejido óseo.
Mi equipo de investigación comenzó a trabajar en este campo de investigación en los años 90 y ha lleva más de 15 años diseñando la última generación de innovadoras biocerámicas avanzadas. Nos centramos en el desarrollo de andamios macroporosos en 3D, que proporcionan respuestas adaptadas a las diferentes etapas de la regeneración ósea. Preparamos implantes a través del control preciso de la composición química, la mesoporosidad, la macroarquitectura y la funcionalización de superficies con factores de crecimiento, con el objetivo de imitar la matriz extracelular ósea.
¿Cuáles son los nuevos desafíos en este campo de investigación?
Implementar un enfoque personalizado junto con cirugías menos invasivas para restaurar la pérdida de hueso humano debido a diferentes enfermedades y traumas (osteoporosis, cáncer, infección, etc.) es el principal desafío en este campo.
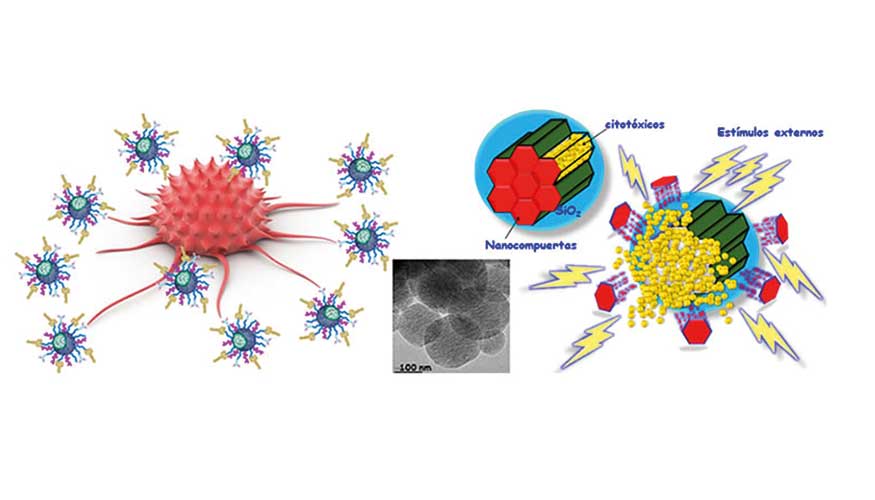
Su equipo también trabaja en nanopartículas mesoporosas sensibles a los estímulos para la terapia antitumoral. ¿Podría describir esta investigación?
Nos centramos en el desarrollo de nanopartículas capaces de transportar fármacos o cualquier otra biomolécula a ciertos tejidos enfermos y liberarlos bajo demanda. En concreto estamos trabajando con nanopartículas mesoporosas porque pueden cargar una mayor cantidad de fármacos que las nanopartículas convencionales como los liposomas o las nanopartículas poliméricas. Además, podemos decorarlas con ciertos grupos funcionales que les confieren la capacidad de responder a determinados estímulos, que pueden ser aplicados externamente por el profesional clínico o desencadenados dentro del cuerpo dependiendo de la patología tratada.
Hemos desarrollado nanovehículos capaces de liberar fármacos en respuesta a la aplicación de ultrasonidos, campo magnético y luz de diferentes longitudes de peso, lo que permite tener un control espacial y temporal en la liberación de la carga. También hemos desarrollado nanopartículas capaces de transportar ciertas biomoléculas y liberarlas en respuesta a gradientes en el pH o la sobreexpresión de ciertas moléculas, que son escenarios típicos de ciertas patologías. Por lo tanto, la carga solo se liberaría en las áreas afectadas sin afectar a los tejidos sanos y reduciendo los efectos secundarios típicos de las terapias convencionales.

¿Qué podemos esperar en el futuro de los biomateriales inteligentes?
Creo que la academia y el sector industrial biotecnológico deberían trabajar juntos para desarrollar la ingeniería de biomateriales inteligentes para curar enfermedades, ya que este es un campo interdisciplinario que necesita los resultados de químicos, biólogos, ingenieros, físicos, clínicos e incluso empresarios. Hasta ahora hemos sido capaces de producir biomateriales inteligentes diseñados para interactuar con sistemas biológicos para una amplia gama de aplicaciones biomédicas y, en los próximos años, la explotación de los beneficios adicionales de esos biomateriales inteligentes va a ser esencial para implementar sus aplicaciones potenciales y su producción a un nivel de escala comercial.
En el futuro habrá una demanda intensiva de biomateriales inteligentes debido a la creciente población geriátrica y la alta incidencia de trastornos cardiovasculares, neurológicos y ortopédicos. Nuestro papel y desafío como investigadores es encontrar y desarrollar soluciones adecuadas para esos problemas sociales. Y para lograrlo posiblemente necesitemos financiación y recursos para poder transformar la ciencia actual en tecnología del mañana.




























