Elevada frecuencia de resistencias genéticas ante los insecticidas organofosforados de la mosca del olivo en España
B. Matallanas1, E. Lantero1, S. Pascual2, M.D. Ochando1, C. Callejas1
1Unidad Docente de Genética, Fac. de CC Biológicas, Universidad Complutense
2Dpto. Protección Vegetal, Grupo de Entomología, INIA
03/12/2019España concentra un 45% de la producción mundial olivarera con más de 2,5 millones de hectáreas, siendo el principal productor y exportador de aceite de oliva y aceituna de mesa. El olivo constituye un pilar de nuestro sistema agroalimentario con cien variedades diferentes y una elevada repercusión económica, social y ambiental. La mosca del olivo Bactrocera oleae (Tephritidae, Rossi 1790) es la plaga más dañina para el olivar. Su distribución tradicional quedaba limitada a las regiones de clima mediterráneo, pero la introducción del olivo en Australia, China o América ha facilitado la dispersión de esta plaga, ya detectada en California, México y China.
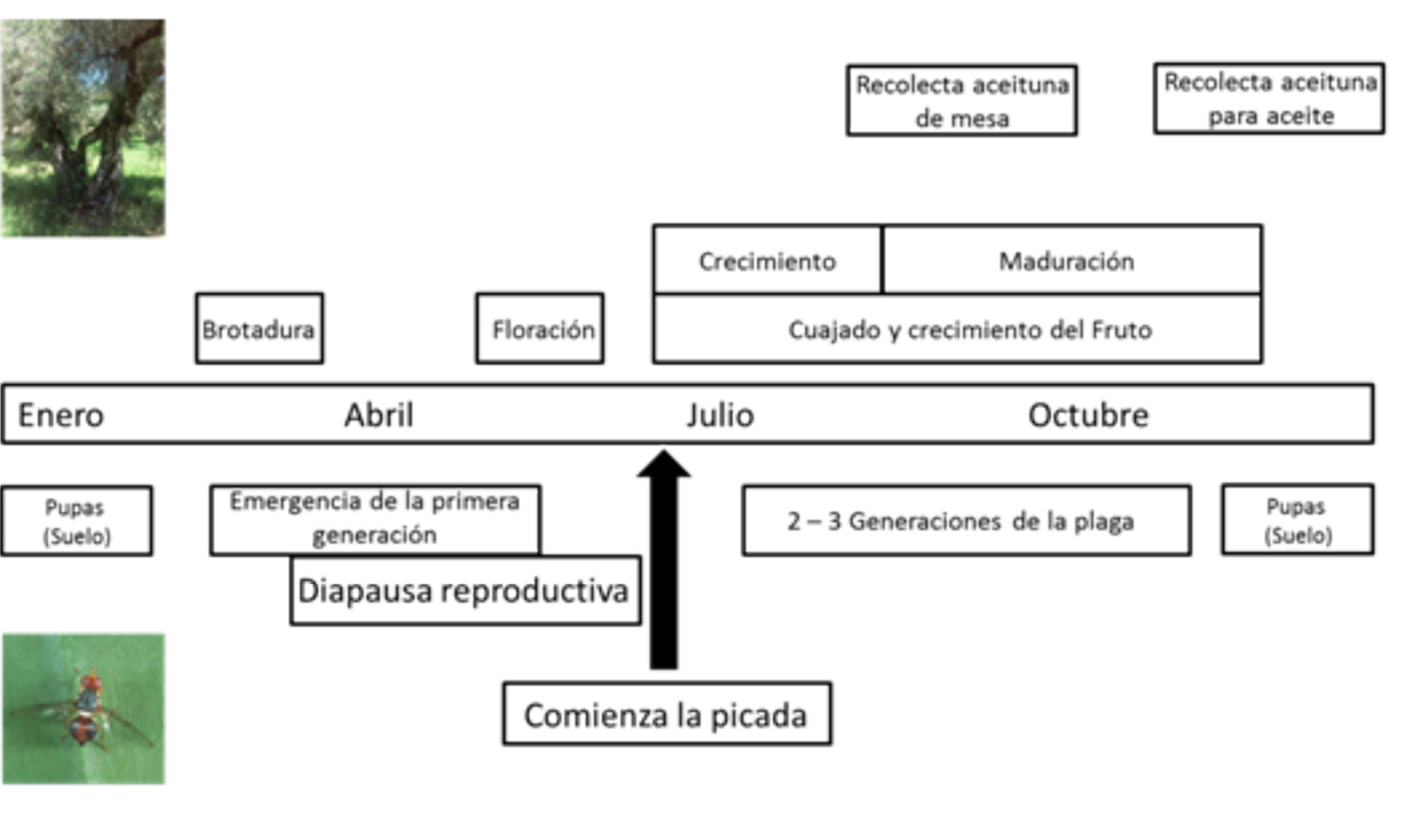
Las hembras de la mosca del olivo preparan una cámara en el interior de la aceituna, donde dejarán los huevos, que eclosionan transcurridos 2-3 días (Figura 1). Las larvas se alimentan de la aceituna durante 10–15 días, después se convierten en pupas y los adultos emergen tras 9 días. El daño que causan está directamente relacionado con los hábitos alimenticios de las larvas, solo comen aceitunas, y por tanto tienen una dependencia absoluta del olivo para su desarrollo.

Figura 1. Hembra adulta de la especie B. oleae. Fuente: http://www.comune.rivadelgarda.tn.it.
Bactrocera oleae tiene de dos a cinco generaciones anuales (Figura 2). Las generaciones precoces, que surgen a partir de marzo, originan una caída prematura de la aceituna. Las más tardías, en otoño, son las que producen mayores pérdidas. La larva, al alimentarse, reduce el peso de la aceituna y favorece la aparición de hongos en las galerías que genera, alterando las propiedades organolépticas y ocasionando con ello una pérdida de calidad del aceite (MAPAMA). En las variedades destinadas a producción de aceituna de mesa la picada implica su descarte para el comercio. En España los daños ocasionados han llegado a suponer un descenso del 15% de la producción olivarera y del 25% en la calidad del aceite, lo que conlleva grandes pérdidas económicas.
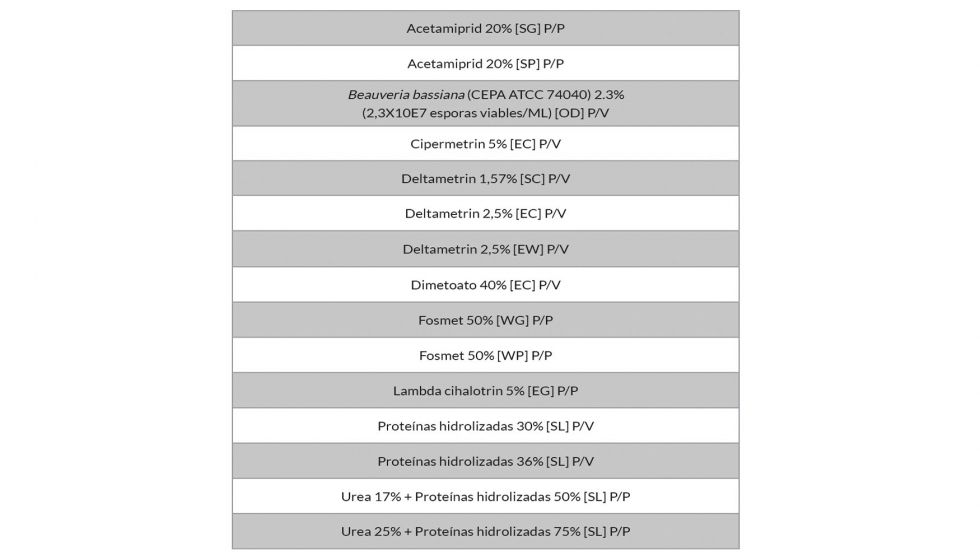
En producción integrada, los productos autorizados para tratamientos en cebo son organofosforados (Dimetoato), espinosinas (Spinosad) y piretroides (Alfa-cipermetrín, Deltametrín y Lambda-cihalotrín); en tratamientos con pulverización a todo el árbol, organofosforados (Dimetoato y Fosmet), neonicotinoides (Acetamiprid y Tiacloprid) y piretroides (Deltametrín y Lambda-cihalotrín) y en productos repelentes, Caolín.
En la actualidad, los insecticidas organofosforados siguen siendo de los más aplicados para el control de la mosca del olivo. La diana de estos productos es la proteína acetilcolinesterasa del insecto. Esta proteína degrada un neurotransmisor denominado acetilcolina una vez que ha ejercido su acción sobre la unión neuromuscular. Los insecticidas organofosforados bloquean irreversiblemente la acetilcolinesterasa, impidiendo la degradación de la acetilcolina, lo que deriva en la parálisis y muerte del insecto.
La amplia, y en ocasiones abusiva, utilización de los organofosforados ha conllevado un incremento en el número de moscas del olivo resistentes a estos insecticidas; se ha observado en poblaciones de campo de Italia, Grecia y Chipre (Hawkes et al., 2005; Nardi et al., 2006; Skouras et al., 2007; Kampouraki et al., 2018). El Comité de Acción contra la Resistencia a Insecticidas (IRAC, por sus siglas en inglés) define la resistencia a los insecticidas como un cambio 'heredable' (es decir, genético, que ocurre en el ADN) en cuanto a la sensibilidad a los insecticidas en una población de insectos plaga, que se refleja en repetidos fallos de un producto insecticida, utilizado correctamente, para alcanzar los niveles de control esperados.
Debido a la variabilidad genética natural, en una población de un determinado insecto hay individuos que presentan resistencia genética a los insecticidas, aunque son poco abundantes. El incremento observado en el número de insectos resistentes se debe a la presión selectiva que ejercen estos productos químicos. En un entorno tratado repetidamente con estos productos, sobreviven y se reproducen más aquellos individuos que porten en su ADN esos cambios ventajosos que les confieren resistencia, pero los insecticidas no producen mutaciones que hacen a los insectos más resistentes. Esta selección hace que aumente la frecuencia de insectos con resistencia a distintos fitosanitarios en las poblaciones de campo, que a la larga se traduce en el fallo del control de la plaga. Así, el seguimiento de los niveles de resistencia es relevante para el manejo de las moscas del olivo.
Entre las distintas estrategias para llevar a cabo un seguimiento de los niveles de resistencia en poblaciones de campo, se encuentran las herramientas moleculares. Los avances en biología molecular han permitido la caracterización genética de la mosca del olivo. Se ha estudiado, en concreto, una región de su genoma correspondiente al gen 'ace', que lleva la información genética necesaria para la síntesis y el funcionamiento correcto de la proteína acetilcolinesterasa. En Bactrocera oleae hay descritos tres cambios en el ADN del gen 'ace' (Figura 3) relacionados con la insensibilidad que adquiere la proteína acetilcolinesterasa a los organofosforados. Los dos cambios más frecuentes son mutaciones puntuales de nucleótidos. Los nucleótidos constituyen el lenguaje de la vida, que se escribe en la cadena de ADN con un código molecular de solo cuatro letras -las cuatro letras del ADN- que designan cuatro componentes químicos: A de adenina, C de citosina, G de guanina y T de timina. Estos dos cambios ocurren en unos fragmentos concretos del gen llamados exones IV y VII, donde una letra del ADN es sustituida por otra. Tanto el cambio detectado en el exón IV (A es cambiada por G) como el detectado en el exón VII (G es sustituida por A), reducen la capacidad del insecticida para unirse a la proteína acetilcolinesterasa codificada por ese gen 'ace', que lleva una o las dos mutaciones en su secuencia de ADN. El tercer cambio, hasta ahora muy poco frecuente (Kakani et al., 2013; Lantero, 2018), es una pérdida de nueve letras en el exón X del gen, que acorta la longitud de la proteína acetilcolinesterasa y modifica su localización en el organismo.
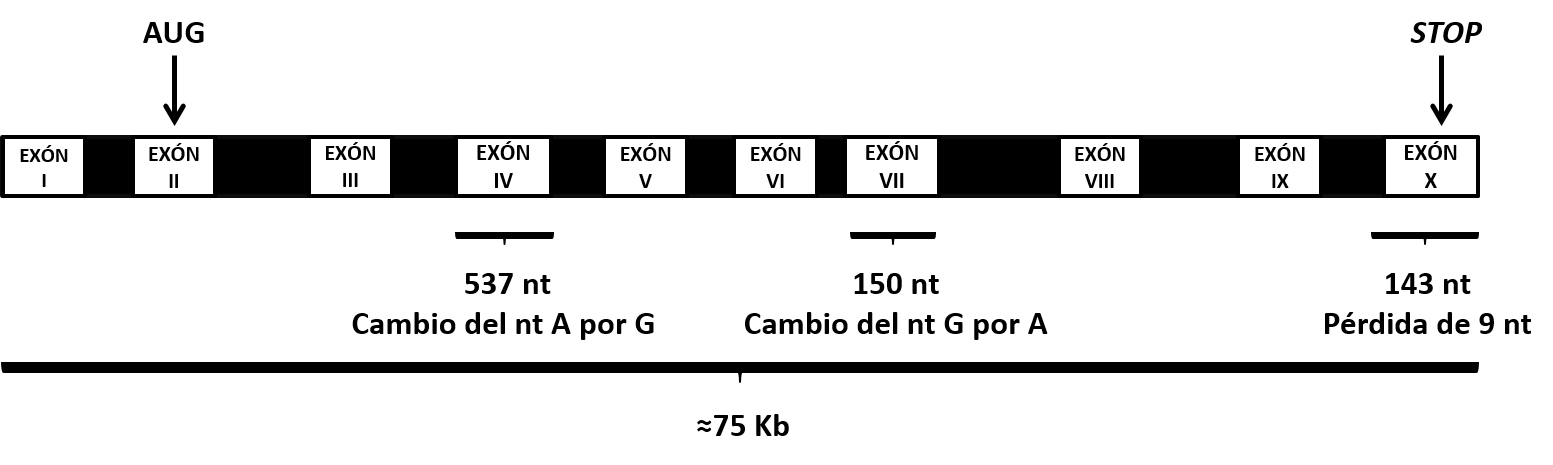
Figura 3. Esquema del gen 'ace' en B. oleae que lleva la información genética para la síntesis de la proteína acetilcolinesterasa. Se señalan los cambios (mutaciones) descritos en tres zonas concretas del gen, denominadas exones IV, VII y X, que confieren resistencia a los organosfosforados (adaptado de Kakani et al. 2013).
Considerando la escasa información disponible en España sobre la frecuencia y distribución de las resistencias que portan las poblaciones de esta plaga a los insecticidas organofosforados, hemos analizado los cambios o mutaciones puntuales en el ADN del gen 'ace' de 11 poblaciones españolas de B. oleae, representativas de su área de distribución.
El análisis
La Figura 4 esquematiza el abordaje seguido para el análisis genético. En la mayoría de las poblaciones analizadas, las aceitunas infestadas se llevaron al laboratorio, donde las larvas se mantuvieron en cámaras climáticas hasta la emergencia de los adultos, que se congelaron a -20 °C hasta la extracción del ADN de cada mosca.
Gracias a la técnica de PCR (Reacción en Cadena de la Polimerasa), se amplificaron de manera específica dos fragmentos concretos de ADN del gen 'ace': los exones IV y VII (Figura 3), obteniéndose en cada una de las moscas billones de copias de cada fragmento con los que realizar los subsiguientes análisis.
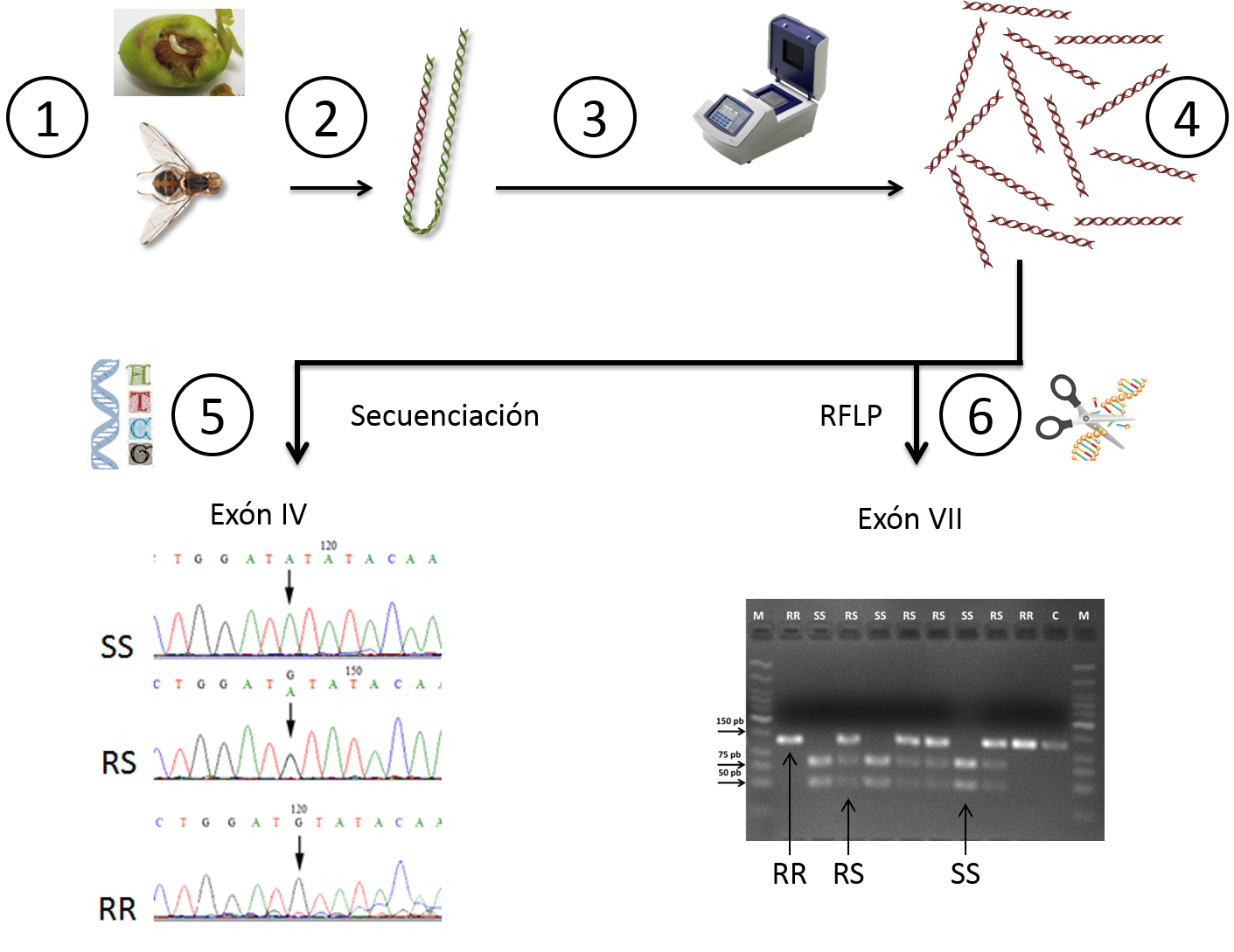
Figura 4. Abordaje seguido para el análisis genético de las mutaciones en el gen 'ace' de B. oleae que confieren resistencia a los organofosforados.
1.- Obtención de las moscas adultas.
2.- Extracción del ADN de cada mosca capturada por separado.
3 y 4.-Reacción en Cadena de la Polimerasa (PCR) de los fragmentos de ADN exón IV y exón VII, del gen 'ace' donde se han descrito las mutaciones puntuales que confieren resistencia a OP. Mediante la PCR, un determinado fragmento de ADN, el ADN diana, es amplificado exponencialmente para obtener muchas copias del mismo. Se realiza en un termociclador, donde varía la temperatura en función de las distintas etapas de las reacciones de amplificación
5- Secuenciación del fragmento de ADN correspondiente al exón IV donde se señala la posición de la mutación o cambio de un nucleótido por otro. SS: individuos sin la mutación, RS: individuos con una copia de la mutación que proporciona resistencia, RR: con dos copias de la mutación.
6.- Patrón de bandas obtenido al cortar con tijeras moleculares el fragmento VII del gen 'ace' y posterior resolución en una electroforesis en gel de agarosa de esas bandas de ADN obtenidas. En las fotografías se indican las moscas del olivo SS: sin la mutación, RS: con una copia de la mutación que da resistencia, RR: con dos copias de la mutación.
Para estudiar el ADN del fragmento exón IV, se determinó su secuencia de letras o nucleótidos mediante técnicas de secuenciación automática. De esta manera se pudo leer este fragmento y ver qué mosca. Bactrocera oleae es diploide, es decir que, al igual que los humanos y muchas otras especies, tiene dos copias de cada gen, una que recibe de su padre y otra de su madre. Por tanto, al analizar el perfil de letras se dedujo también el genotipo de cada mosca para este fragmento. Si una mosca tenía las dos copias de ADN con el cambio de nucleótido que confiere resistencia a los insecticidas organofosforados (letra G), las denominamos RR (Resistente-Resistente); si la mosca analizada tenía en una copia de letra G (Resistente) y en la otra copia la letra A (Sensible), las denominamos RS (Resistente-Sensible); y si la mosca tenía en las dos copias la letra A, las denominamos SS (Sensible-Sensible).
Para el estudio del ADN del exón VII se emplearon unas tijeras moleculares (enzimas de restricción) que cortan el ADN en sitios específicos. Según las características genéticas de cada mosca, se observaban fragmentos de ADN de distinto tamaño que, de nuevo, nos permitía conocer cómo era cada una: RR, RS o SS.
Los resultados
En el conjunto de las poblaciones españolas de la mosca del olivo se observó una elevada frecuencia de las mutaciones (las letras) que confieren resistencias a los organofosforados, tanto en el exón VI como en el VII. La mayoría de las moscas eran RR, en concreto, el 62% de ellas al estudiar el exón IV y el 61% al analizar el exón VII. En cambio, sólo el 13% de las moscas llevaba en las dos copias de ADN la secuencia que codifica la proteína acetilcolinesterasa sensible a los insecticidas organofosforados (SS) en el exón IV, porcentaje que disminuía al 12% al analizar el exón VII (Figura 5A).
Al representar sobre un mapa los resultados de cada población analizada, es interesante observar que ambas mutaciones están ampliamente distribuidas, se encuentran en todas las poblaciones y además en alta frecuencia, mayoritariamente en dos copias cada una (RR) (Figura 5B). Esta unión de las dos mutaciones y en las dos copias de ADN (RR exón IV + RR exón VII) puede suponer una ventaja selectiva para las moscas en un entorno olivarero tratado con insecticidas. En este contexto, estudios en laboratorio señalan que la presencia conjunta de estas mutaciones (en exón IV y VII) no perjudica la supervivencia de la mosca, incluso sin estar expuesta a los insecticidas (Vontas et al. 2002). Las moscas resistentes parecen sobrevivir sin gran coste biológico aun cuando se deja de tratar el olivar con insecticidas, o en olivares no tratados. Por otro lado, considerando la capacidad de dispersión de las moscas del olivo, el flujo genético también parece influir en la frecuencia y amplia distribución de estas dos mutaciones en las poblaciones españolas de B. oleae.
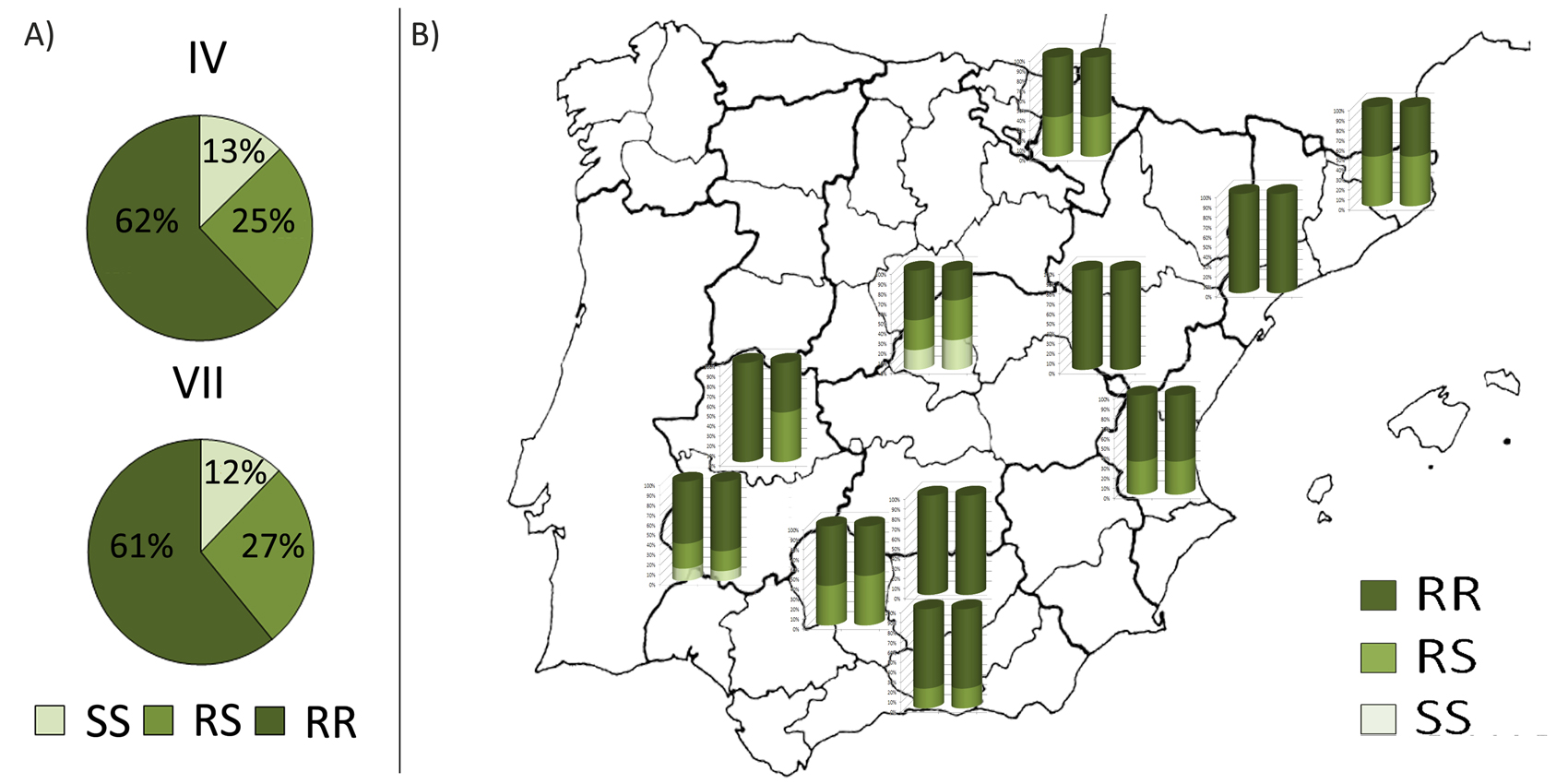
Figura 5. Representación de las frecuencias de las mutaciones que proporcionan resistencia a OP en el gen 'ace' de las poblaciones españolas de B. oleae. RR: individuos con dos copias de la resistencia en el fragmento concreto de ace indicado, RS: individuos con una copia de la resistencia, SS: individuos sin la mutación. A) En el conjunto de las poblaciones españolas. B) En cada una las poblaciones de mosca del olivo muestreadas; barra izquierda: exón IV, barra derecha: exón VII.
Asimismo, en el mapa se evidencia cierto gradiente de este a oeste en la frecuencia de las resistencias. Las muestras de Tarragona, Valencia o Málaga presentaron una mayor frecuencia de las mismas. Hacia el oeste, en las poblaciones de Madrid, Cáceres o Badajoz aumenta la proporción de moscas con una (RS) o dos copias (SS) de ADN en el fragmento IV y en el VII, que les hace sensibles a los insecticidas organofosforados (Figura 5B). Esta tendencia puede deberse, en parte, a diferente presión selectiva. En las regiones litorales las temperaturas son más suaves y la humedad más elevada. Por ello, hay un mayor número de generaciones de mosca del olivo que en el interior de la península, lo que se traduce en diferencias en la intensidad del ataque de la plaga y en la diferente necesidad de aplicar medidas de control, que sería mayor en zonas litorales.
Hay que contemplar, además, el tipo de manejo del olivar en cada región. Desde 1992 Extremadura lidera la producción ecológica agraria nacional (Junta de Extremadura, Dirección general de Agricultura y Ganadería), cuya extensión abarca más de 80000 ha (datos de 2016) de las que aproximadamente el 35% se dedica al olivar, lo que conlleva un uso bastante limitado de tratamientos químicos ante plagas (Subdirec. Gral. Calidad Diferenciada y Agricultura Ecológica, MAPAMA). Sobre estas poblaciones de B. oleae existiría una menor presión de selección que podría explicar, en cierta medida, la menor frecuencia de resistencias a insecticidas organofosforados detectada. Se han obtenido resultados similares o inferiores en muestras portuguesas (Pereira-Castro et al. 2015; Lantero, 2018; Nobre et al., 2019). En ellas, la frecuencia de individuos resistentes a organofosforados es menor que otras poblaciones europeas, incluidas las españolas. La baja presión selectiva ejercida durante décadas debido a un reducido número de tratamientos a insecticidas en estos olivares (ASAJA Jaén, 2017) pueden haber jugado un papel relevante en este bajo nivel de resistencia.
En definitiva, las poblaciones españolas de la mosca del olivo tienen una alta frecuencia de resistencias genéticas frente a insecticidas organofosforados y estas resistencias están ampliamente distribuidas, lo que constituye un reto para el sector olivarero. Como el número de productos autorizados para el control de B. oleae va disminuyendo, es imprescindible salvaguardar su eficacia a largo plazo mediante un empleo apropiado de los mismos. Para reducir los niveles poblacionales de la mosca y prevenir las resistencias, resulta necesario promover el uso racional de todas las alternativas de control disponibles (cultural, biológico, técnicas de trampeo masivo y de atracción y muerte…), como recomienda el IRAC. También es recomendable alternar productos con diferente modo de acción, priorizando los tratamientos cebo -control de adultos- sobre los tratamientos a toda la copa del árbol. No hay que olvidar que es necesario emplear siempre productos autorizados para cada tipo de producción y seguir las recomendaciones proporcionadas por el fabricante para una gestión de la mosca del olivo adecuada y ambientalmente respetuosa.

Referencias bibliográficas
- Hawkes, N.J. et al. (2005). “Detection of resistance associated point mutations of organophosphate insensitive acetylcholinesterase in the olive fruit fly Bactrocera oleae (Gmelin)”. Pesticide Biochemistry and Physiology, 81: 154-163.
- Kakani, E.G. et al. (2013). “Detection and geographical distribution of the organophosphate resistance associated Δ3Q ace mutation in the olive fruit fly, Bactrocera oleae (Rossi)”. Pest Management Science, 70: 743-750.
- Kampouraki, A. et al. (2018). “Recent evolution and operational impact of insecticide resistance in olive fruit fly Bactrocera oleae populations from Greece”. Journal of Pest Science, 91: 1429–1439.
- Lantero, E. (2018). Estudio genético de la plaga del olivo Bactrocera oleae (Rossi 1790) y su aplicación al control biológico. Tesis Doctoral. Universidad Complutense. Madrid.
- Nardi, F. et al. (2006). “Geographical distribution and evolutionary history of organophosphate-resistant ace alleles in the olive fly (Bactrocera oleae)”. Insect Biochemistry and Molecular Biology, 36: 593-602.
- Nobre, T. et al. (2019). “A re-evaluation of olive fruit fly organophosphate-resistant ace alleles in Iberia, and field-testing population effects after in-practice dimethoate use”. Insects, 10 (8): 232.
- Pereira- Castro, I. et al. (2015). “Bactrocera oleae (Diptera: Tephritidae) organophosphate resistance alleles in Iberia: Recent expansion and variable frequencies”. European Journal of Entomology, 112: 20-26.
- Skouras, P.J. et al. (2007). Organophosphate resistance in the olive fruit fly Bactrocera oleae populations in Greece and Cyprus. Journal of Pest Science, 63: 42 – 48.
- Vontas, J.G. et al. (2002). “Resistance-associated point mutations of organophosphate insensitive acetylcholinesterase, in the olive fruit fly Bactrocera oleae.” Insect Molecular Biology, 11: 329–336.javascript:void('body')



















