El AOVE contiene ácidos grasos nitrados: moléculas con potentes propiedades a nivel antiinflamatorio y cardiovascular

Por otro lado, la interacción del NO con diferentes tipos de ácidos grasos no saturados genera unas novedosas moléculas denominadas ácidos grasos nitrados, nitrolípidos o nitroalquenos (NO2-FA). En sistemas animales se ha demostrado extensamente que estos compuestos median un amplio abanico de respuestas celulares (Delmastro-Greenwood et al. 2014; Freeman et al. 2008; Schopfer et al. 2011), entre las que destacan importantes propiedades antiinflamatorias y de prevención de enfermedades cardiovasculares.
Sin embargo, en plantas es escasa la información acerca de la presencia y la función de estos ácidos grasos nitrados. En este sentido, recientemente se ha determinado la presencia endógena de ácido nitro-linoleico conjugado (NO2-cLA) en el AOVE (Fazzari et al. 2014) y la existencia de ácido nitro-linolénico en plantas de Arabidopsis thaliana (Mata-Pérez et al. 2016).
El AOVE constituye la principal fuente de ácidos grasos de la Dieta Mediterránea, el cual se conoce también por ser considerado el ‘oro líquido’ debido a sus propiedades nutricionales y antioxidantes. Este alimento funcional contiene elevados niveles de ácidos grasos monoinsaturados, entre los que destaca el ácido oleico con efectos positivos sobre la protección de la salud cardiovascular.
Pero hasta el momento nadie sabía a ciencia cierta por qué el aceite de oliva era capaz de prevenir enfermedades cardiovasculares. De hecho, estamos considerando una clase de novedosos ácidos grasos, que encontramos por primera vez en el aceite de oliva y las aceitunas, y que explica parte de los beneficios del aceite (Fazzari et al. 2014).
En este sentido y debido al importante papel que tienen los ácidos grasos nitrados en sistemas animales y el valor tanto nutricional como de salud del AOVE, el presente estudio describió por primera vez la detección y caracterización del contenido endógeno de NO2-Ln en AOVEs procedentes de frutos de olivo de las variedades picual y arbequina.
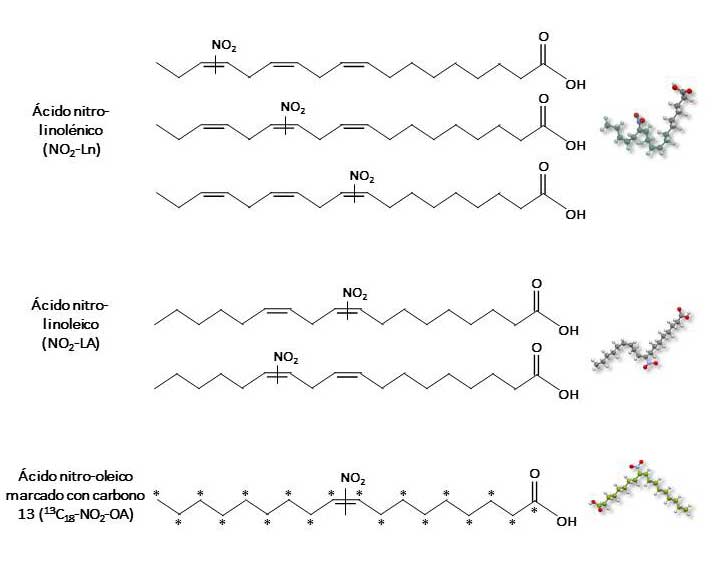
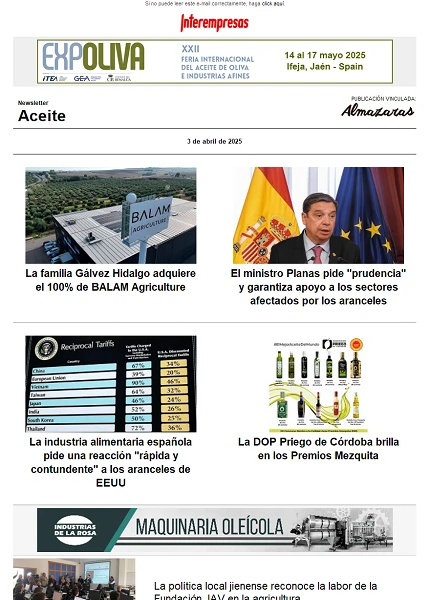
Figura 1. Estándares de diferentes NO2-FAs sintetizados mediante nitroselenación.
Para ello, en primer lugar se llevó a cabo la síntesis de diferentes estándares de ácidos grasos nitrados como son el ácido nitro-oleico (NO2-OA), ácido nitro-oleico marcado con carbono 13 (13C18-NO2-OA), ácido nitro-linoleico (NO2-LA) y NO2-Ln (Figura 1). Todos estos patrones se sintetizaron mediante un proceso de nitroselenación descrito previamente en la literatura (Mata-Pérez et al. 2016). A continuación, se procedió a la recolección de los frutos de aceituna de las variedades picual y arbequina a partir de los cuales se generaron los distintos AOVEs (Figura 2). Este proceso se llevó a cabo en las instalaciones de los servicios técnicos de la Universidad de Jaén utilizando el sistema Abencor (Figura 3), que reproduce a escala de laboratorio el proceso industrial de obtención del AOVE. Posteriormente, se analizó la composición de ácidos grasos de los aceites obtenidos de la variedad Picual y Arbequina mediante cromatografía de gases acoplada a espectrometría de masas (GC-MS/MS) (Tabla 1). En ambos aceites, el ácido graso mayoritario fue el ácido oleico, llegando a alcanzar hasta un 80% del contenido lipídico total en la variedad picual. En cuanto al contenido de ácido linolénico, este fue muy similar en ambas variedades con un 0,8 y 0,7% en las variedades picual y arbequina respectivamente.


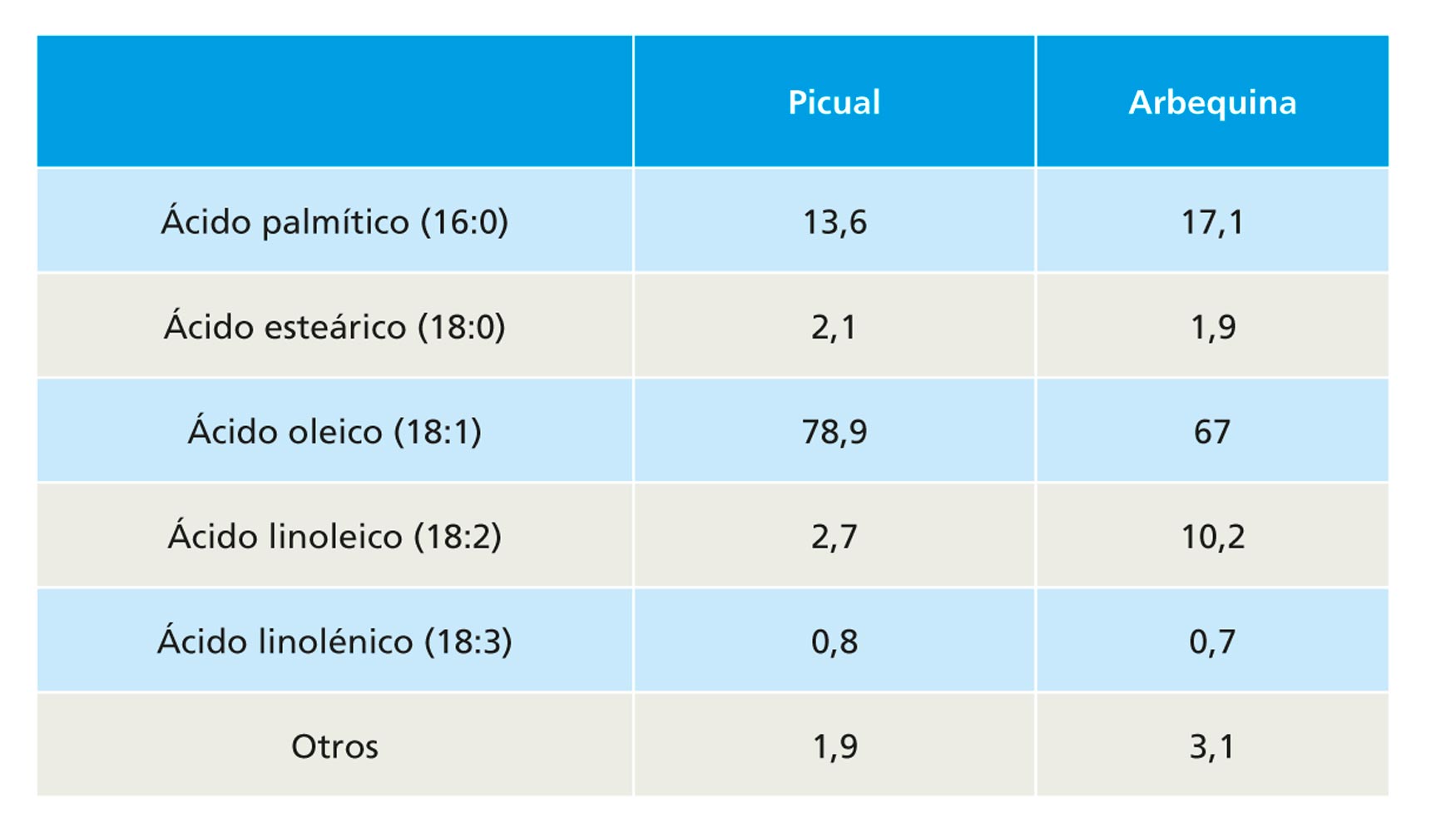
Por último, se llevó a cabo el análisis de la presencia de los ácidos grasos nitrados mediante una técnica extremadamente sofisticada, que permite la detección de estas moléculas con una alta capacidad de detección y sensibilidad, como es la cromatografía líquida de alta resolución acoplada a espectrometría de masas (HPLC-MS/MS) y que requiere la utilización de costosos equipos como los espectrómetros de masas de triple cuadrupolo (Figura 4). En la Figura 5 se muestran los cromatogramas correspondientes al análisis mediante HPLC-MS/MS en el que únicamente se detecta la presencia de ácido nitro-linolénico (NO2-Ln), lo cual se corroboró debido a que el tiempo de retención del estándar de NO2-Ln sintetizado coincidía exactamente con el observado en la muestra de aceite analizada.
Estos datos revelan que los AOVEs constituyen una fuente y reserva metabólica de ácidos grasos nitrados. De forma, que dadas las propiedades reconocidamente antiinflamatorias de los ácidos grasos nitrados, es factible plantear que niveles elevados de estos derivados lípidos estén presentes en el aceite de oliva, actuando además como nuevos indicadores de calidad de los AOVEs en relación con sus acciones beneficiosas sobre la salud cardiovascular.

Figura 5. Análisis de la presencia de ácidos grasos nitrados (NO2-Fas) en AOVE de las variedades Picual y Arbequina mediante HPLC-MS/MS. Cromatogramas correspondientes a diferentes estándares de ácidos grasos nitrados y detección endógena de NO2-Ln en aceite de la variedad Picual en el estadio de 23 SDF. Para ello, se analizaron diferentes transiciones MRM: m/z 326/279 para el NO2-OA, m/z 324/277 para el NO2-LA y m/z 322/275 para el NO2-Ln. En el Panel A se muestra el cromatograma correspondiente al estándar de ácido nitro-oleico (NO2-OA) y cómo la presencia de este ácido graso nitrado no se detecta en la muestra de aceite picual 23 SDF analizado. En el panel B se observa este mismo comportamiento también con el ácido nitro-linoleico (NO2-LA). Por último, el panel C muestra el estándar correspondiente al ácido nitro-linolénico (NO2-Ln) el cual coincide en tiempo de retención con los picos detectados en la muestra de aceite picual 23 SDF. Los picos están referidos a una intensidad total de iones correspondiente a 2.00 e4. La línea vertical punteada indica picos con el mismo tiempo de retención.
Referencias bibliográficas
- Begara-Morales, J.C., Chaki, M., Sánchez-Calvo, B., Mata-Pérez, C., Leterrier, M., Palma, J.M., et al. (2013) Protein tyrosine nitration in pea roots during development and senescence. Journal of experimental botany 64: 1121-1134.
- Beligni, M.a.V. and Lamattina, L. (2001) Nitric oxide: a non-traditional regulator of plant growth. Trends in plant science 6: 508-509.
- Beligni, M.V. and Lamattina, L. (2000) Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyl elongation, three light-inducible responses in plants. Planta 210: 215-221.
- Corpas, F.J., Chaki, M., Begara-Morales, J.C., Valderrama, R., Sánchez-Calvo, B. and Barroso, J.B. (2016) Functional Implications of S-Nitrosothiols under Nitrooxidative Stress Induced by Abiotic Conditions. Advances in Botanical Research.
- Corpas, F.J., Chaki, M., Fernández-Ocaña, A., Valderrama, R., Palma, J.M., Carreras, A., et al. (2008) Metabolism of reactive nitrogen species in pea plants under abiotic stress conditions. Plant and cell physiology 49: 1711-1722.
- Chaki, M., Carreras, A., López-Jaramillo, J., Begara-Morales, J.C., Sánchez-Calvo, B., Valderrama, R., et al. (2013) Tyrosine nitration provokes inhibition of sunflower carbonic anhydrase (β-CA) activity under high temperature stress. Nitric Oxide 29: 30-33.
- Chaki, M., Fernández-Ocaña, A.M., Valderrama, R., Carreras, A., Esteban, F.J., Luque, F., et al. (2009a) Involvement of reactive nitrogen and oxygen species (RNS and ROS) in sunflower–mildew interaction. Plant and Cell Physiology 50: 265-279.
- Chaki, M., Valderrama, R., Fernández-Ocaña, A.M., Carreras, A., López-Jaramillo, J., Luque, F., et al. (2009b) Protein targets of tyrosine nitration in sunflower (Helianthus annuus L.) hypocotyls. Journal of experimental botany 60: 4221-4234.
- Delmastro-Greenwood, M., Freeman, B.A. and Wendell, S.G. (2014) Redox-dependent anti-inflammatory signaling actions of unsaturated fatty acids. Annual review of physiology 76: 79.
- Fazzari, M., Trostchansky, A., Schopfer, F.J., Salvatore, S.R., Sánchez-Calvo, B., Vitturi, D., et al. (2014) Olives and olive oil are sources of electrophilic fatty acid nitroalkenes. PloS one 9: e84884.
- Feechan, A., Kwon, E., Yun, B.-W., Wang, Y., Pallas, J.A. and Loake, G.J. (2005) A central role for S-nitrosothiols in plant disease resistance. Proceedings of the National Academy of Sciences 102: 8054-8059.
- Freeman, B.A., Baker, P.R., Schopfer, F.J., Woodcock, S.R., Napolitano, A. and d'Ischia, M. (2008) Nitro-fatty acid formation and signaling. Journal of Biological Chemistry.
- Mata-Pérez, C., Sánchez-Calvo, B., de las Nieves Padilla-Serrano, M., Begara-Morales, J.C., Luque, F., Melguizo, M., et al. (2016) Nitro-fatty acids in plant signaling: nitro-linolenic acid induces the molecular chaperone network in Arabidopsis. Plant physiology 170: 686-701.
- Schopfer, F.J., Cipollina, C. and Freeman, B.A. (2011) Formation and signaling actions of electrophilic lipids. Chemical reviews 111: 5997-6021.
- Valderrama, R., Corpas, F.J., Carreras, A., Fernández-Ocaña, A., Chaki, M., Luque, F., et al. (2007) Nitrosative stress in plants. Febs Letters 581: 453-461.