Obtención de composites biomédicos de poli (ε-caprolactona), nanohidroxiapatita y alúmina por electrohilado
Los biopolímeros se han venido presentando como una gran solución a la conservación del medio ambiente y el desarrollo de nuevas aplicaciones, principalmente que recaen en una aplicación biomédica. Poli ε-caprolactona (PCL) es un biopoliéster alifático lineal y se obtiene a partir de la ε-caprolactona. La biocompatibilidad de PCL por sí misma es adecuada, sin embargo su bioactividad no es suficiente para muchas aplicaciones. Su copolimerización con otros polímeros y combinación con partículas bioactivas tales como hidroxiapatita (HA) pueden mejorar su bioactividad.
En este proyecto de investigación se sintetiza y caracteriza un composite de PCL-HANPs- AlNPs, con mayor bioactividad y con propiedades mecánicas reforzadas, debida a la adición de nanopartículas de hidroxiapatita (HANPs) y de nanopartículas de alúmina (AlNps=Al2O3). El material compuesto obtenido se propone para un potencial uso como material de soporte biomédico modificando distintos parámetros de procesamiento de la técnica de electrohilado. Las Fibras de PCL-HANPs-AlNPs se obtuvieron con un voltaje aplicado entre 12 y 16 kV. Las nanofibras son uniformes sin defectos y presentan un diámetro promedio aproximado de una micra con partículas de hidroxiapatita y alúmina embebidas en el interior de las fibras.
1. Introducción
La nanomedicina ha avanzado en el campo de los biomateriales con el fin de incrementar la calidad de vida de las personas. Éstos pueden ser compuestos de diversos materiales pero todos deben cumplir con el requisito de ser biocompatibles, resistentes y funcionales. El óxido de aluminio o alúmina (α-Al2O3), es un cerámico sólido, blanco, altamente estable y químicamente inerte. Sus propiedades dependen del arreglo atómico de sus celdas unitarias. Generalmente los números de coordinación formados son 4 y 6 por lo que existen dos formas geométricas posibles, tetraédrica y octaédrica. Las propiedades mecánicas que destacan en este cerámico son: alta dureza, conductividad térmica, alto módulo elástico, aislamiento eléctrico y coeficiente de expansión térmica, sin embargo su resistencia a la fractura es baja [1].Además de dichas características, la α-Al2O3, es bioinerte ya que presenta una mínima alteración física y química in vivo. Esto ha permitido su utilización en los últimos 30 años para prótesis dentales y de cabeza de fémur [2]. Por su parte, la (1, 7)-poli oxepan-2-ona o poli-épsiloncaprolactona (PCL) es un poliéster alifático, semicristalino e hidrofóbico, posee baja viscosidad y gran flexibilidad, y su peso molecular va desde los 3.000 a 80.000 g/mol.
Otra característica apreciable es su biocompatibilidad, debido a que su estructura puede asemejar la matriz extracelular de tejidos vivos, conjuntamente es bioreabsorbible puesto que su degradación ocurre lentamente mediante reabsorción y excreción. Entre sus aplicaciones se incluyen suturas, sistemas de liberación de drogas, catéteres para sangre y envasado de fármacos [3].
Actualmente se utilizan diversas técnicas que permiten la fabricación de materiales nanoestructurados. En fechas recientes, el electrohilado ha destacado como una técnica de gran potencial para la manipulación de una gran variedad de materiales a escalas nanométricas. La formación de dichas estructuras se logra a partir del paso de una solución polimérica por un campo eléctrico, lo cual permite transformar un chorro de solución polimérica en miles de gotas dispersas que finalmente se convierten en nanofibras por diferencia de cargas. Distintos parámetros pueden afectar la síntesis de nanofibras por electrohilado, sin embargo pueden ser englobados en 5: temperatura, concentración de la solución, voltaje aplicado, velocidad de inyección y distancia de recolección [4]. Por ello en la presente investigación se propone el uso de nanofibras obtenidas por la técnica de electrohilado hechas con Policaprolactona (PCL), Hidroxiapatita (HA) y α-Alúmina (Al2O3), compuestos que por separado no son tóxicos, biocompatibles y podrían utilizarse para la regeneración o sustitución de tejido óseo. Las fibras se elaboraron y se caracterizaron por microscopia óptica y electrónica. Se evaluó si las fibras tienen efecto genotóxico mediante el ensayo Cometa en linfocitos de sangre periférica humana (LPH) y el efecto citotóxico por medio de un ELISA midiendo los niveles de TNF α en el suero de la misma sangre. Los resultados de este estudio muestran que la fibra no tiene efectos genotóxicos ni citotóxicos en los LPH.
2. Descripción del método
- 2.1. Síntesis de polvos de alúmina y hidroxiapatita
Para la síntesis del precursor metalorgánico de alumina se utilizó una relación estequiométrica de ácido fórmico: aluminio de 1:1.5 según Reyes [5,6]. Primeramente se corta una lámina de aluminio en cuadros pequeños, en segunda instancia se lavan con agua destilada para retirar las impurezas. Posteriormente el aluminio se sumerge en una solución mercúrica etanolica para activar el aluminio, después se retira el aluminio de la solución del catalizador, y finalmente se agrega el ácido fórmico concentrado (HCOOH), manteniendo agitación constante la reacción a una temperatura de 60 °C.
Para la síntesis de la HA se utilizó nitrato de calcio tetrahidradato, fosfato de amonio e hidróxido de amonio. La reacción se llevó a cabo por medio de precipitación en medio básico, una vez sintetizada la Hidroxiapatita se dejó reposando a temperatura ambiente después se realizaron los procesos de lavado, secado, molienda y suspensión de partículas.
- 2.2. Ruta de obtención de fibras
Se prepararon soluciones de PCL al 8 y 10% (P/V) disolviendo pellets de PCL en acetona mediante agitación magnética. Los polvos de alúmina (α-Al2O3) y hidroxiapatita (HA) se agregaron a las soluciones poco a poco hasta saturarlas. Posteriormente la mezcla se agitó mediante un ultrasonicador para asegurar su homogeneidad. Las soluciones PCL/α-Al2O3/HA se sometieron al proceso de electrohilado bajo distintas condiciones de velocidad de inyección, voltaje y distancia, modificadas a partir de las condiciones atmosféricas.
- 2.3. Caracterización por espectroscopía infrarroja (IR) y análisis térmico (ATG y ATD)
Se realiza la caracterización por espectroscopía infrarroja, en un espectrómetro Brucker Alpha-Platinum-ATR, mediante la técnica de reflexión total atenuada (ATR), con un cristal de diamante, con 32 barridos de 400 a 4.000 cm-1 y a una resolución de 4 cm-1. Para el análisis térmico se colocan 40 mg de las fibras en un crisol de alúmina a una velocidad de calentamiento de 10 °C/min, en un rango de 25 a 1.200 °C y con un flujo de nitrógeno de 100 cm3/min, para la obtención del térmograma de comportamiento térmico en un equipo calorimétrico (marca SDT y modelo Q-600).
- 2.4. Caracterización por microscopía electrónica de barrido (MEB)
Se realiza el análisis topográfico, morfológico y composicional de 50 mg del material en un microscopio electrónico de barrido (marca JEOL y modelo JEOL-JSM-7600F) utilizando el detector Labe (Low angle baskater electron) y utilizando 15 kV.
- 2.5. Caracterización genotóxica y citóxica
Se realizaron tratamientos con diferentes concentraciones de la nanofibra a los LPH por 2,4 y 24 h de exposición a 37 °C. Se realizaron geles con agarosa normal (1%) y con linfocitos, se agregó 90 μl de agarosa LMPA 0,5 % Gibco a 37 °C. Se colocaron en una solución de lisis final (2,5 M de NaCl, 100 mM de EDTA, 10 mM de Trisma-base pH 10), aforada a 100 ml con 1% Tritón-X y 10% DMSO10% por 1 h. Posteriormente, se pusieron en la cámara de electroforesis y se cubrieron con amortiguador alcalino frío [NaOH (300 mM) + 1 mM de EDTA] a pH 13,0 por 20 min, la electroforesis fue a 300 mA y 25 Volts durante 20 minutos. Después se lavaron con amortiguador neutralizante Tris (0,4 M pH= 7,5) por 5 min y fijados con etanol absoluto frío por 10 min. En cuanto al efecto inmunotóxico se aisló el suero sanguíneo de todos los lotes experimentales y se usaron 100 μl para detectar los niveles de TNF-α.
3. Análisis y discusión de resultados
Síntesis de polvos de α-alúmina e hidroxiapatita
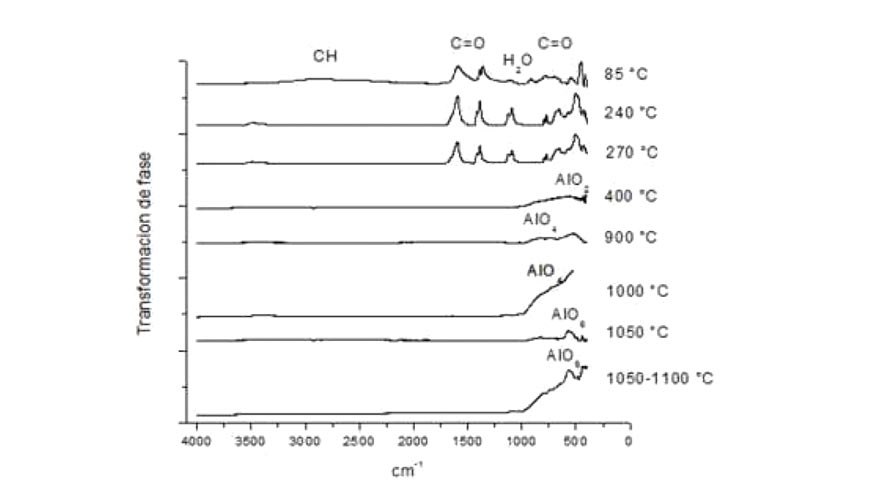
Al calcinar el precursor metaloorgánico formiato de alumino a las diferentes temperaturas mencionadas se obtuvieron distintas fases de alúmina hasta llegar a la fase más estable, los polvos correspondientes a la α-Al2O3eran finos y de color blanco mate. En la figura 1, correspondiente a espectroscopia infrarroja, se observa la modificación y pérdida gradual de los grupos funcionales característicos del formiato de aluminio, (O2CH)n, y agua hasta la generación del óxido de aluminio. La transformación de fases inicia entre los 270 y 400 °C y culmina con la formación de la fase alfa pura a los 1.050-1.100 °C.
La espectroscopia infrarroja de la hidroxiapatita muestra dentro la región de longitud de onda 3.500 a 3.000 cm-1, las bandas de estiramiento de los grupos OH. En las longitudes 1.300 a 1.100 cm-1 se aprecian las vibraciones de los grupos CO3, y finalmente en la región de las longitudes de onda de 1.000 a 900 cm-1 se observan las bandas de los enlaces PO4 por estiramiento asimétrico.
El análisis por espectroscopia infrarroja de las fibras electrohiladas de PCL, muestra que las bandas más características se presentan a 2.949 cm-1 para los grupos metileno en vibración asimétrica; a 2.865 cm-1 para los grupos metileno con vibración simétrica; a 1.727 cm-1 para el grupo carbonilo; a 1.293 cm-1 para los enlaces carbono-oxígeno (C-O) y carbono-carbono (C-C); a 1.240 cm-1 para los enlaces carbono-oxígeno-carbono (C-OC) con vibración asimétrica; a 1.190 cm-1 para los enlaces oxígeno-carbono-oxígeno (OC-O) con vibración simétrica y a 1.157 cm-1 para los enlaces carbono-oxígeno que se encuentran en la región cristalina del polímero.
En la figuras 2 y 3 se pueden observar nanofibras de PCL al 8% con HA al 6 % y Al2O3 al 1%. Se puede apreciar cómo se distribuye la HA y Al2O3 a lo largo de la fibra de PCL.

Figura 2. Micrografías MEB de PCL al 8% con HA al 6% y Al2O3 al 1% en diferentes aumentos (Zona 1).

Figura 3. Micrografías MEB de PCL al 8 % con HA al 6 % y Al2O3 al 1 % en diferentes aumentos (Zona 2).
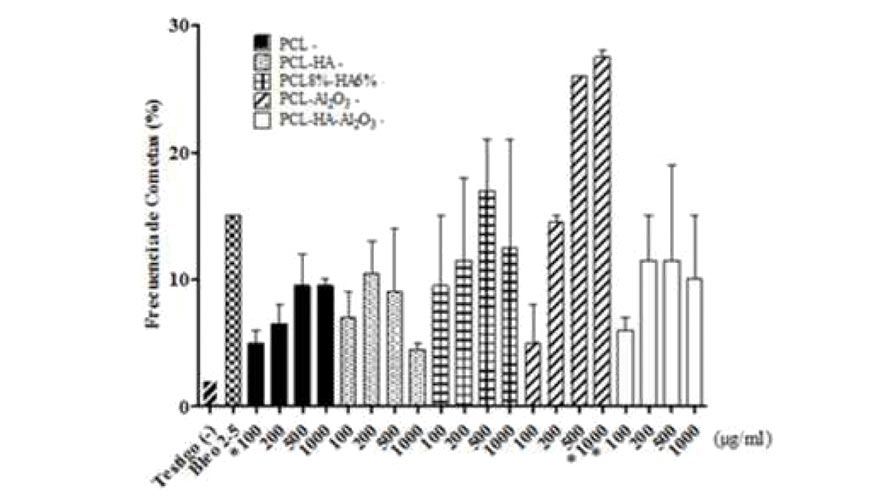
La respuesta genotóxica de los linfocitos en sangre periférica a las 24 horas de exposición ante los diferentes tratamientos (figura 4) de las nanofibras no es diferente del testigo negativo con excepción de los tratamientos de PCL10%-Al2O32,5% correspondientes a 500 μg/ml (26%) y 1.000 μg/ml (28%) y la Bleomicina a 2,5 μl/ml (15%) de acuerdo al ANOVA de un factor con una prueba de comparación múltiple Newman-Keuls (P 0,05).
4. Conclusiones
El análisis de espectroscopia infrarroja y de microscopia electrónica demuestra que se logró exitosamente la síntesis de las nanopartículas de HA y Al2O3 y la obtención de fibras de PCL-alúmina-HA El porcentaje de ADN dañado fue menor significativamente que el testigo negativo, en los tratamientos de 200 μg/ml de nanofibras de PCL, 500 y 1.000 μg/ml de PCL8%-HA6%, 1000 μg/ml de PCL10%-Al2O32,5% y los de 200 y 1.000 μg/ml de fibras de PCL8%-HA6%-Al2O31%, por lo tanto el porcentaje de ADN dañado es más influenciado por el periodo de exposición a las fibras en todos los casos.
Los materiales utilizados para elaborar las fibras liberan especies reactivas de oxigeno que provocan daño indirecto a los linfocitos, sin embargo muestra ser transitorio y poco significativo, por lo que se asume que es un material viable debido a que las fibras que presentaron ligera genotoxicidad (PCL10%-Al2O32,5%) reparan el daño a las 24 horas de exposición.
Referencias
[1] Acchar y Segadães. Properties of sintered alumina reinforced with niobium carbide. Int. Journal of Refractory Metals and Hard Materials, (2009), 27:427–430.
[2] Sastre, Aza, San Román. Biocerámicos. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo. Faenza Editrice Iberica S.L. Italia, (2000).
[3] Vert, Li, Spenlehauer, Guerin. Bioresorbability and biocompatibility of aliphatic polyesters. J Mater Sci Mater Med. (1992),3:432–46.
[4] Nam, Jin. Electrospun polycaprolactone scaffolds under strain and their application in cartilage tissue engineering, (2006).
[5] Reyes, Serrato, Sugita. Low-temperature formation of alpha alumina powders via metal organic synthesis. Adv. In Tech. of Mat. Proc. J., (2006), Vol. 8 (1) 55-62.
[6] Reyes, S. et al (2013). Analysis of the phase transformation of aluminum formate to α-alumina by Raman and infrared spectroscopy, J. Ceram. Procs. Res. Vol. 14, No. 5, 627-631.




















