La tecnología SIGS representa una alternativa prometedora a los fungicidas químicos
El silenciamiento génico inducido por pulverización: Una revolución en la protección de cultivos
Irene T. Bocos Asenjo1,2, Jonatan Niño Sánchez1,2
1 Departamento de Producción Vegetal y Recursos Forestales, ETSIIAA, Universidad de Valladolid, 34004 Palencia. jonatan.nino@uva.es
2 Instituto Universitario de Investigación en Gestión Forestal Sostenible (iuFOR), ETSIIA, Universidad de Valladolid, 34004, Palencia. ITBA: Investigadora predoctoral JNS: Profesor Ayudante Doctor
22/07/2024El silenciamiento génico inducido por pulverización, conocido como SIGS por sus siglas en inglés (Spray-Induced Gene Silencing), representa una innovadora técnica en biotecnología agrícola. Esta metodología se basa en la aplicación externa de ARN de doble cadena (ARNdc) sobre un organismo, con el objetivo de regular específicamente la expresión de uno o varios genes a través del mecanismo de ARN de interferencia (ARNi). Este fenómeno, descubierto inicialmente en el nematodo Caenorhabditis elegans, ha sido posteriormente demostrado en una amplia variedad de organismos, incluyendo animales, mamíferos, plantas y hongos.
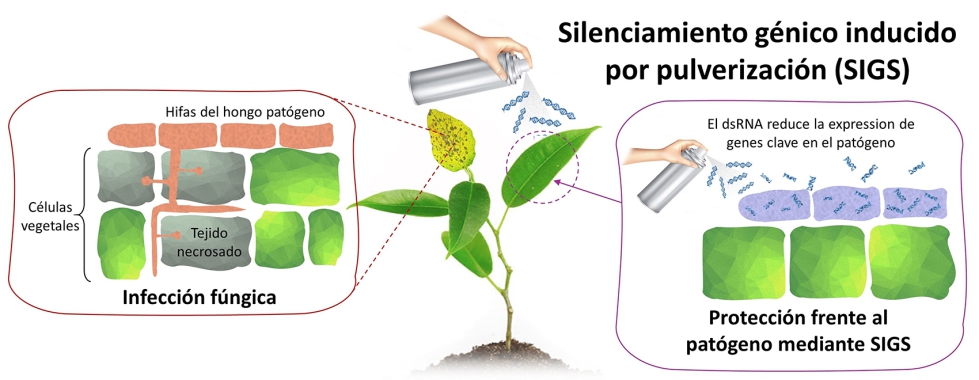
Fotografía 1. Esquema de la tecnología SIGS: Silenciamiento génico inducido por pulverización.
Mecanismo de acción y aplicaciones en agricultura
En el contexto de la protección de cultivos, el ARNdc se diseña específicamente para ser complementario a los genes del patógeno implicados en el proceso de infección. Una vez que el ARNdc entra en las células del patógeno, reconoce y se une a los transcriptos [ARN mensajeros (ARNm)] correspondientes a estos genes, 'silenciando' su expresión mediante el mecanismo de ARNi. El proceso de ARNi, conservado en los organismos eucariotas, degrada transcriptos específicos para evitar su traducción. En SIGS esta especificidad se dirige hacía genes que traducen proteínas o enzimas importantes para el desarrollo y/o virulencia del patógeno, cuyo silenciamiento produce una inhibición en la capacidad del patógeno de causar enfermedades en las plantas (ver Fotografía 1).
Sorprendentemente, en 2018, y dos años después de las primeras aplicaciones de SIGS (Wang et al., 2016; Koch et al. 2016), un estudio reveló que durante la infección, de manera natural las plantas son capaces de enviar ARNdc a patógenos fúngicos para inhibir su virulencia (Cai et al., 2018). Este fenómeno, conocido como ARN de interferencia entre reinos, se describió por primera vez en Arabidopsis thaliana (una planta modelo en estudios genéticos). Se demostró que esta planta puede enviar ARNdc al patógeno fúngico B. cinerea como mecanismo de defensa, a través de vesículas extracelulares. Este descubrimiento demostró que, en la naturaleza, las plantas utilizan mecanismos de ARNi para protegerse de sus patógenos. Además, establece la base teórica de la tecnología del Silenciamiento Génico Inducido por Huésped o HIGS por sus siglas en inglés (Host-Induced Gene Silencing).
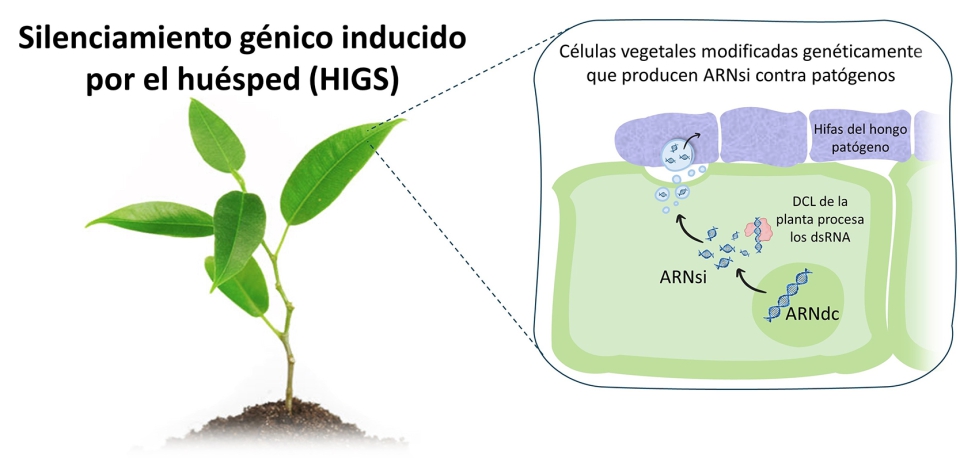
En HIGS, es necesario obtener plantas modificadas genéticamente que produzcan por sí mismas ARNdc diseñados específicamente para controlar un patógeno (ver Fotografía 2), a diferencia de la tecnología SIGS, cuya aplicación de ARNdc es externa (ver Fotografía 1). Un buen ejemplo de aplicación HIGS es el control de Fusarium oxysporum f. sp. cubense TR4, causante de la enfermedad de Panamá en el banano banano (Ghag et al., 2014). En este estudio, se generaron plantas capaces de producir ARNdc dirigido contra genes de virulencia de F. oxysporum, como FTF1 y velvet (Niño-Sánchez et al., 2016), consiguiendo lograr una resistencia efectiva contra el patógeno. Aunque la tecnología HIGS ha demostrado ser eficaz en numerosos patosistemas, no se ha implementado de manera generalizada debido a su principal inconveniente: el uso de plantas modificadas genéticamente, lo cual enfrenta limitaciones en su aplicación actual.
En este sentido, la tecnología SIGS ofrece la ventaja de no requerir plantas modificadas genéticamente. Además, comparte con la tecnología HIGS otras ventajas del control de enfermedades mediante ARNi. Primero, la eficiencia y seguridad dependen de la homología entre las secuencias del gen diana y la molécula de ARNdc aplicada. Esta precisión minimiza el riesgo de efectos no deseados tanto en la planta como en el microbioma. En SIGS, cualquier efecto adverso sería transitorio y fácilmente corregible mediante la rápida sustitución del ARNdc, a un coste reducido. Además, no es necesaria una homología completa, lo que impide que el patógeno escape de su control mediante la generación de mutaciones puntuales, evitando así la aparición de estirpes resistentes, un problema creciente con el uso de fungicidas tradicionales.
En segundo lugar, SIGS es una técnica muy versátil porque una sola molécula de ARNdc puede ser quimérica, dirigida a varios genes de un mismo patógeno, lo que teóricamente aumentaría su eficacia. Además, puede ser específica de genes de distintos patógenes, incluso si no están relacionados filogenéticamente. Por ejemplo, se puede diseñar un único ARNdc que tenga como diana un gen esencial en un hongo patógeno y un gen esencial del insecto vector que lo transmite. Esto es posible ya que SIGS también ha demostrado ser eficaz en el control de plagas (Jain et al., 2022).
En tercer lugar, la aplicación de ARNdc se considera una técnica respetuosa con el medio ambiente y completamente segura para el ser humano. En caso de persistencia en el ambiente, el ser humano es capaz de digerir estas moléculas en su tracto digestivo sin ningún riesgo.
Ejemplos de casos satisfactorios en la aplicación de SIGS
Botrytis cinerea, un patógeno que afecta a diversas especies vegetales y productos de postcosecha, se ha establecido como un modelo de estudio ideal para la técnica SIGS debido a su impacto económico y su manejabilidad en el laboratorio. En 2016, se demostró que SIGS es efectivo en el control de la podredumbre gris causada por B. cinerea en frutos como el tomate, la fresa y la uva, así como en cultivos de lechuga, cebolla y rosa (Wang et al., 2016). En este estudio inicial, los genes diana seleccionados fueron BcDCL1 y BcDCL2, esenciales para el patógeno. Investigaciones posteriores han identificado nuevas dianas útiles para el control de B. cinerea mediante SIGS, incluyendo genes responsables del tráfico de vesículas (BcVPS51, BcDCTN1 y BcSacI), de la síntesis de ergosterol (BcERG11, BcERG1, BcERG13), y otros genes esenciales como BcTIM44, BcTRR1, BcPRD11 y BcNOB1.
En 2016, también se confirmó la efectividad de SIGS en el control de la fusariosis de la espiga del trigo, causada por Fusarium graminearum. En este caso, los genes parálogos Cyp51, responsables de codificar la proteína 14-? lanosterol demetilasa, fueron el objetivo génico (Koch et al., 2016). Esta proteína está directamente involucrada en la síntesis de ergosterol, una molécula fundamental en la integridad de la membrana celular fúngica. Es importante destacar que los fungicidas azoles, se dirigen a la misma enzima, causando daño en la membrana celular fúngica, lo que resulta en la muerte celular y la inhibición del crecimiento del hongo.
Desde entonces, numerosos patógenos fúngicos han demostrado ser susceptibles a la técnica SIGS. Algunos ejemplos incluyen Sclerotinia sclerotiorum en hojas de lechuga, coles y colza, Verticillium dahliae en la planta modelo Arabidopsis thaliana, Aspergillus niger en frutos, Rhizoctonia solani y Magnaporthe oryzae en arroz, así como los oomicetos patógenos Plasmopara viticola en vid y Phytophthora infestans en patata. Es particularmente relevante el estudio reciente sobre el control mediante SIGS del patógeno fúngico Fusarium circinatum, causante del chancro resinoso del pino. Este estudio demuestra cómo la tecnología SIGS, además de ser útil en el sistema agrícola, puede ser un aliado importante en el control de enfermedades en el sistema forestal, donde las restricciones en el uso de fitosanitarios son más estrictas (Bocos-Asenjo et al., 2024).
Limitaciones, desafíos y avances nanotecnológicos en SIGS
A pesar de los prometedores resultados, la aplicación generalizada de SIGS en la agricultura enfrenta diversos desafíos. Un primer requisito fundamental es que el patógeno receptor pueda eficientemente internalizar las moléculas de ARNdc aplicadas externamente. Aunque algunas especies, como Colletotrichum gloeosporioides o ciertas oomicetos del género Phytophthora, presentan ciertas limitaciones en este aspecto, en general, los hongos patógenos de naturaleza filamentosa demuestran capacidad para incorporar el ARNdc aplicado. Una vez el ARNdc se encuentra dentro de la célula, resulta esencial que el patógeno disponga de la maquinara completa de ARNi para desencadenar el silenciamiento génico: incluyendo proteínas Dicer para procesar el ARNdc en ARN interferente pequeño (ARNsi), el complejo RISC (con proteína Argonauta activa) para dirigir el ARNsi hacia el ARNm diana mediante la complementariedad de secuencias, y proteínas RdRP que amplifiquen la señal de silenciamiento génico para lograr una acción sistémica. Afortunadamente, la mayoría de las especies patógenas cumplen con estos requisitos, dado que estos mecanismos se consideran esenciales para el adecuado desarrollo de organismos eucariotas. No obstante, es necesario evaluar este criterio para cada patógeno específico.
Otro desafío importante es el coste asociado a la producción del ARNdc. Aunque desde 2008 ha habido una notable disminución en los costos, cuando la producción de 1 gramo de ARNdc rondaba los $12.500, la actualidad muestra una reducción significativa, estableciéndose en tan solo $0,5 por gramo (Bocos-Asenjo et al., 2022).
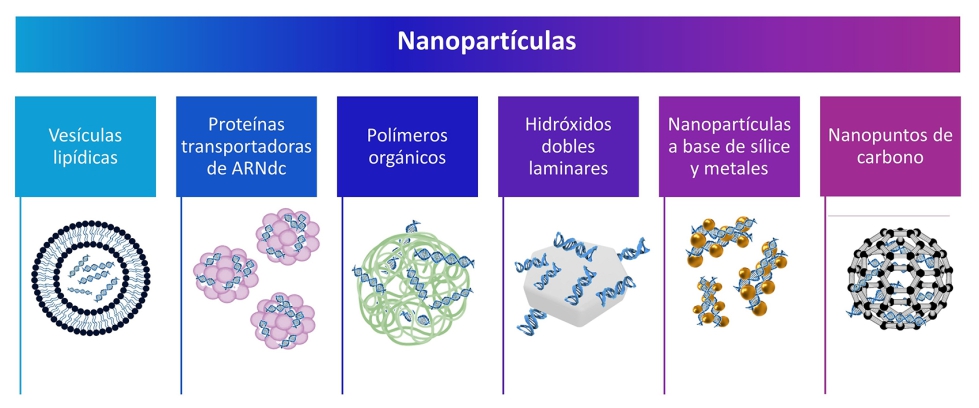
Sin embargo, el principal desafío actual para la aplicación de la tecnología SIGS en condiciones de campo radica en la inestabilidad del ARNdc en el entorno exterior, siendo susceptible a la radiación, la lluvia y la acción de las nucleasas presentes en las superficies de los tejidos vegetales. Si el ARNdc se degrada antes de poder ser internalizado por las células del organismo patógeno, no puede desencadenar el proceso de ARNi, lo que resulta en una ineficacia de la tecnología SIGS. Para superar este obstáculo, se están desarrollando métodos de encapsulación en nanopartículas que protegen el ARNdc y garantizan su entrega eficiente al patógeno (ver Fotografía 3). La nanotecnología ofrece soluciones innovadoras para mejorar la estabilidad y eficacia del ARNdc. Las nanopartículas se pueden clasificar en tres grandes grupos: orgánicas, inorgánicas y basadas en carbono.
Entre las nanopartículas orgánicas se destacan las vesículas lipídicas, las proteínas transportadoras de ARNdc y los polímeros orgánicos. Las vesículas lipídicas son especialmente efectivas en la protección del ARNdc contra la acción de las nucleasas. Se ha observado su eficacia en el control de B. cinerea en vid y en varios tipos de frutos, extendiendo el período de protección hasta tres semanas contra la podredumbre gris en comparación con tratamientos que utilizan ARNdc desnudo (Qiao et al., 2023) (ver Fotografía 4). Aunque las proteínas transportadoras de ARN están bien establecidas en el ámbito médico, se requiere más investigación para su aplicación en la protección de cultivos, debido a sus costos elevados y a los desafíos asociados con la entrega eficiente de ARNdc. Por otro lado, los polímeros orgánicos, como el quitosano, están siendo ampliamente utilizados en la encapsulación de diversas moléculas orgánicos, incluido el ARNdc. Han demostrado ofrecer protección efectiva, por ejemplo, contra R. solani en arroz (Wang et al., 2023).

Fotografía 4. La aplicación de ARNdc mediante vesículas artificiales (derecha) extiende la protección contra la podredumbre gris causada por B. cinerea durante tres semanas en hojas de vid, debido a un aumento en la estabilidad y durabilidad de las moléculas de ARNdc.
Entre las estrategias de utilización de nanopartículas inorgánicas, una de las más investigadas es el empleo de hidróxidos dobles laminares (LDH), que combinados con el ARNdc han dado lugar al producto BioClay™. Este enfoque ha demostrado prolongar la protección en plantas de tomate, uva y garbanzo contra la podredumbre gris causada por B. cinerea (Niño-Sánchez et al., 2022) (ver Fotografía 5). Además de su eficacia contra hongos patógenos, se ha observado que el BioClay™ también resulta útil en la protección contra virus (Mitter et al., 2017) y la mosca blanca (Jain et al., 2022).
Las nanopartículas basadas en carbono, como los nanopuntos de carbono, nanoperlas, nanotubos, fullerenos y otros, se distinguen por su estructura estable, alta reactividad química y amplia superficie de carga. Algunos de estos materiales ya han sido evaluados para la entrega de ARNdc en cultivos como el tomate y el tabaco, así como para la protección en arroz contra R. solani.

Fotografía 5. La aplicación de ARNdc mediante BioClayTM (derecha) extiende la protección contra B. cinerea hasta un mes después de su aplicación en plantas maduras de garbanzo.
Conclusión
A medida que se superen las limitaciones actuales y se desarrollen nuevas aplicaciones, los productos basados en ARNdc podrían complementar significativamente las estrategias tradicionales de control de patógenos
Agradecimientos
Este trabajo ha sido posible gracias al proyecto SIGSbyBEVS (101068728), financiado por la Unión Euroea mediante el programa Horizon - MSCA; el proyecto SUPERA (PLEC2021-008076) financiado por el MINECO mediante el programa Líneas estratégicas; el proyecto VA178P23 financiado por la Junta de Castilla y León en el programa de Apoyo a proyectos de investigación; y por la ORDEN EDU/601/2020 Ayudas destinadas a financiar la contratación predoctoral de personal investigador, cofinanciados con el Fondo Social Europeo.
Referencias
Bocos-Asenjo, I. T. et al. (2022). New Insights on the Integrated Management of Plant Diseases by RNA Strategies: Mycoviruses and RNA Interference. Int. J. Mol. Sci. 23, 9236.
Bocos-Asenjo, I. T. et al. (2024). Spray-induced gene silencing (SIGS) as a tool for the management of Pine Pitch Canker forest disease. bioRxiv 2024.03.05.583474.
Cai, Q. et al. (2018). Plants send small RNAs in extracellular vesicles to fungal pathogen to silence virulence genes. Science (80-.). 360, 1126–1129.
Ghag, S. B., Shekhawat, U. K. S. & Ganapathi, T. R. (2014). Host-induced post-transcriptional hairpin RNA-mediated gene silencing of vital fungal genes confers efficient resistance against Fusarium wilt in banana. Plant Biotechnol. J. 12, 541–553.
Jain, R., Fletcher, S. & Mitter, N. (2022). Effective RNAi-mediated control of the crop pest whitefly. Nat. Plants 2022 85 8, 461–462.
Koch, A. et al. (2016). An RNAi-Based Control of Fusarium graminearum Infections Through Spraying of Long dsRNAs Involves a Plant Passage and Is Controlled by the Fungal Silencing Machinery. PLOS Pathog. 12, e1005901.
Mitter, N. et al. (2017). Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses. Nat. Plants 2017 32 3, 1–10.
Niño-Sánchez, J. et al. (2016). The FTF gene family regulates virulence and expression of SIX effectors in Fusarium oxysporum. Mol. Plant Pathol. 17, 1124–1139.
Niño-Sánchez, J. et al. (2022). BioClayTM prolongs RNA interference-mediated crop protection against Botrytis cinerea. J. Integr. Plant Biol. 64, 2187–2198.
Qiao, L. et al. (2023). Artificial nanovesicles for dsRNA delivery in spray-induced gene silencing for crop protection. Plant Biotechnol. J. 21, 854–865.
Wang, M. et al. (2016). Bidirectional cross-kingdom RNAi and fungal uptake of external RNAs confer plant protection. Nat. Plants 2016 210 2, 1–10.
Wang, Y. et al. (2023). Nanoparticle carriers enhance RNA stability and uptake efficiency and prolong the protection against Rhizoctonia solani. Phytopathol. Res. 5, 1–11.

























