La Normativa de la UE sobre los productos sanitarios entra en vigor en 2020
Volker Watzke, director del sector de productos sanitarios para la UE de Domino Printing Sciences (Domino)
31/10/2019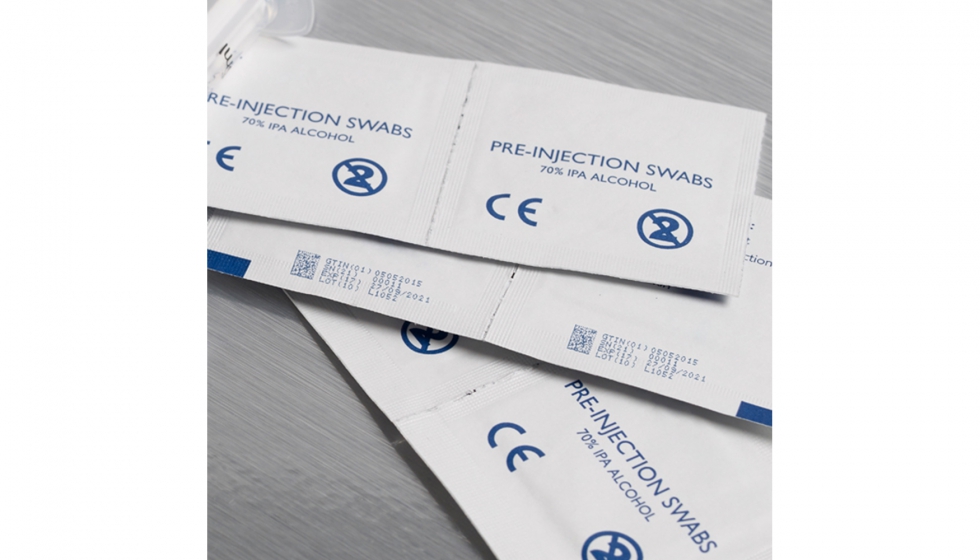
¿Qué exige la Normativa de la UE sobre los productos sanitarios?
La Normativa de la UE sobre los productos sanitarios entrará en vigor el 26 de mayo de 2020, y sustituirá a la Directiva 93/42/CEE relativa a los productos sanitarios y la Directiva 90/385/CEE sobre los productos sanitarios implantables activos, ambas vigentes en la UE.
Como parte de la normativa, los fabricantes de productos sanitarios a la venta en la UE deben acatar estrictas directrices para garantizar el uso seguro de sus productos. Esta abarca todos los productos sanitarios vendidos en la UE, desde bisturís y agujas hasta marcapasos, lentes de contacto y extremidades protésicas.
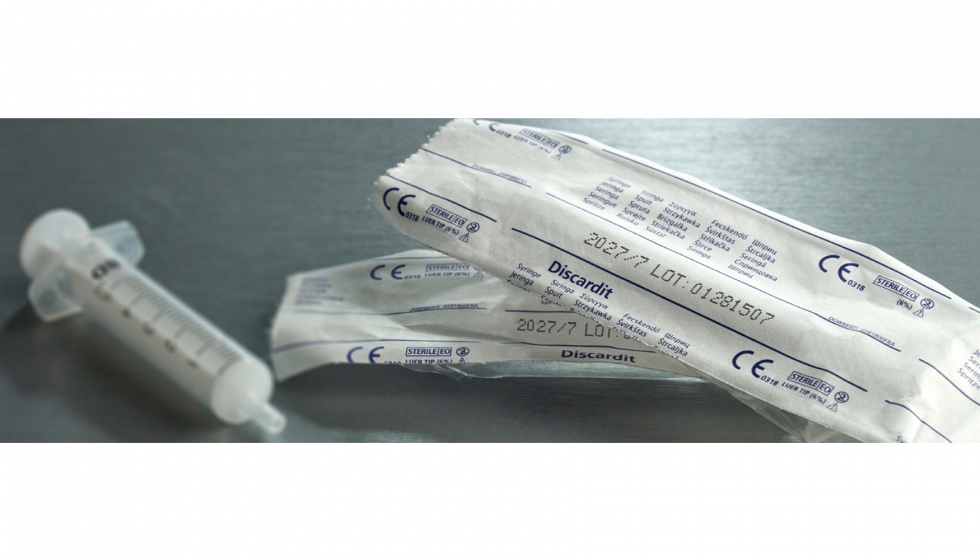
A partir del 26 de mayo de 2020, tendrá que asignarse a todos los productos sanitarios un código UDI (Identificación Única del Producto (UDI). Los productos de clase III y clase IIa/b deberán tener su código UDI indexado y registrado en una base de datos centralizada de la UE llamada EUDAMED, la base de datos europea sobre productos sanitarios.
Los fabricantes de productos de clase III y clase IIa/b serán responsables de compartir los datos de los productos con arreglo al anexo VI, parte B, de la normativa. Los fabricantes de productos de clase I también habrán de recopilar y guardar los datos de los productos, pero solo tendrán que facilitar esta información de ser solicitada.
La introducción de la nueva Normativa de la UE sobre los productos sanitarios obliga a los fabricantes de este tipo de aparatos a invertir en tecnología que permita la aplicación rápida y precisa de códigos de trazabilidad en los productos y los envases, de forma individualizada en cada uno de los artículos.
Si no cumplen estos procedimientos, esos productos podrían retirarse de la venta, y los fabricantes de este tipo de productos no podrán seguir suministrando sus productos a otros Estados miembros de la UE.
¿En qué fase nos encontramos?
Los fabricantes de productos sanitarios deberán mantenerse al corriente de las novedades en cuanto se produzcan, y acudir a autoridades como GS1, así como a los organismos notificados y sus socios de confianza, para obtener asesoramiento y asistencia. Las conferencias, los seminarios web y otros eventos ofrecen abundante información relativa a la mejor manera de gestionar sus procedimientos y prepararse para la nueva normativa.
En el momento en que se redactaron estas líneas, estaba previsto que las especificaciones técnicas de Eudamed se publicaran a finales de 2019. Hasta ahora, los fabricantes han tenido la ventaja de contar con un boletín técnico, proporcionado por la Comisión Europea, que facilita información sobre el modo en que deben presentarse los datos. El boletín técnico atiende las distintas necesidades de cada fabricante.
Los fabricantes tendrán aproximadamente 5-6 meses desde la publicación de las especificaciones técnicas de Eudamed y la fecha final del registro. Por consiguiente, es recomendable empezar a recabar datos lo antes posible. Los fabricantes tendrán que recopilar los datos de cada producto con arreglo al anexo VI, parte B, de la Normativa de la UE sobre los productos sanitarios, y empezar a preparar los datos para compartirlos a través de Eudamed.
Además de preparar todos los datos antes de mayo de 2020, la fecha límite, los fabricantes han de cerciorarse de que cuentan con socios adecuados que les asistan durante el proceso. A fin de garantizar que sus productos cumplen con la nueva normativa, los fabricantes deberán acudir a su entidad emisora de códigos y los organismos notificados en busca de asesoramiento.
Actualmente, algunos grandes fabricantes de productos sanitarios destinan hasta el 25% de su base de empleados a adaptar sus procedimientos a la norma. Es poco probable que los pequeños y medianos fabricantes tengan capacidad para dedicar tanto personal de su plantilla y deberán barajar la posibilidad de solicitar asistencia externa.
Entidades emisoras
En junio de 2019, GS1 se convirtió en la primera entidad emisora de códigos de conformidad con la Normativa de la UE sobre los productos sanitarios, de modo que los códigos DataMatrix 2D y GS1-128 ya pueden utilizarse. Se prevé que otras entidades emisoras la imiten, con lo que es posible que se usen códigos de HIBCC e ICCBBA en el futuro.
Organismos notificados
Como parte de las Directivas vigentes de la UE (90/385/CEE) y (93/42/CEE), los fabricantes auditan y verifican sus productos periódicamente para garantizar el cumplimiento. Los organismos notificados asisten a los fabricantes en este proceso para que se puedan vender los productos nuevos y existentes. De los 57 organismos notificados en Europa que se ocupan de la legislación vigente, solo 38 han solicitado la acreditación para la Normativa de la UE sobre los productos sanitarios. En el momento de redactarse este texto, solo cuatro organismos notificados habían conseguido la nueva acreditación.
Los fabricantes pueden elegir el organismo notificado que deseen para sus productos, pero deben tener en mente que algunos organismos notificados existentes ya no podrán asistirles una vez que entre en vigor la Normativa de la UE sobre los productos sanitarios. El proceso nuevo de acreditación es mucho más complicado y, como tal, en torno a 20 organismos notificados no han cursado la solicitud.
La repentina falta de organismos notificados supone un problema para los fabricantes que pretenden obtener la acreditación de sus productos, y puede suponer un obstáculo para la innovación, ya que las empresas emergentes tienen dificultades para encontrar financiación. Las empresas emergentes que pretendan registrar sus productos deberán acudir a uno de los cuatro organismos notificados recién acreditados en busca de asesoramiento.
Una repercusión mundial
La Normativa de la UE sobre los productos sanitarios abarca todos los artículos vendidos en la UE, pero esto no significa que los Estados miembros de la UE son los únicos que deben cumplir los requisitos. Todos los fabricantes que deseen vender sus productos en la UE han de cerciorarse de que cumplen los requisitos de la Normativa de la UE sobre los productos sanitarios, o puede que sus productos se vean retirados del mercado.
Del mismo modo, los fabricantes que estén registrados con arreglo a la Normativa de la UE sobre los productos sanitarios deberán centrar su atención en el futuro en garantizar el cumplimiento en distintas partes del mundo donde otras legislaciones pudieran aplicarse. Actualmente, Estados Unidos, India y Corea del Sur están en trámites para aprobar legislación en materia de identificación de productos sanitarios y medicamentos. Por otro lado, actualmente hay debates en curso al respecto en Arabia Saudí, Australia, Brasil, Canadá, China, Colombia, Japón, Nueva Zelanda, Rusia, Singapur y Turquía.
¿Quién ofrece más asesoramiento y asistencia?
Ha llegado el momento de actuar, dado que la fecha límite para garantizar el cumplimiento de la Normativa de la UE sobre los productos sanitarios se aproxima con rapidez.
Los expertos de Domino están a su disposición para ayudarle a garantizar que sus productos cumplan la Normativa de la UE sobre los productos sanitarios que entrarán en vigor próximamente. En Domino, ofrecemos paquetes de validación para ayudar a los fabricantes a autenticar sus productos y prepararse para la acreditación de la Normativa de la UE sobre los productos sanitarios.
La gama de soluciones de codificación y marcaje de Domino ofrece a los fabricantes de productos sanitarios la tecnología más adecuada para cumplir los requisitos de UDI. Póngase en contacto con los expertos de Domino para obtener asesoramiento y asistencia sobre el modo de garantizar que su codificación cumpla la Normativa de la UE sobre los productos sanitarios.