Sensores electroquímicos: una alternativa para la determinación de histamina

Introducción
La histamina (Fig. 1) es una amina biogénica de gran importancia, tanto en el campo de la medicina, como a nivel alimentario.
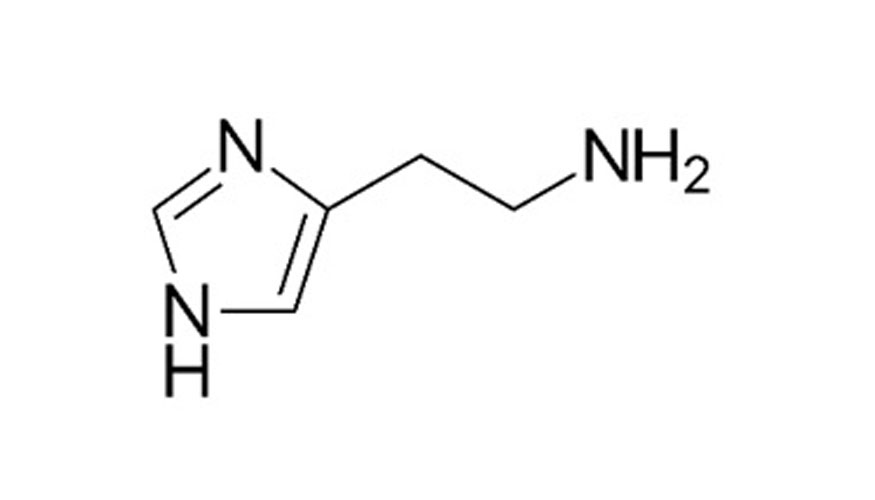
Se encuentra presente en una gran parte de los tejidos del organismo y en concentraciones más elevadas en pulmones, piel o tracto gastrointestinal. Es un importante mediador en gran cantidad de reacciones biológicas, destacando la actuación como agente vasoactivo y regulador de funciones fisiológicas relacionadas con la respuesta inflamatoria del cuerpo. Una vez en el torrente sanguíneo, causa una variedad de síntomas, desde rinitis, erupciones cutáneas y en casos graves reacciones anafilácticas.
La determinación de la histamina es un aspecto crítico para la industria y seguridad alimentaria ya que es un indicador de frescura y calidad de muchos alimentos habituales de la dieta. Su determinación es necesaria en carnes, lácteos, mariscos, vinos, cervezas y en general en los productos con alto contenido en histidina, ya que son susceptibles de sufrir una degradación microbiana de este aminoácido esencial para transformarse en histamina, cuya ingesta en exceso puede causar síntomas compatibles con una reacción alérgica.
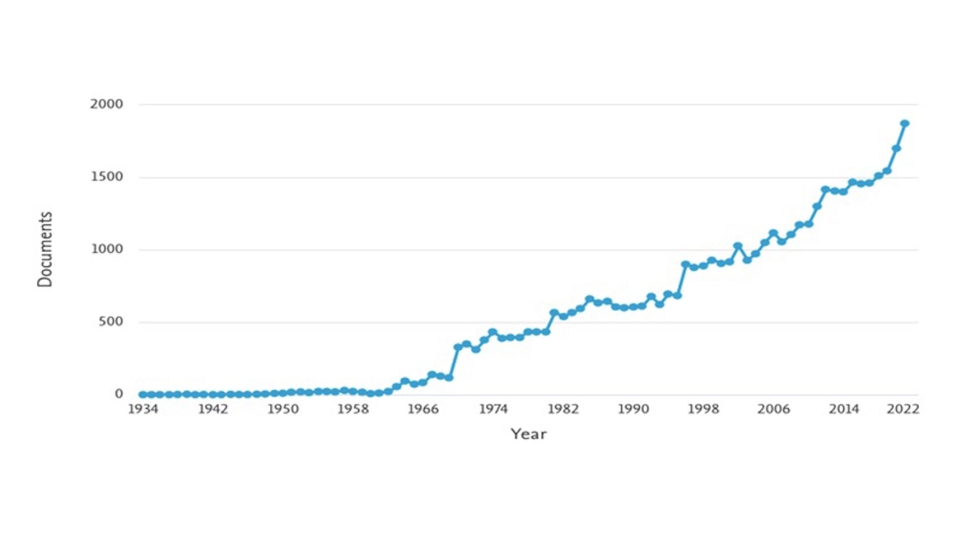
Según las leyes y regulaciones de la Unión Europea (UE) y de la Administración de Medicamentos y Alimentos (FDA), los niveles de histamina no deben superar concentraciones superiores a 100-200 ppm, en el caso de la UE, y de 50 ppm en el caso de FDA. Por tanto, la búsqueda de métodos de análisis sensibles que permitan hacer determinaciones de histamina precisas en los niveles requeridos, sigue siendo un campo de gran interés para muchos investigadores. En efecto, la determinación de histamina a lo largo de los últimos años ha estado muy presente en el ámbito científico, tal y como muestra en la Fig.2 obtenida de la fuente Scopus, que refleja el incremento en el número de artículos científicos a lo largo de los años.
Sensores y biosensores
Un sensor es un dispositivo capaz de cuantificar un analito en una muestra. Su funcionamiento consiste en convertir una propiedad física o química del analito de interés en una señal medible, de tal manera que la magnitud de esa señal sea directamente proporcional a la concentración del analito. Cuando interviene una sustancia de naturaleza biológica el sensor se denomina biosensor.
Una de las partes más importantes de un biosensor es el bioreceptor, que es el elemento de detección que interacciona con el analito. Éste se pone en contacto con un transductor capaz de transformar la información en una señal, que después de pasar por un procesador responde selectivamente al analito problema, evitando interferencias con el resto. Los fundamentos del elemento de detección pueden basarse en fenómenos físicos, químicos y bioquímicos. En los físicos no hay reacción química, sino cambios en propiedades físicas como la absorbancia, el índice de refracción, la temperatura, etc. En los químicos, hay una reacción química involucrada. Por último, los bioquímicos pueden considerarse una subcategoría de los químicos, donde se produce una reacción bioquímica.
Hay distintos tipos de transductores siendo los más ampliamente utilizados los transductores ópticos y los electroquímicos. Estos últimos se han ido implantando con mayor frecuencia a lo largo de los años debido a su simplicidad y bajo coste. A su vez, los transductores electroquímicos se pueden subdividir en muchas categorías en función de la técnica electroquímica utilizada, siendo los más frecuentes los potenciométricos, los voltamperométricos y los amperométricos.
Los sensores y biosensores electroquímicos son una alternativa sensible, precisa y de gran selectividad para la determinación de una gran amplitud de analitos en distintas matrices, y se encuentran en posición de liderazgo entre el resto de los sensores, ya que existe una gran variedad de aplicaciones en diversas áreas industriales, ambientales, agroalimentarias o medicinales.
Biosensores electroquímicos
La electroquímica es una rama de la química analítica que estudia la interacción entre procesos químicos y eléctricos. Las técnicas electroquímicas se llevan a cabo en las llamadas celdas electroquímicas, dispositivos muy simples que constan de dos o tres electrodos (trabajo, referencia y contralectrodo), unidos a un generador de señales, y sumergidos en una disolución electrolítica. En el seno de las celdas tienen lugar las reacciones electroquímicas, que son reacciones de oxidación/reducción que se producen en la interfase electrodo/disolución.
Atendiendo a la magnitud eléctrica que se mide se tienen distintas técnicas siendo las más comunes las técnicas potenciométricas, amperométricas y voltampermétricas. La potenciometría mide el potencial de la celda que se establece entre los electrodos en condiciones de equilibrio. La voltamperometría estudia las relaciones entre la intensidad y el potencial variable aplicado. Por último, la amperometría mide la intensidad de corriente que se origina al aplicar un potencial constante.
Existe gran variedad de electrodos de trabajo, aunque los electrodos serigrafiados son los más utilizados en los dispositivos biosensóricos, debido a que son miniaturizables y desechables, características que confieren gran versatilidad al biosensor. Están constituidos por un soporte de material plástico o cerámico en el que se imprimen los electrodos mediante la técnica de serigrafía empleando distintas tintas conductoras y aislantes. Frecuentemente, el electrodo de trabajo y el contraelectrodo se constituyen por la impresión de una tinta a base de carbono. El electrodo de referencia se conforma utilizando tinta a base de Ag/AgCl (Fig. 3).
Los biosensores utilizan mecanismos biológicos para el reconocimiento de especies particulares. La naturaleza ha desarrollado un amplio conjunto de biomoléculas y estructuras moleculares capaces de reconocer específicamente alguna propiedad particular de una determinada molécula en una mezcla. Los elementos de reconocimiento más utilizados son las enzimas y los anticuerpos. Para que el transductor pueda llevar a cabo su función, es necesario que se encuentre conectado al elemento de detección. Esta conexión, en el caso de los biosensores electroquímicos, se realiza inmovilizando el biomaterial sobre el electrodo de trabajo utilizando distintos métodos que permitan el contacto estrecho con el transductor. Existen cinco procedimientos de inmovilización: adsorción, microencapsulación, atrapamiento, reticulación y formación enlaces covalente.
La adsorción es una unión débil, que se lleva a cabo mediante fuerzas de Van der Waals o enlaces de hidrógeno y solo se adecúa para la utilización del sensor durante cortos periodos de tiempo. La microencapsulación utiliza una membrana inerte para retener al biomaterial en el transductor. El atrapamiento se basa en el uso de un gel polimérico formado a partir de un monómero, que al polimerizar retiene al bioreceptor en la matriz del gel conservando la actividad biológica. La reticulación o entrecruzamiento produce una unión química mediante un enlace intermolecular entre el biomaterial y un reactivo bifuncional, como el glutaraldehído o diisocianato de hexametileno. Por último, en la unión covalente la especie de bioreconocimiento se une mediante un enlace químico covalente a una molécula con la que ha sido previamente funcionalizado el transductor, dando lugar a biosensores muy estables en el tiempo.
Los biosensores electroquímicos combinan el poder analítico de las técnicas electroquímicas con la especificidad de los procesos de reconocimiento biológico. Su finalidad es generar una señal eléctrica de origen biológico para relacionarla con la concentración de un sustrato. Para ello, un reactivo bioespecíifico se retiene en un electrodo capaz de transformar el reconocimiento biológico en una respuesta electroquímica, generalmente potenciométrica, voltamperométrica o amperométrica.
Determinación de la histamina mediante biosensores electroquímicos
En el área agroalimentaria están descritas un gran número de técnicas instrumentales que permiten detectar y cuantificar la histamina en muestras alimentarias. Entre ellas, los sensores electroquímicos han sido ampliamente utilizados como dispositivos para la determinación de histamina, y han demostrado ser una interesante alternativa debido a su bajo coste, facilidad de uso, alta sensibilidad y selectividad en las determinaciones. Además, su capacidad de miniaturización les hace susceptibles para poder ser utilizados in situ.
Existen gran cantidad de aminas biogénicas cuya similitud estructural con la histamina, las convierten en potenciales interferentes. Para solventar este problema se recurre a estrategias muy diversas de modificación del electrodo de trabajo, con la finalidad de aumentar su selectividad frente a otras aminas y también evitar otro tipo de interferentes.
Las modificaciones descritas en bibliografía incluyen la deposición o recubrimiento de los electrodos con nanomateriales, complejantes, polímeros de impresión molecular, mediadores, óxidos metálicos etc., que cumplen con el triple objetivo de aumentar la conductividad, mejorar la inmovilización del bioreceptor para conseguir una mayor interacción con el analito y reducir los potenciales de trabajo.
Así, la utilización de polímeros de impresión molecular producen sitios de unión selectivos que reconocen una molécula particular en una matriz. Nanomateriales como nanopartículas, nanotubos de carbono y grafeno ejercen un efecto catalítico aumentando el área activa del electrodo, lo que redunda en un aumento en la sensibilidad. Moléculas como el ferroceno o el tetratiafulvaleno se han utilizado frecuentemente como mediadores con el objetivo de reducir el potencial de trabajo.
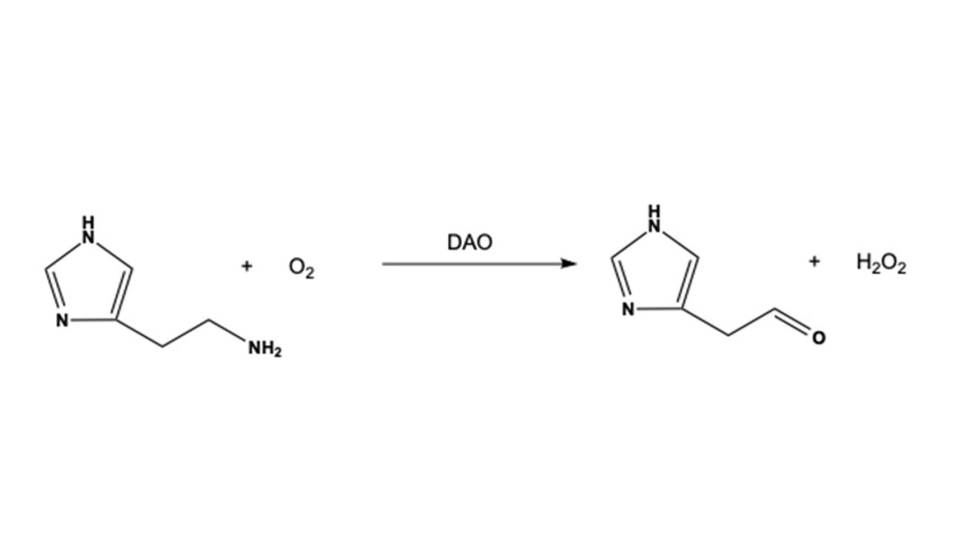
En los biosensores, los bioreceptores más utilizados son las enzimas diamino deshidrogenasa y diamino oxidasa que cataliza la reacción de oxidación del grupo amino de la histamina a aldehído, dando como subproducto peróxido de hidrógeno (Fig 4). Este compuesto es de gran importancia, dado que a menudo, es el detectado por el transductor para relacionarlo con la concentración de histamina.
En la tabla 1 se resumen los distintos métodos encontrados en la bibliografía en los últimos años para la determinación de histamina en distintas matrices por medio de biosensores electroquímicos, mostrando el efecto que los distintos modificadores y técnicas electroquímicas ejercen sobre el potencial de operación, el límite de detección o el intervalo de calibración.
|
Muestra |
Electrodo de trabajo |
Técnica detección |
V (mV) |
Rango lineal (µM) |
LOD (µM) |
Referencia |
|
Pescado y vino |
MIN-PVC |
Pot. |
- |
1-1x105 |
1.12 |
Basozabal I., Guerreiro A., Gómez-Caballero A., Goicolea M. A., Barrio R. J. (2014). Biosensors and Bioelectronics, 58, 138-144 |
|
Vino y orina |
MIP-CPE |
Pot | - |
300-1x105 |
160 |
Basozabal I., Guerreiro A., Gómez-Caballero A., Goicolea M. A., Barrio R. J. (2014). Biosensors and Bioelectronics, 58, 138-144 |
|
Atún |
Au-UME | CV | - | 18-2.5x103 | 3.25x10-6 |
Akbari-Adergani B., Hosseini H., Shekarchi M., Pirali-Hamedani M., (2012). International Journal of Food Properties, 15, 1336-1344 |
|
Vino y orina |
liginina-GCE |
CV y SWV |
190 |
5-200 |
0.28 |
Degefu H., Amare M., Tessema M., Admassie, S. (2014). Electrochimica Acta, 121, 307–314 |
|
Suero |
grafeno-HRP-GCE |
CV | 280 |
9x10-6- 9x10-3 |
4.5x10-6 |
Yang M., Zhang J., Chen X. (2014). Journal of Electroanalytical Chemistry, 736, 88-92 |
|
Cerveza y vino |
SWCNT-CPE |
CV |
1.250 |
4.5-720 |
1.26 |
Stojanovic Z. S., Mehmeti E., Kalcher K., Guzsvány V., Stankovic D. M. (2016). Food Analytical Methods, 9(10), 2701-2710 |
| Suero |
MIP-CPE |
CV | 10 |
7x10-3-0.4 |
7.4x10-5 |
Akhoundian M., Rüter A., Shinde S. (2017). Sensors, 17(3), 645-655 |
|
Pescado |
PU-SPCE |
CV y DPV |
310 |
0.1-100 |
1.7 |
Degefu H., Amare M., Tessema M., Admassie, S. (2014). Electrochimica Acta, 121, 307–314 |
|
Pescado |
DOX-HRP-SWCNT-Fc-SPCE |
Amp. |
50 |
0.3-20 |
0.17 |
Pérez S., Bartrolí J., Fàbregas E. (2013). Food Chemistry, 141, 4066-4072 |
|
Camarón tigre |
DAO-CeO2-PANI-GCE |
Amp. |
100 |
450-1x103 |
48.7 |
Gampu M., Nesakumar N., Sethuraman S., Krishnan U., Rayappan J. (2014). Sensors and Actuators B: Chemical, 199, 330-338 |
|
Atún enlatado |
Cu@Pd-PGE |
Amp. |
550 |
0.1-100 |
3.2x10-3 |
Gajjala R., Palathedath S. (2018). Biosensors and Bioelectronics, 102, 242-246 |
|
Salsa de pescado |
ReO2-SPCE |
Amp. |
100 |
4.5-90 |
17.9 |
Veseli A., Vasjari M., Arbneshi T., Hajrizi A., Svorc L., Samphao A., Kalcher K. (2015). Sensors and Actuators B: Chemical, 228, 774-781 |
|
Pescado y vino |
HMD-TTF-SPCE |
Amp. |
130 |
8-60 |
8.1 |
Henao W., del Torno L., Domínguez O., Alonso M.A., Arcos M.J. (2016). Food Chemistry, 190, 818-823 |
|
Pescado |
nPt-GPH-quitosano-SCPE |
Amp. |
400 |
0.1-300 |
0.0254 |
Apetrei I.M., Apetrei C. (2016). Sensors, 16, 422-437 |
|
Pescado |
Co(II)-ftalocianina-CPE Azul de prusia-CPE HRP-Os-CPE |
Amp. |
400 -100 -50 |
100-1x103 |
5.13 4.8 4.5 |
Leonardo S., Campàs M. (2016). Microchim Acta, 183, 1881-1890 |
|
Pescado |
Cu |
Amp. |
200 |
1-750 |
0.33 |
Lin Y., Chen C., Lin M. (2018). Sensors and Actuators B: Chemical, 255, 2838-2843 |
|
Plasma sanguíneo |
AuNPs-MnO2-SCPE |
Amp. |
1.000 |
0.3-5.1 |
0.08 |
Knežević S., Ognjanović M., Nedić N., Mariano J., Milanović Z., Petković B., Antić B., Djurić S., Stanković D. (2020). Microchemical Journal, 155, 1-6 |
|
Atún y caballa |
[Fe(CN)6]3--DOX-SPCE |
Amp. |
200 |
450-670 |
8.7 |
Torre R., Costa-Rama E., Nouws H., Delerue-Matos C. (2020). Journal of Analytical Science and Technology, 11(5), 1-8 |
|
Pescado |
TiO2-MWCNT-Ru-CS-SCPE |
Amp. |
300 |
9.9-1.1x103 56-1.1x103 |
36 |
Koçoglu I.M., Erden P.E., Kiliç E. (2020). Analytical Methods, 12, 3802-3812 |
Tabla 1. Parámetros operativos y características de los métodos electroquímicos publicados en los últimos años para la determinación de histamina por medio de sensores y biosensores electroquímicos.
Amp. amperometría, AuNPs nanopartículas de oro, CPE electrodo de pasta de carbono, CV voltamperometría cíclica, DAO diaminoxidasa, DPV voltamperometría diferencial de impulsos, DOX diaminoxidasa, Fc ferroceno, GCE electro de carbono vitrificado, GPH grafeno, HMD enzima deshidrogenasa, HRP peroxidasa de rábano picante, MIN nanopartículas de impresión molecular, MIP partículas de impresión molecular, MWCNT nanotubos de carbono multipared, nPt nanopartículas de platino, PANI polianilina, Pot. potenciometría, PS polisulfona, PU poliuretano, PGE electrodo tipo lápiz, PVC policloruro de vinilo, SPCE electrodo serigrafiado, SWCNT nanotubos de carbono de pared simple, SWV voltamperometría de onda cuadrada, TTF tetratiafulvaleno, UME ultramicroelectrodo.
Conclusiones
La importancia de la determinación de la histamina en muestras alimentarias para demostrar su calidad y frescura ha incidido en el creciente interés en el desarrollo de diversos métodos de análisis para la determinación de esta molécula. Entre ellos, la utilización de sensores y biosensores electroquímicos ha mostrado ser de gran utilidad para realizar su cuantificación, permitiendo el análisis in situ, sin el requerimiento de personal altamente cualificado. La utilización de sistemas electródicos serigrafiados, junto con ingeniosas y diversas estrategias de modificación empleando elementos de bioreconocimiento como enzimas, combinadas con nanomateriales, complejantes, polímeros, mediadores, óxidos metálicos, y/o mediadores, permiten aumentar la selectividad frente a otras aminas biogénicas y a otros potenciales interferentes, y abordar el análisis de la molécula en matrices complejas.
Por esta razón, estos dispositivos se han convertido en una alternativa para la determinación selectiva y sensible de histamina en un amplio espectro de matrices muy prometedora para la industria.








































