Parámetros de bioquímica sanguínea en bovinos adultos
Romero-Aguirregomezcorta J., Lopes J.S., Coy P., Cánovas S., Romar R. y Gadea J
1 Dept. Fisiología. Universidad de Murcia. Murcia 30.100. 2 IMIB-Arrixaca, Murcia;
Contacto: jgadea@um.es
09/09/2024Las técnicas de reproducción asistida (TRA) han revolucionado la eficiencia y la productividad del sector del ganado bovino, permitiendo un mejor aprovechamiento del potencial reproductivo de animales superiores genéticamente y facilitando una gestión más eficiente de los programas de mejora genética.
Entre las TRA más utilizadas se encuentran la inseminación artificial (IA), la producción in vitro de embriones (PIV) y la transferencia embrionaria (TE). La IA en bovinos se desarrolló a principios del siglo XX, y se vio favorecida por el desarrollo de técnicas eficientes de congelación espermática desde la mitad del siglo pasado, que permiten almacenar las muestras seminales congeladas de animales de alto valor genético en nitrógeno líquido durante largos periodos de tiempo (Foote 2002). Esta técnica ha permitido una rápida difusión de características genéticas deseables y una mejora significativa en la productividad de carne y leche.
Por otro lado, la PIV, que incluye la fecundación in vitro (FIV) y el posterior cultivo embrionario in vitro, se ha convertido en una herramienta crucial para multiplicar el material genético del ganado de alta calidad genética (Rabel et al. 2023). Este proceso implica la obtención de ovocitos, a partir de ovarios obtenidos en el matadero o mediante la aspiración de ovocitos de las hembras donantes (técnica conocida como ovum pick up u OPU), que serán fecundados en laboratorio con semen de animales valiosos genéticamente y el cultivo de los embriones resultantes, de los cuales se puede hacer una biopsia para estudiar el potencial genético del embrión. Finalmente, los embriones se vitrifican mediante un procedimiento específico de congelación para almacenarse en nitrógeno líquido hasta su uso. Posteriormente, la TE permite que los embriones producidos y recogidos de una hembra donante, o los embriones producidos in vitro sean transferidos a hembras receptoras.

La aplicación de estas técnicas de PIV permite utilizar gametos de animales de alto valor genético tanto del toro como de la vaca y posibilita la obtención de múltiples embriones de una sola hembra donante en un ciclo, lo que aumenta significativamente su capacidad reproductiva. También favorece una selección más rigurosa de embriones antes de la transferencia, lo que incrementa las probabilidades de obtener crías de alto valor genético. A pesar de las ventajas que el uso de estas técnicas complejas ofrece, también presentan algunas limitaciones como la necesidad de instalaciones especializadas, equipo costoso y personal altamente capacitado.
Una cuestión que preocupa a la comunidad científica y que aún no ha sido completamente resuelta, es conocer si los animales derivados de las técnicas de PIV pueden presentar diferencias en algunos parámetros fisiológicos y de salud en comparación con los obtenidos mediante IA. En el caso del ganado bovino, muy pocos son los estudios que comparan animales derivados de PIV con los derivados de IA centrados en los parámetros de bioquímica sanguínea (Chavatte-Palmer et al. 2002; Rérat et al. 2005), y a menudo solo incluyen datos sobre los primeros días de vida de los terneros (Sangild et al. 2000) o hasta el primer año de vida (Lopes et al. 2022). Sin embargo, debido a la larga esperanza de vida del ganado bovino, especialmente en el caso de las vacas nodrizas, se requieren estudios a más largo plazo que confirmen los resultados.
Nuestro grupo ha descrito previamente diferencias en el primer año de vida entre animales derivados de embriones PIV, posteriormente vitrificados y transferidos a una hembra receptora, de aquellos animales derivados de IA para algunos parámetros de bioquímica sanguínea (Lopes et al. 2022). El objetivo de este trabajo es estudiar si existen diferencias en los parámetros de bioquímica sanguínea en animales adultos comprendidos entre 1,5 y 4 años de edad.
Material y métodos
Animales
En las instalaciones de la Granja Docente Veterinaria de la Universidad de Murcia se mantuvo un grupo de bovinos, y los animales se alojaron en corrales separados, hembras y machos. Todos ellos dispusieron de agua ad libitum y fueron alimentados con una mezcla de cereales y paja (15,5% de proteína bruta, 2,10% de grasa bruta, 9,30% de fibra bruta, 7,90% de ceniza bruta, 1,40% de calcio, 0,51% de fósforo y 0,41% de sodio).
Se tomaron muestras de sangre en la vena caudal de manera repetida a lo largo del estudio cuando los animales tenían edades comprendidas entre los 1.5 y los 4 años. Estos animales se habían producido mediante IA (IA; 7 animales, 5 machos y 2 hembras, 14 muestras) o mediante PIV, seguida de vitrificación y TE (TEV). En un grupo se realizó un cultivo embrionario clásico (TEV-C; 7 animales, 4 machos y 3 hembras, 18 muestras) y en otro grupo se suplementó el medio de cultivo embrionario con fluido oviductal y uterino, con el objetivo de aportar sustancias que están en estos fluidos de manera fisiológica (TEV-F; 4 animales, 3 machos y 1 hembras, 12 muestras). La descripción completa de la generación de estos animales y su evolución en las primeras fases puede consultarse en (Lopes et al. 2020; Lopes et al. 2022).
Toma de las muestras sanguíneas y análisis de parámetros bioquímicos
Se tomaron muestras de sangre en la vena caudal, utilizando tubos de vacío con heparina de litio como anticoagulante. El plasma sanguíneo se obtuvo por centrifugación de la sangre a 1000G durante 10 minutos, y luego se almacenó a -80°C hasta el análisis. En estas muestras se evaluaron los parámetros de bioquímica en plasma mediante el uso de un analizador automático (Olympus AU400, Japón) en el laboratorio Interlab-UMU de la Universidad de Murcia. La precisión inter e intraensayo de los métodos fue lineal e inferior al 15%.
Los parámetros incluidos fueron: proteínas totales (g/dL), albúmina (g/dL), globulina (g/dL), creatinina (mg/dL), urea (mg/dL), colesterol (mg/dL), triglicéridos (mg/dL), amilasa (UI/L), lipasa (UI/L), creatinina cinasa (CK, UI/L), fosfatasa alcalina (ALP; UI/L), gamma-glutamil transpeptidasa (GGT; UI/L), aspartato aminotransferasa (AST; UI/L), alanina aminotransferasa (ALT, UI/L) y bilirrubina total (mg/dL).
Análisis estadístico
Los datos se analizaron mediante una prueba ANOVA de medidas repetidas con diseño anidado (animal dentro de grupo) y grupo como factor principal, tras comprobar que no había efecto del sexo del animal en los resultados. Se utilizó el programa SPSS (versión 28, IBM). Los modelos anidados permiten diferenciar la variabilidad entre los animales dentro del grupo, del verdadero efecto del grupo, en este caso, de la técnica de reproducción asistida utilizada para generar al animal.
Resultados
Los valores de todos los parámetros estudiados y de todos los animales estaban dentro de los niveles de normalidad (Doornenbal et al. 1988; Kessell 2015), lo que indica que no hay evidencias de que los animales derivados de técnicas de producción in vitro, vitrificación y transferencia presenten anomalías en sus parámetros de bioquímica que indiquen alguna alteración en su salud.
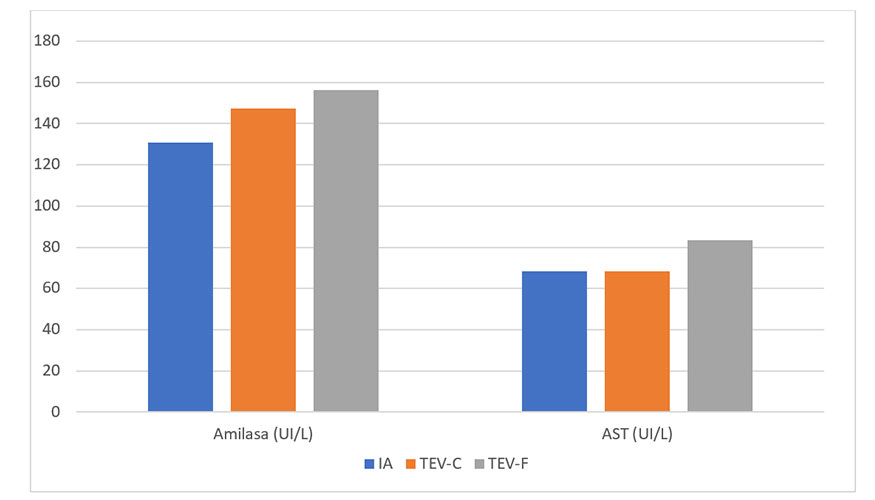
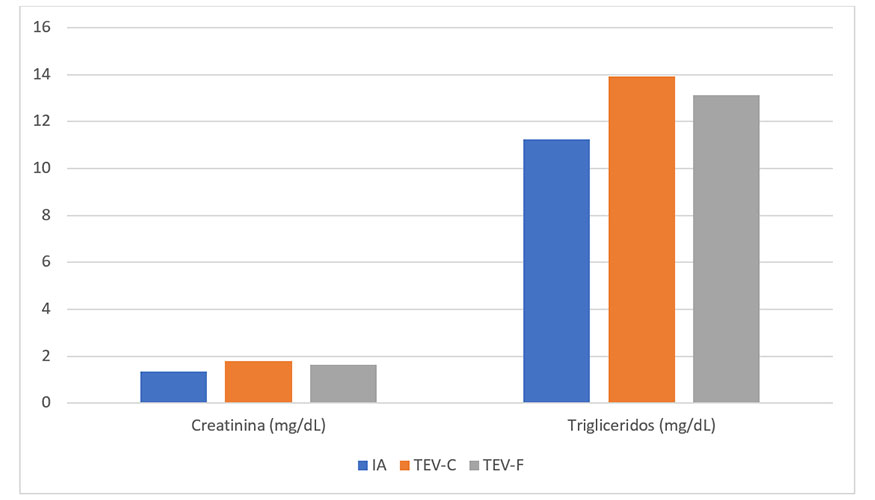
Al analizar si había diferencias entre los valores de los diversos grupos en sus parámetros de bioquímica sanguínea, encontramos diferencias en 4 de los 15 parámetros estudiados, que se detallan a continuación. Los valores de las enzimas amilasa y aspartato aminotransferasa (AST), estaban significativamente elevados en los animales del grupo TEV-C en comparación con los del grupo IA, mientras que los valores del grupo TEV-F fueron similares a los del grupo AI (Figura 1, amilasa P<0.001; AST P>0.05). Estas diferencias en el perfil amilasa-AST no se habían encontrado previamente en estos animales en su etapa juvenil (menos de un año) y ponen de manifiesto que el perfil bioquímico de los animales derivados de TEV-F es más similar al de los AI que al de los derivados del cultivo embrionario clásico (TEV-C), como se ha descrito previamente tanto en bóvidos como en suidos (París-Oller et al., 2021, 2022; Lopes et al., 2020). Los valores elevados de amilasa, una enzima involucrada en la digestión de carbohidratos, y de AST, relacionada con el metabolismo de aminoácidos, podrían indicar un mayor compromiso metabólico en los animales producidos in vitro durante su vida adulta.
Conclusiones
Los parámetros de bioquímica sanguínea de los animales adultos resultantes de la aplicación de técnicas de inseminación artificial o de producción in vitro de embriones seguidos de vitrificación y transferencia embrionaria se encuentran dentro de los valores de referencia, sin que se detecten valores que indiquen alteración de la salud.
No se encontraron diferencias entre animales de diferente sexo para los parámetros estudiados. Se encontraron diferencias significativas para los parámetros de amilasa, aspartato aminotransferasa, creatinina y triglicéridos entre grupos experimentales, que ponen de manifiesto adaptaciones diferentes al metabolismo energético del animal. Las causas de estas diferencias deberán ser estudiadas en el futuro.
Agradecimientos
Este estudio es parte del proyecto PID2020-113366RB-I00 financiado por MCIN/AEI/10.13039/501100011033/ y ‘FEDER Una manera de hacer Europa’.
Nota
Este artículo resume la comunicación presentada en las XX Jornadas sobre Producción Animal, celebradas en Zaragoza, los días 13 y 14 de junio de 2023. Romero-Aguirregomezcorta J., Lopes J.S., Coy P., Cánovas S., Romar R., Gadea J. Parámetros de bioquímica sanguínea en bovinos adultos derivados de inseminación artificial y transferencia de embriones vitrificados producidos in vitro. XX Jornadas de Producción Animal. Asociación Interprofesional para el Desarrollo Agrario (AIDA). Zaragoza. 13-14 junio de 2023. ISBN: 978-84-09-50588-3. Pag. 226.
Referencias
- Chavatte-Palmer P et al. (2002) Clinical, Hormonal, and Hematologic Characteristics of Bovine Calves Derived from Nuclei from Somatic Cells. Biol Reprod 66 (6):1596-1603. doi:10.1095/biolreprod66.6.1596
- Doornenbal H et al. (1988) Reference values of blood parameters in beef cattle of different ages and stages of lactation. Can J Vet Res 52 (1):99-105
- Foote R (2002) The history of artificial insemination: Selected notes and notables. Journal Of Animal Science 80 (E-Suppl 2):1
- Kessell A (2015) Bovine Haematology and Biochemistry. In: Bovine Medicine. pp 146-160. doi:https://doi.org/10.1002/9781118948538.ch16
- Lopes JS et al. (2020) Reproductive Outcomes and Endocrine Profile in Artificially Inseminated versus Embryo Transferred Cows. Animals (Basel) 10 (8):1359. doi:10.3390/ani10081359
- Lopes JS et al. (2022) Year-Long Phenotypical Study of Calves Derived From Different Assisted-Reproduction Technologies. Front Vet Sci 8 (1525):739041. doi:10.3389/fvets.2021.739041
- Rabel RAC et al. (2023) Pre-Implantation Bovine Embryo Evaluation-From Optics to Omics and Beyond. Animals (Basel) 13 (13). doi:10.3390/ani13132102
- Rérat M et al. (2005) In Vitro Embryo Production: Growth Performance, Feed Efficiency, and Hematological, Metabolic, and Endocrine Status in Calves. Journal of Dairy Science 88 (7):2579-2593. doi:https://doi.org/10.3168/jds.S0022-0302(05)72934-9
- Sangild PT et al. (2000) Blood chemistry, nutrient metabolism, and organ weights in fetal and newborn calves derived from in vitro-produced bovine embryos. Biol Reprod 62 (6):1495-1504. doi:10.1095/biolreprod62.6.1495










