Complementos alimenticios inmunoestimulantes en el ganado vacuno extensivo
Barraso, C1; García-Gudiño, J1; Vizcaino, M1; Del Moral, J2; González, F3; García, A1.
1 Producción y Sanidad Animal, Cicytex.
2 Grupo Innofarm Nutrición y Salud.
3 Tegasa
01/09/2023La respuesta de la inmunidad innata y adquirida son las medidas más significativas por medio de las cuales los animales combaten las enfermedades. Mientras la memoria de sistema inmune adaptativo es bien conocida, tanto a nivel celular como molecular, el sistema inmunitario innato no lo es tanto, de manera que las estrategias de prevención frente a las enfermedades se centraban en el sistema inmune adaptativo (vacunas). Sin embargo, el paradigma de la memoria innata ha cambiado recientemente, con pruebas sustanciales que indican que las células inmunitarias innatas se adaptan funcionalmente tras la estimulación o la exposición microbiana. Más específicamente, monocitos circulantes, macrófagos derivados de monocitos y células asesinas naturales (NK), tienen respuestas secundarias modificadas a patrones moleculares asociados a microorganismos, después de un evento inicial de contacto.
El uso de inmunoestimulantes no genera una respuesta específica a un tipo de antígenos, sin embargo, produce una serie de respuestas que aceleran el reconocimiento y eliminación de agentes infecciosos y partículas extrañas (Apines-Amar and Amar, 2015).

Los inmunoestimulantes pueden utilizarse ante situaciones que supongan un estrés añadido y, por tanto, alteren el rendimiento de los animales, o bien, cuando existe el riesgo de una mayor exposición a microorganismos patógenos y parásitos. Los inmunoestimulantes son principalmente agentes profilácticos, por lo tanto, no deben utilizarse para combatir una enfermedad ya instaurada. El concepto de utilizar inmunoestimulantes que aumentan el nivel de resistencia a todos los agentes infecciosos potenciales, despierta entusiasmo y curiosidad en el ámbito de la producción animal.
En las últimas dos décadas, se ha investigado sobre diferentes tipos de inmunomoduladores, los cuales, se agrupan en distintas categorías, en función de su naturaleza: agentes químicos, microrganismos (bacterias y levaduras), polisacáridos, extractos de plantas o animales y/o factores nutricionales.
| Grupo | Molécula/organismo |
| Citoquinas | IL-1, IL-2, IL-6, IFNa, INFg, TNFa, rLI-1 y rIL-2, IL2+ antibióticos, r INF-g |
| Fármacos | Levamisol, Tiobendazol, etc. |
| Microorganismos | Mycobacterium bovis-BCG, Propionibacterium acnes, Paraproxvirus ovis, etc. |
|
Productos microbianos |
Betaglucanos, Mananos, Muramil dipéptido, Extractos de pared celular de Mycobacterium spp., Lipopolisacáridos, etc. |
| Nutracéuticos | Arginina, Betacaroteno, Ácido Lindeico, Isoflavonas, Ácidos grasos poliinsaturados, minerales, vitaminas, etc. |
|
Plantas medicinales |
Panax ginseng, Aloe vera, Echinacea spp., Quillaja saponaria (preferentemente evaluado como adyudante). |
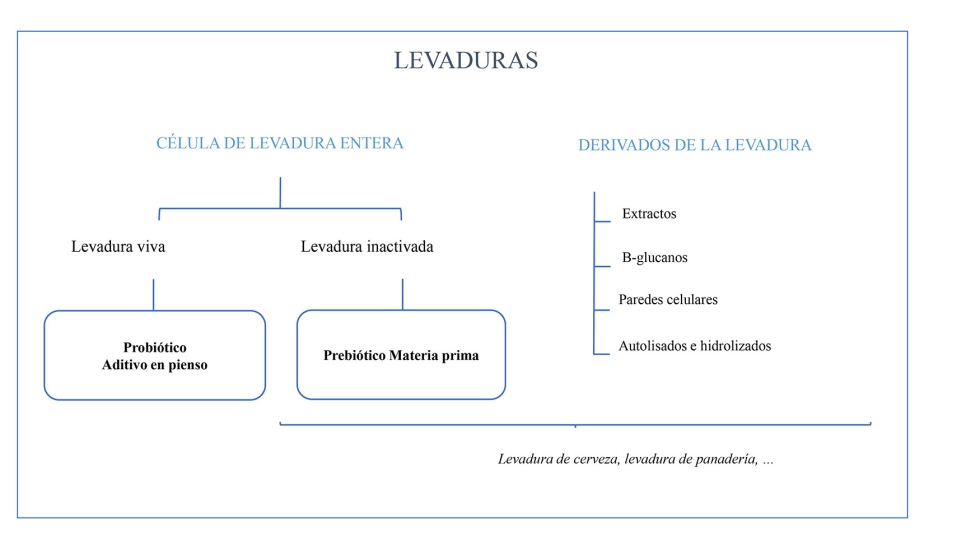
Desde hace tiempo, la levadura Saccharomyces cerevisiae (SCY) ha sido empleada como parte de la dieta de animales de abasto (Eckles et al., 1924). El interés en el uso de la levadura como alimento animal, ha respondido básicamente a la disponibilidad de levadura residual proveniente de otros procesos, fundamentalmente la producción de alcohol, pan, así como de la baja disponibilidad o alto precio de fuentes convencionales de alimento, sobre todo harinas proteicas.
Al estar registrada como un producto seguro – ‘Generally Recognized as Safe’ (GRAS) para uso en nutrición animal, la levadura Saccharomyces cerevisiae y sus diversas cepas son las que más se han utilizado en producción y nutrición animal (Hooge, 2004; Krysiak et al., 2021).
En las últimas décadas, se han introducido una gran cantidad de productos a base de levadura en el mercado, estos incluyen:
- Levaduras inactivadas. Los aditivos que poseen células inactivas de levadura son una excelente fuente de proteínas. Sin embargo, no tienen actividad en el rumen, siendo una fuente de nutrientes para los microorganismos ruminales.
- Levaduras vivas. Los suplementos de levadura viva liberan enzimas esenciales (proteasas, peptidasas, invertasas, hidrolasas, maltasas, fosfatasas, galactosidasas, etc.), vitaminas y aminoácidos durante la digestión, y promueven un ambiente en el rumen más saludable, reduciendo los niveles de oxígeno y estimulando el crecimiento de bacterias que degradan las fibras y consumen ácido láctico.
Otro tipo de productos derivados de las células de levaduras de S. cerevisiae son los conocidos como extractos o autolisados de levadura y las paredes celulares de levaduras, productos obtenidos a partir de la autolisis de la célula completa de levadura (Stone and Petes, 2006). El uso de fracciones de paredes celulares de levaduras como fuente de polisacáridos en la dieta, principalmente de tipo beta-glucanos y mannano-oligosacaridos (MOS), desempeñan un papel importante en la activación de los sistemas inmunitarios innato y adaptativo (Dalmo and Bøgwald, 2008).
El mecanismo de inmunomodulación de los β-glucanos depende en gran medida de su pureza y estructura molecular, que es reconocida y puede unirse a receptores tipo Toll like (TLRs). Los β-1,3/1,6 Glucanos, activan primeramente los fagocitos (macrófagos, monocitos, granulocitos) y las células de defensa del organismo, que representan la primera línea de defensa del sistema inmunológico. Cuando los fagocitos son activados, aumentan su capacidad para deglutir, matar y digerir cualquier microorganismo invasor. Al mismo tiempo, secretan anticuerpos, moléculas de citoquinas que actúan como señales, estimulando la producción de nuevas células blancas en la sangre, y simultáneamente hacen más activa la producción de anticuerpos. En otras palabras, una vez que los macrófagos, monocitos, granulocitos y células de defensa son activadas, estimulan la activación del sistema inmunológico por completo, dando una óptima resistencia del organismo a posibles ataques del medio externo. Los beta-glucanos mejoran la función del sistema inmunitario sin llegar a ser demasiado activo (Chihara, 1992).
Son muchos los estudios que indican la actividad inmunoestimulante de S. cerevisiae, sin embargo, aún existen muchos interrogantes (Dalmo and Bøgwald, 2008). No todas las cepas de levadura tienen el mismo modo de acción en los diversos sistemas de producción animal, esto reafirma la importancia de la selección de cepas adecuadas para su utilización como aditivo en dietas destinadas a rumiantes. Las diferencias en la respuesta con cepas de S. cerevisiae y la interacción que se produce con la dieta que se ofrece a los animales, presentan nuevas oportunidades, así como nuevos problemas (Lee et al., 2000)
Además, las discrepancias y desacuerdos en la bibliografía sobre la eficacia de determinados preparados inmunoestimulantes, pueden deberse al estado inmunológico general de los animales, al sistema de explotación, los patógenos específicos de las explotaciones, factores medioambientales, especies, dosis, periodo de suplementación y duración del efecto. A diferencia de muchos quimioterápicos, los inmunoestimulantes no muestran una relación lineal dosis/respuesta (Sung et al., 1994).
Material y métodos
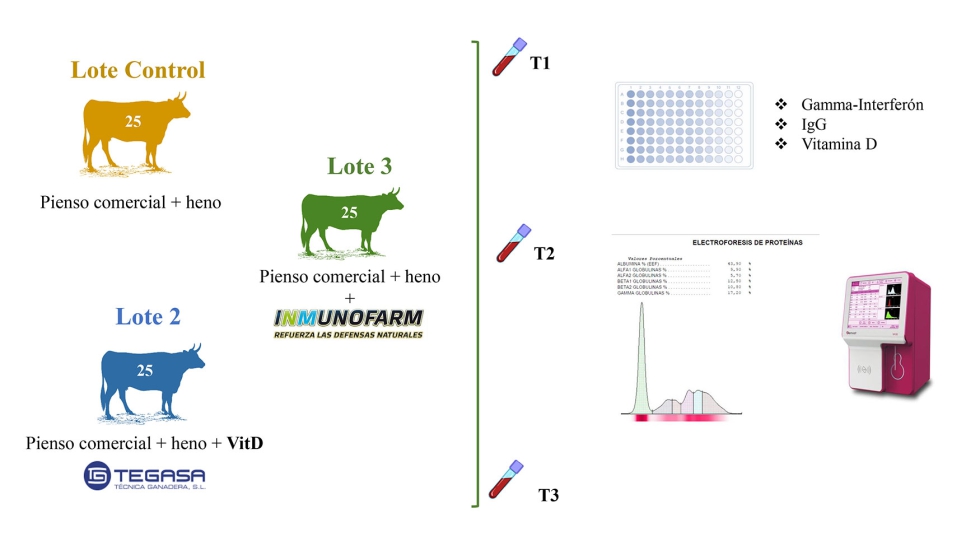
Nuestro equipo llevó a cabo un estudio longitudinal, de un año de duración, para determinar el posible efecto inmunoestimulante de un producto comercial a base de levadura de cerveza inactiva, y un aditivo vitamínico formulado principalmente a base de vitamina D y calcio.
Se establecieron al azar tres lotes experimentales homogéneos, cada uno de ellos con 25 vacas de raza retinta adultas, con diferentes edades y condiciones fisiológicas, mantenidas en un régimen de explotación extensivo basado en el aprovechamiento del pasto, suplementándose en épocas de carestía. El lote 1 o control se suplementó con pienso comercial y heno. El lote 2, además del pienso y heno, se le añadió un aporte de 150 g/animal/día un complemento vitamínico-mineral (vitamina D, calcio) (Tegasa). Finalmente, el lote 3, además del pienso y heno tradicional recibió un complemento alimenticio comercial (carbonato cálcico, lithotame, levadura de cerveza inactivada, aislado proteico de guisante, oxido de magnesio) (Inmunofarm) a razón de 7 kg/t pienso. Se tomaron muestras de sangre en 6-7 vacas de cada uno de los lotes antes de iniciar la suplementación, durante y al final, realizándose análisis hematológicos a través del equipo de hematología de veterinaria por impedancia eléctrica de 3 partes, y la determinación de los niveles séricos de inmunoglobulina G (IgG) (Cusabio), Gamma-Interferón (ϒ-INF) (BIO RAD) y vitamina D (DLG Diagnostika GMBH) a través de métodos inmuno-enzimáticos comerciales, además de las correspondientes analíticas hematológicas y proteinogramas.
Resultados
Los leucocitos tienen un papel vital en el sistema inmunitario, son responsables de proteger el cuerpo contra infecciones, enfermedades y sustancias extrañas. Los resultados obtenidos en este estudio coinciden con los obtenidos por Delgado-Fernández (2015), en cuyo estudio, determinaron en terneros de raza Siboney de Cuba, en pastoreo y suplementado con Saccharomyces cerevisiae, un incremento en el conteo global de leucocitos.
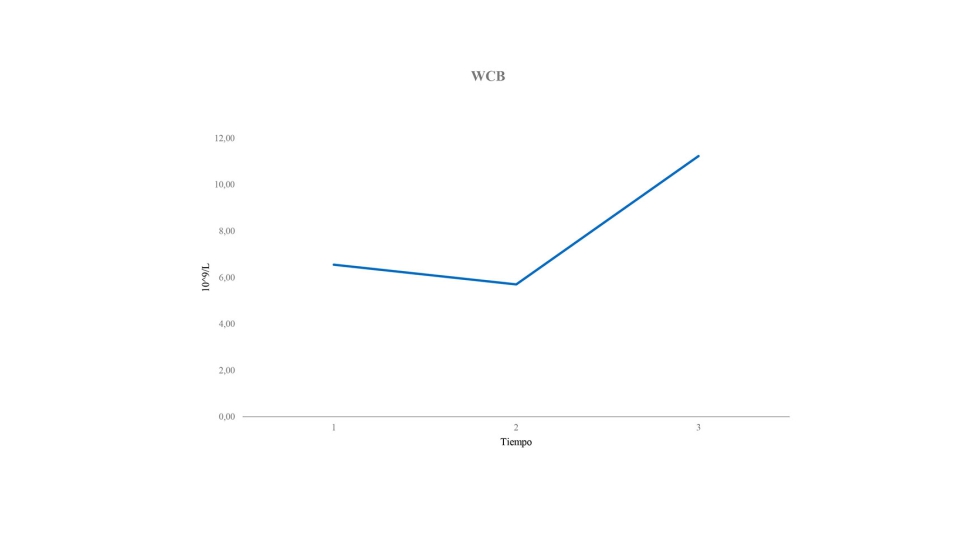
El número de leucocitos totales y la fórmula leucocitaria o determinación de los diferentes tipos de células blancas son procedimientos sencillos que permiten obtener una útil información de la función de la médula ósea. En general, un número elevado indica la presencia de una respuesta inmunológica por infección o por inflamación.
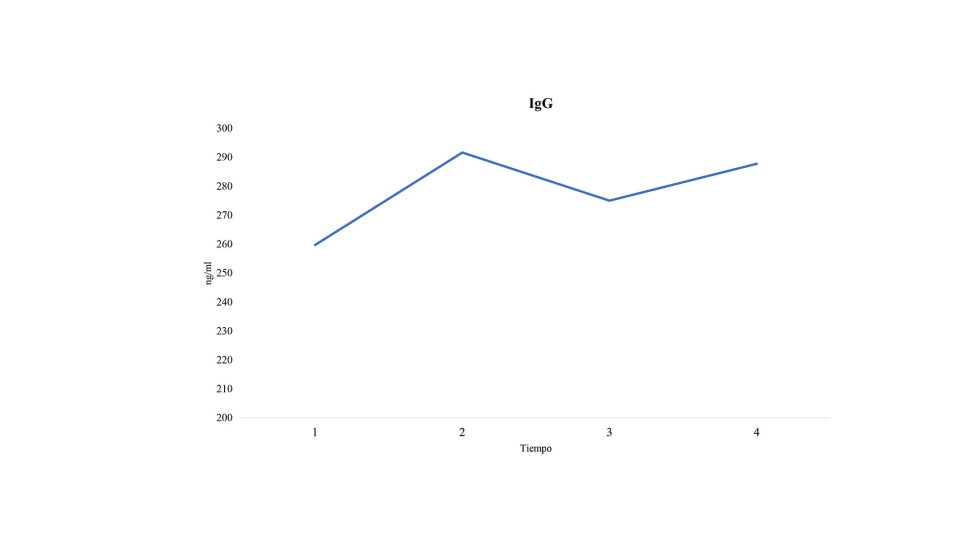
Los resultados obtenidos para los niveles de IgG determinados por ELISA mostraron diferencias significativas (p=0,018) en el lote 3, diferencia que no pudo establecerse a nivel de proteinograma, dado que este último es un método de análisis semicuantitativo. Estos resultados coinciden con Ma (2014), en cuyo trabajo se obtuvo una mejora del sistema inmunitario adaptativo en terneros Holstein suplementados con beta-glucanos de levaduras. No se obtuvieron diferencias significativas en los niveles de ϒ-INF.
Por su parte, todos los lotes mostraron diferencias significativas para la vitamina D a lo largo del tiempo (p<0,05), coincidiendo el mayor incremento con el periodo estival, por lo que se asume que el incremento se debe más a un efecto ambiental que a la propia suplementación de vitamina D.
La adición de S. cerevisiae al ganado vacuno de carne y leche, no sólo puede mejorar la función inmunitaria, sino también mejorar el rendimiento, reducir la emisión de nitrógeno y mejorar la calidad de la leche. Gao et al., (2017) demostraron que la adición de un 0,50% de S. cerevisiae en la dieta del ganado vacuno cruzado Simmental, puede aumentar la ganancia diaria en un 9,68%, disminuir la relación alimento/ganancia en un 1,79% y aumentar el beneficio económico en un 9,09% (Gao et al., 2017).
Conclusiones
El empleo de Inmunofarm en vacuno retinto extensivo parece incrementar significativamente tanto la inmunidad innata (número de leucocitos) como la inmunidad adquirida (niveles de IgG).
Como consecuencia de esta mejora en la inmunidad, el ganado retinto extensivo suplementado con Inmunofarm, presentaría mayor resistencia frente a posibles infecciones víricas o bacterianas.
Aunque existe variabilidad en los resultados obtenidos al utilizar levadura S. cerevisiae como parte de la dieta de rumiantes, de manera general, estos son positivos (Suarez-Machín and Guevara-Rodríguez, 2017).
Agradecimientos
Los autores agradecen a la Junta de Extremadura y al Fondo Europeo de Desarrollo Regional por el apoyo económico a través del proyecto Coplagan programa operativo Feder-Extremadura 2014-2020.
Bibliografía
- Anderson, D.P. 1992. “Immunostimulants, Adjuvants and Vaccine Carriers in Fish: Applications to Aquaculture.” nnual Review of Fish Diseases, 2: 281–307.
- Apines-Amar, M.J.S. y Amar, E.C. 2015. “Use of Immunostimulants in Shrimp Culture: An Update.” Biotechnological Advances in Shrimp Health Management in the Philippines: 45–71.
- Blecha, F. 2000. “Immune System Response to Stress.” The Biology of Animal Stress: 111–21.
- Bowden, R.A. 2003. “Inmunomodulación e Inmunomoduladores.” In Quinto Simposio Internacional de Reproducción Animal, 177–88.
- Chihara, G. 1992. “Recent Progress in Immunopharmacology and Therapeutic Effects of Polysaccharides.” Developments in biological standardization 77: 191–97.
- Dalmo, Roy A, and Jarl Bøgwald. 2008. “Beta-Glucans as Conductors of Immune Symphonies.” Fish & shellfish immunology 25(4): 384–96.
- Delgado Fernández, Rándolph, Guillermo Barreto Argilagos, and Roberto Vázquez Montes de Oca. 2015. “Empleo de Saccharomyces cerevisiae para la prevencion y control de las diarreas en terneros en pastoreo.” Revista de Producción Animal 27: NA. https://link.gale.com/apps/doc/A466297607/AONE?u=anon~6a9bc7ea&sid=googleScholar&xid=2e7803fa.
- Eckles, C H et al. 1924. “Yeast as a Supplementary Feed for Calves.” Journal of Dairy Science 7(5): 421–39. https://www.sciencedirect.com/science/article/pii/S0022030224940409.
- Gao, H.L.; Hou, P.X.; Mei, N.A.; Liang, X.J. 2017. “Effects of Dietary Supplementation of Yeast Culture on Productive Performance and Economic Benefits of Beef Cattle.” Anim. Husb. Feed Sci. 38: 45–50.
- Hooge, Danny M. 2004. “Meta-Analysis of Broiler Chicken Pen Trials Evaluating Dietary Mannan Oligosaccharide, 1993-2003.” International Journal of Poultry Science 3: 163–74.
- Krysiak, Katarzyna, Damian Konkol, and Mariusz Korczynski. 2021. “Overview of the Use of Probiotics in Poultry Production.” Animals : an open access journal from MDPI 11(6).
- Lee, S S, J K Ha, and K.-J Cheng. 2000. “Influence of an Anaerobic Fungal Culture Administration on in vivo Ruminal Fermentation and Nutrient Digestion.” Animal Feed Science and Technology 88(3): 201–17. https://www.sciencedirect.com/science/article/pii/S0377840100002169.
- Ma, X.J. 2014. “Effects of Saccharomyces cerevisiae Cultures on Rumen Physiological Functions in Ruminants.” Contemp. Anim. Husb. 24: 23–25.
- Suarez-Machín, and Guevara-Rodríguez. 2017. “Levadura Saccharomyces cerevisiae En La Alimentación de Rumiantes. Revisión Bibliográfica.” ICIDCA. Sobre los Derivados de la Caña de Azúcar 51: 21–30. https://www.redalyc.org/articulo.oa?id=223154251004.
- Stone, Jana E, and Thomas D Petes. 2006. “Analysis of the Proteins Involved in the in Vivo Repair of Base-Base Mismatches and Four-Base Loops Formed during Meiotic Recombination in the Yeast Saccharomyces cerevisiae.” Genetics 173(3): 1223–39.
- Sung, H H, G H Kou, and Y L Song. 1994. “Vibriosis Resistance Induced by Glucan Treatment in Tiger Shrimp (Penaeus Monodon).” Fish Pathology 29(1): 11–17.











