Bioimpresión celular 3D, ¿ciencia ficción o realidad?
Lidia Tomás, responsable del Departamento de Bioensayos de Ainia
02/07/2021La biotinta es el material fruido que se carga en los inyectores de la bioimpresora y que permite mimetizar la arquitectura del tejido celular de interés. Los principales componentes son:
- Las células vivas representativas del tejido a imprimir, bien de un tipo celular o varios.
- Los biomateriales para la generación de la estructuras o andamiajes (los denominados scaffolds), como el colágeno, la gelatina o los hidrogeles a base de ácido hialurónico o polietilenglicol, componentes para el mantenimiento célula.
- Otros compuestos o moléculas que permita la solidificación o con capacidad de reticular (crosslinkers).
Dado que es complicado que un único material reúna todas las propiedades para la obtención de la características necesarias (propiedades reológicas y mecánicas, capacidad de impresión, biocompatibilidad celular), una de las tendencias es hacer uso de biotintas multicomponentes, de modo los materiales suelen ser combinaciones de varios materiales para lograr las propiedades mecánicas deseadas así como facilitar la capacidad de impresión.
Las 4 grandes etapas de la bioimpresión
La creación de las estructuras celulares 3D mediante bioimpresión puede dividirse en 4 grandes etapas:
- Diseño de la estructura (selección de las células, los materiales para la generación de la biotinta)
- Proceso de bioimpresión
- Post-bioimpresión cultivo de la estructura celular (funcionalizarlo, y/o crecimiento soporte placa, biorreactor…)
- Evaluación de la estructura (comprobar la viabilidad, estructura, y funcionalidad
3 tipos de tecnologías para la bioimpresión
El proceso de bioimpresión celular per se, es decir, la forma que se crean las estructuras por el depósito de la biotinta en el soporte, se puede clasificar en 3 tipos de tecnologías en las que se basan las diferentes bioimpresoras disponibles en el mercado:
- Bioimpresión basada en extrusión, de modo que la biotinta se extruye por los inyectores formando un filamento continuo;
- Bioimpresión de inyección en gotas, en la que la biotinta se coloca mediante un goteo discreto que se van apilando para crear la estructura. A su vez existen distintas formas de crear la gota (por procesos térmicos, piezoeléctricos y asistida por láser)
- Bioimpresión mediante fotopolimerización, se basa en la sensibilidad a la luz de algunos polímeros para la solidificación de éstos a través de la luz
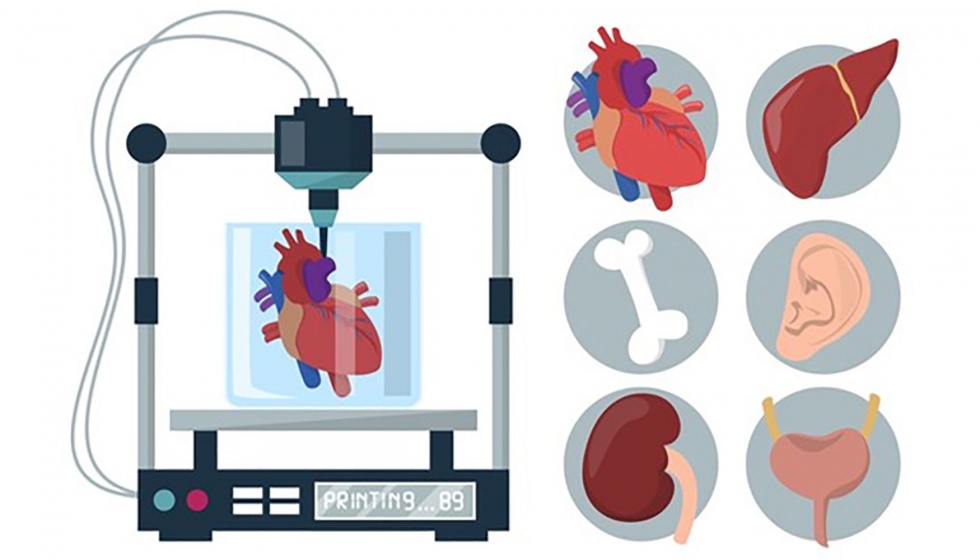
La bioimpresión celular inicialmente se pensó como una alternativa a la demanda continúa de transplantes. Se demostró por primera vez por el Dr. Klebe en los años 80 mediante la microadición de células a capas e utilización de una impresora convencional Hewlett-Packard (HP). No obstante, el avance de la tecnología facilitando e incrementando la vialidad celular tras su paso por los inyectores, entre otros factores, ha permitido que desde el año 2000 se haya intensificado las investigaciones sobre su aplicabilidad. Gracias a la capacidad de lograr la manipulación espacio-temporal de varias células la bioimpresión se ha convertido en uno de los sistemas que mejor recrea el microambiente celular de los tejidos y con ello el comportamiento celular a escala de laboratorio. La bioimpresión 3D de órganos es compleja y aún deben evolucionar la tecnología.
Aplicación de la bioimpresión 3D en el sector farmacéutico, dermocosmético y alimentario
La aplicación de la bioimpresión 3D se ha extendido a distintos ámbitos más allá de la medicina regenerativa para la reconstrucción de tejidos (por ejemplo, córneas, huesos o cartílagos) tales como:
- El sector farmacéutico para estudiar el mecanismo de acción de determinadas patologías e identificar nuevos fármacos por ejemplo los antitumurales
- El sector dermocosmético para crear piel y estudiar el efecto de determinados compuestos o fórmulas.
- Otro sector con potencial aplicación es el sector alimentario, bien para el desarrollo de ingredientes y productos con efecto funcional ya que esta tecnología permite crear modelos in vitro más precisos de aquellas funciones fisiológicas de interés, así como para la fabricación de carne in vitro, una de las alternativas tecnológicas más relevantes para el abastecimiento sostenible de proteínas. La bioimpresión 3D permite crear los andamiajes sobre los que se deposita las células de tejido muscular para su posterior cultivo en biorreactor.
Uno de los principales retos de futuro de la bioimpresión 3D es la creación de órganos para trasplantes, aunque fue su objetivo inicial la reproducción una estructura celular tan compleja es una tarea ardua. Aun así, se va haciendo logros. En este sentido, hay que mencionar que ya se habla de la bioimpresión 4D en la que las células utilizadas para la creación de los tejidos son células de donantes. De ahí que se augura que esta tecnología va a ser clave para la biomedicina personalizada.
En base a lo mencionado anteriormente consideramos a la bioimpresión celular una tecnología de ingería tisular revolucionaría que están permitiendo que lo in vitro esté más próximo a lo in vivo.
TECNOMIFOOD: Desarrollo de modelos celulares mediante bioimpresión 3D
Ainia, en el marco del proyecto TECNOMIFOOD, está trabajando en el desarrollo de modelos celulares mediante bioimpresión 3D. Además la utilización del sistema integrado propio formado por el Digestor Dinámico de fermentación colónica de Ainia y los modelos celulares 3D permite la recreación de todo el proceso de ingesta de productos: digestión gastrointestinal, bioaccesibilidad y biodisponibilidad de los compuestos, mimetizar la interacción con la microbiota intestinal así como el efecto biológico sobre el tejido diana, que combinado junto con tecnologías ómicas para la monitorización de la respuestas biológicas (proteómica, metagenómica y transcriptómica dirigida) constituye una herramienta versátil, robusta y precisa como modelo preclínico in vitro para identificar, seleccionar y evaluar ingredientes bioactivos y productos funcionales.
La Red TECNOMIFOOD es una red formada por cinco centros tecnológicos (Ainia, Anfaco, Azti, CNTA, Leitat), que tiene como objetivo la integración de las tecnologías ómicas para facilitar el acceso empresarial a estas tecnologías y la optimización de su uso, en todas las etapas de la cadena de valor del diseño y la evaluación de ingredientes, nutracéuticos y alimentos funcionales.








