Una vacunación efectiva debe inducir una respuesta inmunitaria
Bases inmunológicas y su aplicación a la vacunación
El sistema inmunitario ha evolucionado para equiparse con una gran diversidad de mecanismos que permiten mantener el estado de equilibrio frente a diferentes amenazas, con especial dedicación a la invasión con microbios patógenos. Desde el reconocimiento y activación de la inmunidad innata hasta la producción de células citotóxicas o anticuerpos de alta afinidad y especificidad, el sistema inmunitario trata de aislar y reducir la presencia del invasor lo más rápido posible, adaptándose al tipo de patógeno.
La existencia de enfermedades infecciosas en humanos surge de la intensa relación con los animales desde la domesticación en el periodo neolítico. La domesticación es un hecho histórico clave que precede a la aparición de algunas de estas enfermedades que hoy conocemos como zoonóticas. Sin embargo, los patógenos necesitan un periodo de adaptación a las nuevas especies para superar las barreras específicas de especie, entre las que se encuentra la respuesta inmunitaria (Figura 1).
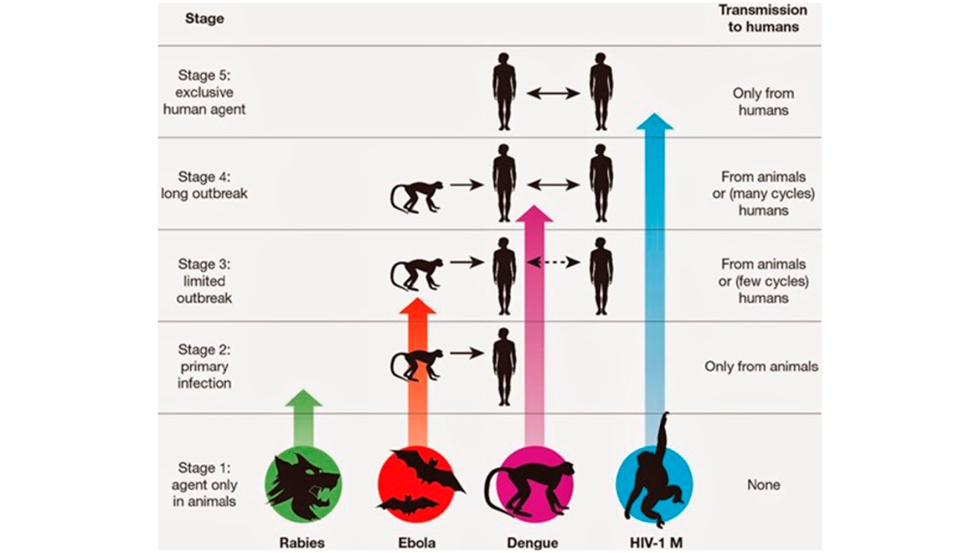
Figura 1. Podemos distinguir cinco etapas desde que un patógeno animal evoluciona hasta transformarse en un patógeno humano. En la primera etapa los microbios solo están presentes en animales y no se detectan en humanos en condiciones naturales. En la segunda etapa, el microbio puede transmitirse del animal al hombre y causar una infección primaria, que no se transmite entre personas. Una tercera etapa en la evolución de los patógenos implicaría patógenos con ciclos de transmisión entre personas, que causan algún brote muy esporádico y ocasional, pero que desaparecen muy pronto, aunque el virus está escondido en su hospedador reservorio natural animal. Algunos microbios han evolucionado más y se han adaptado mejor al ser humano pudiendo causar epidemias mucho más importantes. Por último, algunos patógenos cuyo origen es también animal, han evolucionado y se han especializado para infectar exclusivamente humanos.
En la lucha frente a los microorganismos invasores, los mamíferos cuentan con herramientas que, en coordinación, forman lo que conocemos como sistema inmunitario. Este sistema formado por diversas estructuras, células y mecanismos moleculares tiene como principal función mantener un estado de equilibrio en el organismo, lo que conocemos como homeostasia o integridad.
La capacidad de modificar y potenciar la actividad de este sistema data de tiempos inmemoriales en los que las epidemias de viruela o peste devastaban poblaciones humanas. Sin embargo, algunos individuos se recuperaban y otros no volvían a enfermar. Se tiene constancia de esta observación en la China del siglo XII, cuando se inoculaba deliberadamente a niños con pústulas de viruela procedentes de individuos enfermos, proceso que conocemos como “variolización”, protegiendo a los supervivientes. Posteriormente, esta práctica se convirtió en vacunación cuando Edward Jenner observó que los animales inoculados con material contaminado procedente de vacas con peste bovina sufrían una enfermedad más leve y permanecían protegidos, frente a exposiciones posteriores.
Las estrategias de defensa que se han desarrollado en el marco de las infecciones contagiosas es muy variada y abarca desde la presencia de meras barreras físicas, a mecanismos moleculares minuciosamente regulados, en respuesta a la también gran variedad de patógenos que las causan. En general podemos afirmar que al menos existen dos líneas de defensa frente a la invasión microbiana: la inmunidad innata que comprende tanto las barreras físicas, celulares y biológicas que actúan de manera temprana y con un grado de especialización bajo; y la inmunidad adquirida que incluye la respuesta humoral y celular de gran especificidad.
Inmunidad Innata
La inmunidad innata supone la primera línea de defensa y se basa en la existencia de barreas físicas, químicas y moleculares presentes en todas las células del organismo. Los patrones moleculares asociados a los diferentes grupos patógenos y que conocemos como PAMPs (pathogen-associated molecular patterns), dentro de los que podemos encontrar macroestructuras como el lipopolisacárido bacteriano, la manosilación de proteínas virales, diferentes tipos de material genético o metabolitos poco comunes en los mamíferos, son reconocidos por los receptores de reconocimiento de patógenos (PRRs). Estos PRRs incluyen detectores de diferentes macromoléculas asociadas a patógenos relacionadas con su presencia, invasión o replicación. El reconocimiento de los PAMPs deriva en una activación inmunitaria rápida.
La conexión entre la respuesta innata y la adaptativa ocurre cuando células presentadoras de antígeno (CPAs) con capacidad fagocítica, reconocen a través de sus PRRs, los mencionados PAMPs. Esta interacción determina una activación subsiguiente en las propias CPAs que, tras procesar los antígenos de los patógenos, los presentan a los linfocitos en un ambiente adecuado. Así, el tipo de activación debido a la respuesta innata determina el tipo de respuesta adaptativa, un aspecto que debe considerarse en el diseño de vacunas (
figura 2).
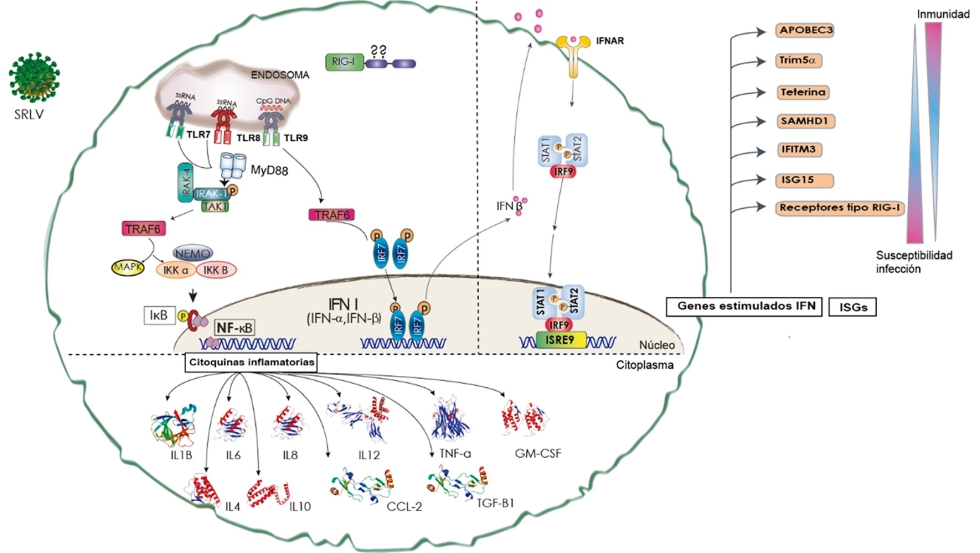
Figura 2. Reconocimiento de patógenos y señalización intracelular. Cuando un patógeno (virus en este caso) entra en contacto con una célula, los receptores de la inmunidad innata de tipo TLR reconocen algunos componentes de los patógenos (RNA o DNA), activando rutas de señalización que conllevan la producción de factores de transcripción (NF-κB e IRF7) que, a su vez, inducen la expresión de multitud de citoquinas inflamatorias y de interferón de tipo I (α y β), respectivamente. El IFN-β ejerce su acción de manera autocrina o paracrina dependiendo de la sensibilidad celular (presencia del receptor IFNAR), que se traduce en la expresión de una gran cantidad de proteínas antivirales como APOBEC3 o teterina.
Presentación antigénica
Las células presentadoras de antígeno reconocen, procesan y presentan las proteínas de los patógenos a las diferentes subpoblaciones de linfocitos T (CD4 o CD8) que, tras la activación correspondiente, madurarán, proliferarán y ejercerán sus acciones efectoras, además de generar memoria inmunológica (Figura 3).
El contexto de la presentación antigénica, es decir, el modo en el que las CPAs se comunican con los linfocitos T depende fundamentalmente de cómo se adquiere el antígeno y determina, en gran medida, el tipo de respuesta adaptativa. En general, el procesamiento de antígenos adquiridos a través de procesos de fagocitosis, se realiza a través de la digestión enzimática en el interior de los fagosomas, generando péptidos que, tras su modificación en el aparato de Golgi, se combinan con moléculas del complejo mayor de histocompatibilidad de tipo II (MHC-II). En este contexto, las CPAs presentarán los complejos antígeno-MHC-II a los linfocitos Thelper (Th), que proliferan y secretan citoquinas que contribuyen de manera esencial en la fase efectora de la respuesta, mediante procesos de comunicación celular y señalización.
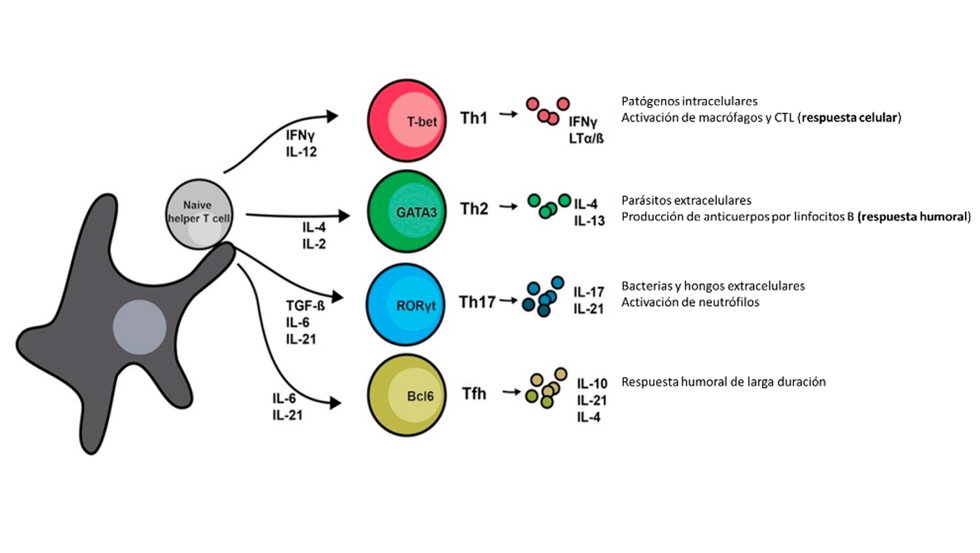
Figura 3. Las células presentadoras de antígeno son capaces de comunicarse con un amplio abanico de células T para dar lugar, dependiendo del microambiente de citoquinas, a diferentes subpoblaciones y funciones. Los linfocitos Th1 secretan citoquinas que favorecen respuestas celulares, basadas en la actividad citotóxica de algunos linfocitos, frente a patógenos intracelulares. Los Th2 promueven la producción de anticuerpos necesarios para afrontar infecciones con patógenos extracelulares. Los Th17 lo hacen a través de neutrófilos en epitelios y los Tfh (células T auxiliares foliculares) que están relacionadas con la memoria de los linfocitos B.
La presencia de estas citoquinas da lugar, de manera específica, a las diferentes subpoblaciones de Th, que expresan la molécula CD4 en su superficie. La denominada Th2 es la encargada de estimular linfocitos B para su maduración en células plasmáticas, que son las encargadas de la producción de anticuerpos (Figura 4). Este tipo de respuesta está dirigida frente a patógenos extracelulares susceptibles de sufrir procesos mediados por los anticuerpos como neutralización, opsonización, aglutinación, activación del complemento, etc., y es la que conocemos como respuesta humoral.
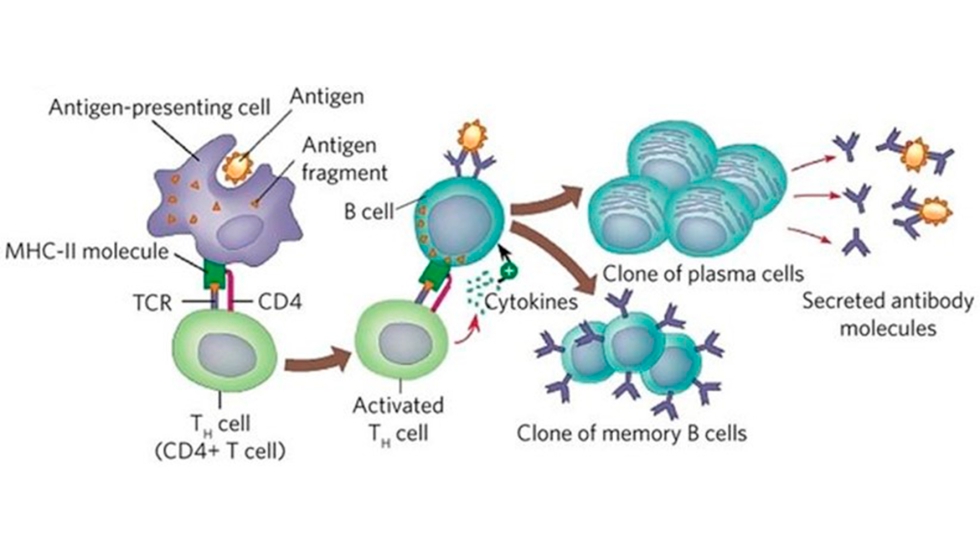
Figura 4. El origen y procesamiento del antígeno es determinante a la hora de inducir respuestas de tipo celular y humoral. La incorporación exógena de antígenos, a través de la fagocitosis, asegura una presentación en el contexto de MHC-II a los linfocitos Th2, que, a través de la producción de citoquinas, promueven la diferenciación de los linfocitos B en células plasmáticas, productoras de anticuerpos.
Por otro lado, la población Th1 es la encargada de estimular linfocitos T citotóxicos (CTL), a través de la producción de citoquinas, originando lo que conocemos como respuesta celular (figura 5). Además, los antígenos endógenos, aquéllos que se producen en el interior de la célula, sin la mediación de procesos de adquisición de material externo son digeridos en un complejo proteico intracelular denominado proteasoma y combinados con moléculas de MHC de clase I. El ejemplo básico de esta vía es la infección viral o la vacunación con material genético. En este caso, la presentación antigénica se realiza directamente a linfocitos T citotóxicos, que expresan CD8 en la superficie y que son responsables de eliminar células infectadas por el patógeno.
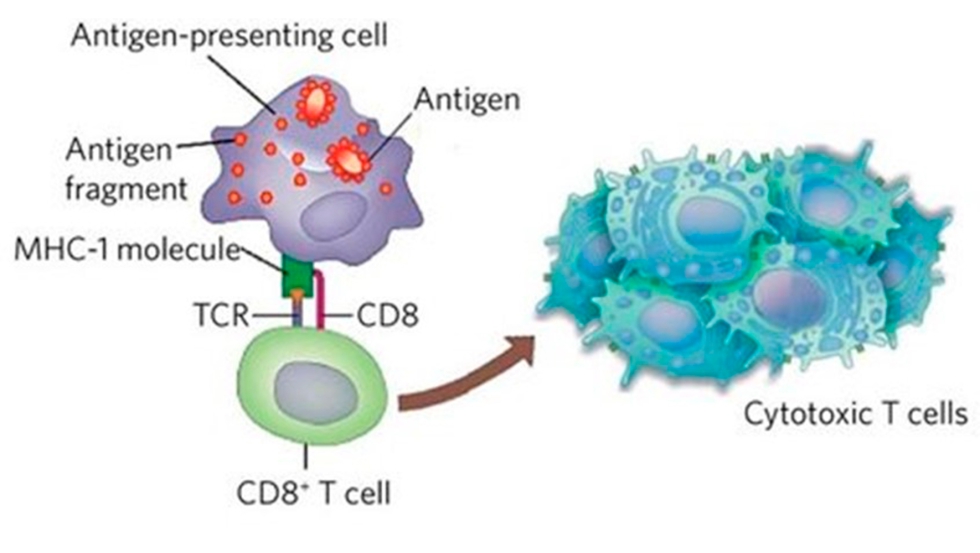
Figura 5. La producción endógena de antígeno promueve su combinación con moléculas de MHC-I y su presentación a linfocitos T CD8 o citotóxicos, cuyo papel principal es el reconocimiento y eliminación de células infectadas.
Tipos de vacunas
Una vacunación efectiva debe inducir una respuesta inmunitaria al menos similar a la resultante de la infección natural, evitando el desarrollo de efectos adversos y asegurando que los riesgos de la inmunización son netamente menores a los de contraer la enfermedad. La vacunación ha contribuido y contribuye de manera incuestionable al desarrollo del ser humano previniendo el desarrollo de enfermedades fatales, tanto en el propio ser humano, como en los animales domésticos.
Los conceptos de inmunización y vacunación no son completamente sinónimos, ya que la inmunización puede ser activa (mediante vacunación) y pasiva (anticuerpos calostrales). A través del conocimiento exhaustivo de los mecanismos de defensa del organismo, tanto innatos como adaptativos, y utilizando las herramientas biotecnológicas más avanzadas, las vacunas han pasado de la simple inoculación de agentes atenuados o inactivados, a la construcción de vectores virales recombinantes, por ejemplo. Estos avances se han puesto de relevancia recientemente en las nuevas vacunas frente al SARS-CoV2, destacando entre los desafíos a los que nos enfrentamos en el contexto de la salud global.
La eficacia de las estrategias de inmunización depende de múltiples factores incluyendo el tipo de patógeno, el acervo genético del individuo, la vía de administración, la presencia de adyuvantes, etc. Tradicionalmente la producción de anticuerpos se ha considerado un indicador principal de la inmunogenicidad vacunal, sin embargo, hoy en día conocemos que, al menos en el caso de patógenos intracelulares, se deben evaluar parámetros inmunológicos relacionados con la respuesta celular y/o aquellos que estimen el nivel de protección
Las vacunas vivas son las más antiguas, contienen el patógeno vivo que se ha atenuado de manera natural o artificial, por lo que la respuesta será similar a la infección natural, pero evitando la aparición de la enfermedad. La respuesta que generan es en general de alta intensidad y durabilidad, pero no están indicadas en individuos inmunodeprimidos ya que, aunque baja, los patógenos atenuados tienen capacidad de replicación y de causar infección en un ambiente inmunológico favorable.
Las vacunas proteicas inactivadas por calor o con agentes químicos representan una manera de evitar estos problemas de seguridad, inactivando totalmente el patógeno. De esta manera, no causan enfermedad en los individuos inoculados independientemente de su estado inmunológico. Sin embargo, son poco inmunogénicas y necesitan de adyuvantes y protocolos intensivos para ofrecer buenos resultados, ya que inducen respuestas menos intensas y de menor duración. Nuevas tecnologías como el ADN recombinante han permitido el diseño de vacunas en forma de subunidades, que no contienen el patógeno entero, si no que incluyen una o más proteínas, focalizando la respuesta inmunitaria en antígenos específicos.
El avance en técnicas de transfección y genética reversa ha permitido el desarrollo de vacunas basadas en partículas parecidas a los virus (VLPs) que consisten en macroestructuras proteicas autoensamblantes que simulan la forma de un virus, pero sin capacidad replicativa, ya que no contienen genoma. La respuesta inmunitaria es muy similar a la observada tras la infección natural ofreciendo perfiles de eficacia y seguridad óptimos. La biología sintética ha permitido la manipulación del material genético para su empleo como vacunas ADN/ARN, que proporcionan las instrucciones necesarias para la síntesis interna de las proteínas virales o bacterianas frente a las que se quiere dirigir la respuesta. Son una opción eficaz, barata y muy adaptable a diferentes patógenos, siendo una de las más prometedoras para su desarrollo en el futuro. Una manera de dirigir de manera eficiente esa información al interior de las células es mediante el empleo de vectores virales/bacterianos, aprovechando sus capacidades infectivas y de ocultación al sistema inmunitario. Como en el caso de las vacunas genéticas, esta es una tecnología nueva en la que también se basan algunas de las vacunas de la COVID-19 por primera vez, en medicina humana.
Interferencia con la inmunidad materna
Los diferentes tipos de placenta determinan estructuras y procesos inmunológicos de distinta índole. En animales con placentación endoteliocorial (la mayoría de los carnívoros) el paso de anticuerpos al feto se permite durante la gestación, al igual que en los de placentación hemocorial (la mayoría de primates, incluyendo los humanos). Sin embargo, en los de placentación epiteliocorial (porcinos y algunos rumiantes) la circulación fetal se mantiene separada de la materna por lo que obtienen la inmunidad, a través de la ingestión de calostro, siendo el factor más importante en las primeras horas de vida en la protección de las crías. Mediante la absorción intestinal de las inmunoglobulinas (anticuerpos), factores de crecimiento, citoquinas, células, etc., se asegura por un lado la tolerancia a la microbiota normal y los alimentos; y por otro la adquisición de protección frente a las infecciones que haya padecido la madre.
Sin embargo, la presencia de anticuerpos en el suero de los neonatos puede tener efectos en la capacidad de los lechones para generar respuesta frente a una eventual infección o inmunización. Clásicamente se ha considerado que los neonatos presentan un sistema inmunitario inmaduro, incapaz de generar una respuesta protectora. Sin embargo, los últimos hallazgos indican que tan solo la respuesta de anticuerpos estaría inhibida en animales encalostrados, cuando se emplean formulaciones clásicas (vacunas vivas e inactivadas).
Los anticuerpos maternales, del tipo IgG mayoritariamente, pueden interceptar los antígenos proteicos presentes en el inóculo vacunal, neutralizándolo por completo. Por ello, las vacunas genéticas o las aplicadas en zonas donde la concentración de IgGs maternas es baja, por ejemplo, las mucosas, podemos conseguir superar la barrera inmunitaria que suponen los anticuerpos maternos. Otros estudios indican que la respuesta debida a los linfocitos T (CD4 y CD8) es activa y efectiva, incluso en animales recién nacidos, confirmando que tan solo la síntesis de anticuerpos se encuentra inhibida.
Por todo ello, la visión actual de la vacunación de neonatos debe ser reconsiderada teniendo en cuenta la respuesta inmunitaria en su conjunto (humoral y celular), nuevas formulaciones vacunales y vías de administración que eviten su interacción con IgGs maternas.























