Nanopartículas magnéticas metálicas para liberar fármacos de forma dirigida y para tratar tumores
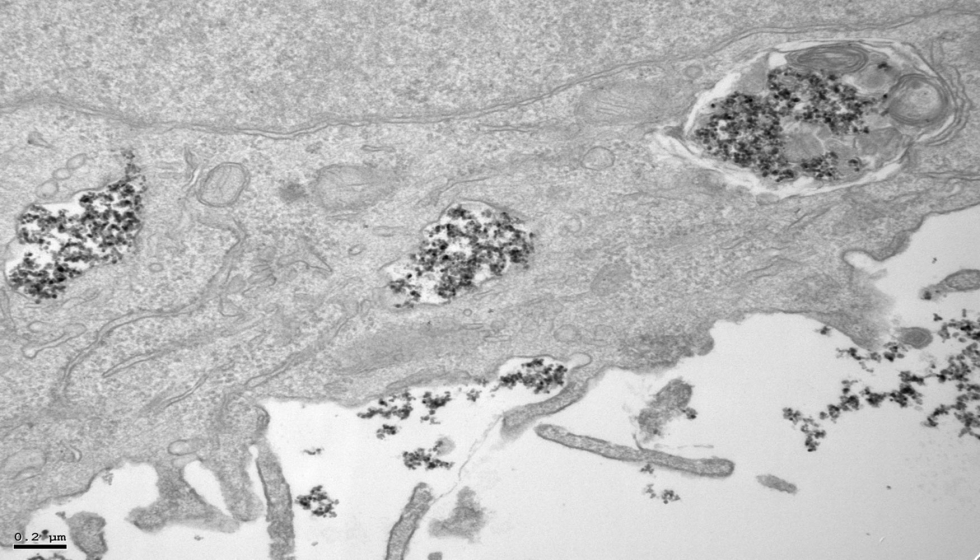
Las nanopartículas metálicas magnéticas se han aplicado en terapia y diagnóstico con resultados prometedores. Estas nanopartículas de óxido de hierro son útiles para introducirlas en las células y desempeñar diversas funciones, como liberar fármacos de forma localizada, eliminar células tumorales mediante la emisión de calor (hipertermia) o para realizar diagnósticos en resonancias magnéticas. Pero para conseguir su aprobación clínica es necesario conocer cómo se comportan en el interior de las células, qué rutas intracelulares activan, y cómo se degradan, para determinar sus efectos terapéuticos y su posible toxicidad.
Ahora, un estudio liderado por investigadores del CSIC y publicado en la revista Biomaterials ha mostrado que la cobertura de estas nanopartículas es clave para conocer cómo se mueven y cómo se degradan en el interior de las células. Para usarlas en aplicaciones médicas, suelen recubrirse de diferentes tipos de moléculas y polímeros (macromoléculas) para hacerlas más biocompatibles, estables, biodegradables y para evitar que formen agregados que podrían generar trombos. Este trabajo muestra que esta cobertura es decisiva para mejorar la eficacia de las nanopartículas.
El investigador Domingo F. Barber, del Centro Nacional de Biotecnología (CNB-CSIC), que ha liderado el estudio, señala: “Según el tipo de recubrimiento utilizado, cuando las nanopartículas entran en contacto con el entorno biológico se producen diferentes interacciones con las proteínas del medio, afectando su tamaño final, la vía de captación celular, así como el tránsito que siguen hasta su degradación en la maquinaria celular que se encarga de este proceso (los endolisosomas: un cuerpo del citoplasma celular fundamental para eliminar patógenos o microorganismos)”.
Yadileiny Portilla, investigadora en el CNB-CSIC y primera autora del trabajo junto con Vladimir Mulens y en el que también trabaja la investigadora Puerto Morales, del Instituto de Ciencia de Materiales de Madrid (ICMM-CSIC), destaca: “El tipo de recubrimiento y el aumento de tamaño de la nanopartícula por su asociación con proteínas del medio biológico son esenciales para dictar las rutas de entrada celular y el tránsito intravesicular, así como en la velocidad de degradación celular”.
“En las células tumorales -añade Portilla-, las nanopartículas se acumulan en endolisosomas, donde se degradan más lentamente, mientras que en las células macrofágicas del entorno tumoral, la degradación ocurre más o menos rápidamente dependiendo del recubrimiento, ya que en función de este se acumulan en vesículas con diferente capacidad de degradación. Estos hallazgos son de vital importancia a la hora de diseñar las nanopartículas ya que podremos, en función de su futura aplicación, potenciar el efecto deseado dependiendo de la diana terapeútica”.
El uso de las nanopartículas de óxido de hierro está ampliamente extendido en varios campos de la biomedicina, ya que podrían facilitar la liberación dirigida de fármacos y biomoléculas, su capacidad para producir calor se utiliza en el tratamiento de cáncer por hipertermia intracelular y además son capaces de generar contraste en diagnóstico en imágenes de resonancia magnética.












































