Este hallazgo supone un importante avance en el conocimiento de nuevas aptitudes de estos hongos y su función como promotores de crecimiento de las plantas
Contribución directa e indirecta del hongo entomopatógeno Metarhizium brunneum (Pecth) en la solubilización y adquisición del hierro en plantas de melón y pepino
Fabián García-Espinoza 1,2,†, María José García del Rosal 1, Enrique Quesada-Moraga1 y Meelad Yousef-Yousef 1,*,†
1 Departamento de Agronomía. Unidad de Excelencia María de Maeztu-DAUCO. ETSIAM, Campus de Rabanales, Universidad de Córdoba, Edif. C4, 14071 Córdoba, España.
2 Departamento de Parasitología, Universidad Autónoma Agraria Antonio Narro–Unidad Laguna, Periférico Raúl López Sánchez S/N, Torreón 27054, Coahuila, Mexico.
† Estos autores contribuyeron equitativamente a este trabajo.
*Correspondencia: z12yonam@uco.es; Tel.: +34-957-218-527
08/06/2023Los hongos entomopatógenos (HE) tienen un estilo de vida multifuncional; además de su función bien conocida como agentes de biocontrol, también pueden ayudar a las plantas a responder a otros estreses bióticos y abióticos, como la deficiencia de hierro (Fe). Este estudio explora la capacidad de la cepa EAMa 01/58-Su del HE Metarhizium brunneum para inducir respuestas de adquisición de Fe in vitro e in vivo. La cepa EAMa 01/58-Su mostró una gran capacidad para exudar sideróforos de hierro (58.4% de exudación en medio CAS agar) y proporcionó un mayor contenido de Fe en ma-teria seca y en sustrato en comparación con el control. Se observó, una regulación positiva (24, 48 o 72 h post-inoculación) de la actividad de la reductasa férrica así como de la expresión de los genes de adquisición de Fe FRO1, FRO2, IRT1, HA1 y FIT, revelando así el potencial de la cepa EAMa 01/58-Su del HE M. brunneum para inducir los mecanismos implicados en la adquisición de Fe.

Introducción
Los hongos entomopatógenos (HE) se encuentran entre los agentes de control micro-biano de plagas más importantes que se han desarrollado comercialmente, aunque algunas especies de ascomicetos entomopatógenos, presentan estilos de vida multifuncionales y pueden interactuar con las plantas cultivadas como endófitos o como competentes en la rizosfera, interacciones mu-tualistas que benefician a la planta hospedante tales como la promoción de su crecimiento, e incluso mejor respuesta a otros estreses de tipo biótico y abiótico (Hu & Bidochka, 2019; Nosheen et al., 2021; Quesada-Moraga, 2020).
El hierro (Fe) es un micronutriente esencial para una serie de procesos enzimáticos importan-tes en la mayoría de los organismos y en la mayoría de los entornos y su deficiencia se considera una de las principales limitaciones de la productividad de los cultivos en todo el mundo (Romera et al., 2019). La deficiencia de Fe no se desencadena por bajas concentraciones totales de Fe, sino por una baja biodisponibilidad de este en el suelo (Kraemer, 2004). Para superar estas limitaciones, se sabe que algunas bacterias, hongos y gramíneas secuestran Fe utilizando sideróforos (Krasnoff et al., 2014).
En condiciones de deficiencia de Fe, las plantas desarrollan respuestas morfológicas y fisio-lógicas, principalmente en sus raíces, destinadas a facilitar su adquisición (García et al., 2015, 2021; Gattullo et al., 2018; Romera et al., 2019). En plantas de Estrategia I, las principales respuestas fisiológicas son: aumento de la actividad de la reductasa férrica, incremento del transporte de Fe2+, acidificación de la rizosfera y aumento de la síntesis y/o liberación de ácidos orgánicos, compuestos fenólicos, como cumarinas y flavinas, que pueden actuar como agentes quelantes y reductores de Fe, mejorando su solubilidad para las plantas (Rodríguez-Celma & Schmidt, 2013; Sisó-Terraza et al., 2016; Tsai & Schmidt, 2017). En la regulación de las respuestas de deficiencia de Fe se han implicado hormonas y sustancias reguladoras como el etileno (ET) y el óxido nítrico (NO), que actúan como reguladores positivos (García et al., 2010, 2011).
Nuestros trabajos recientes han demostrado el papel de varias especies de HE en la adquisición de nutrientes por parte de las plantas, con un mayor crecimiento y productividad de plantas de sorgo, trigo, girasol y tomate inoculadas con cepas de los HE Metarhizium brunneum Petch., Beauveria bassiana (Balsamo) Vuil. e Isaria farinosa (Holmsk.) Fr. (Raya-Díaz et al., 2017; Sán-chez-Rodríguez et al., 2018). En el caso de M. brunneum, se observó un aumento de la disponibi-lidad de Fe en suelos calcáreos y un alivio la clorosis férrica en plantas de sorgo, trigo y girasol (Raya-Díaz et al., 2017; Sánchez-Rodríguez et al., 2016). Sin embargo, no hay estudios sobre los mecanismos por los que los HE mejoran la adquisición de Fe por las plantas. En este trabajo, se han estudiado los mecanismos directos e indirectos que utilizan los HE para aliviar la clorosis férrica en plantas de pepino y melón.
Material y métodos
Cepas fúngicas y preparación del inóculo. En los ensayos se utilizaron dos cepas de B. bassiana (EABb 04/01-Tip y EABb 01/33-Su) y una cepa de M. brunneum (EAMa 01/58-Su) de la colección de cultivos de la Unidad de Entomología Agrícola del Departamento de Agronomía de la Universidad de Córdoba (España) con Códigos de Acceso a la Colección Española de Cultivos Tipo 20744, 21149 y 20764, respectivamente. La colonización endofítica transitoria y temporal de plantas de melón se ha demostrado previamente mediante la aplicación foliar de estas cepas (Garrido-Jurado et al., 2017; Resquín-Romero et al., 2016). Para proporcionar inóculo para los experimentos, las tres cepas se sub-cultivaron a partir de cultivos almacenados en patata dextrosa agar (PDA) en placas de Petri y se cultivaron durante 15 días a 25 °C en la oscuridad.
Estudio in vitro de la biodisponibilidad de Fe mediante la producción de sideróforos. El estudio in vitro se realizó para estudiar las capacidades de las distintas cepas de hongos para desmineralizar Fe. Antes del ensayo, las cepas se cultivaron en medio de agar dextrosa de patata (PDA) para obtener micelio de cuatro días de edad. Este ensayo se repitió dos veces con cuatro réplicas biológicas por cepa. Seguimos un método simplificado (Srimathi & Suji, 2018) del ensayo químico universal para la detección de sideróforos (Schwyn & Neilands, 1987). Discos 6 mm de diámetro de micelio de cada cepa se cortaron de colonias en crecimiento activo (4 d) y se colocaron en el centro de placas de Petri (9 cm) que contenían medio de agar Cromo Sulfonato de Azurol (CAS). Las placas se incubaron a 26 (±2) °C en la oscuridad durante 10 días (Barra-Bucarei et al., 2020). Diariamente, a partir de los 3 y hasta 10 días después de la inoculación (dpi), se midió tanto el diámetro de la colonia y el área de halo amarillo/naranja que la rodeaba, el tamaño del área de color naranja era indicativo de la cantidad de sideróforos producidos (Andrews et al., 2016; Barra-Bucarei et al., 2020).
Estudios de biodisponibilidad de Fe en plantas y suelo. Para evaluar la adquisición de Fe en plantas, se utilizó un diseño completamente aleatorizado con 3 tratamientos (3 cepas aplicadas por empapado del suelo), y su respectivo control, con 6 réplicas (plantas) por tratamiento. Semilla certificada de melón (Cucumis melo L. cv. Galia), con una desinfección superficial (Garrido-Jurado et al., 2017), fue sembrada en sustrato en macetas de 500 ml, tanto las macetas como el sustrato fueron debidamente esterilizados.
La preparación del inóculo se llevó a cabo raspando los conidios de las placas de Petri en una solución estéril de 0,1% Tween 80, seguido de sonicación durante 5 minutos para homogeneizar el inóculo y filtración a través de gasa para eliminar el micelio. Con ayuda de una cámara de Malassezse estimó la concentración de conidios que finalmente se ajustó a 1×108 conidios/ml mediante la adición de una solución estéril de agua destilada con 0,1% Tween 80. El empapado del suelo se llevó a cabo cuando las plantas de melón alcanzaron la etapa de cuatro hojas verdaderas, 5 ml de la suspensión se vertieron con una pipeta sobre la superficie de la maceta. Las plantas control fueron tratadas de manera similar con una solución estéril de 0,1% Tween 80. Luego, a 50 dpi, se realizó un análisis elemental en materia seca y sustrato. Para ello, el sustrato y el material vegetal, incluidas las partes aéreas y las raíces, se secaron en un horno a 60 °C durante 96 h y se pesaron.
El contenido de Fe en materia seca y sustrato se evaluó utilizando la técnica modificada de “Fósforo Olsen” (Olsen et al., 1954). El contenido de Fe se determinó con un espectrofotómetro de absorción atómica (Perkin-Elmer Analyst 200).
Actividad de la reductasa férrica y expresión génica de adquisición de Fe
Condiciones de crecimiento y material vegetal. Para estudiar la actividad de la reductasa férrica y la expresión relativa de los genes de adquisición de Fe se utilizaron dos especies de cucurbitáceas (C. melo L. var. Futuro y Cucumis sativus L. var Ashley, Semillas Fitó, S.A., Barcelona, España). Las plantas se mantuvieron en un sistema hidropónico, en condiciones controladas en una cámara de crecimiento a temperaturas diurnas de 22 °C / 20 °C nocturnas, con humedad relativa entre 50 y 70%, y un fotoperíodo de 14 h a una irradiancia fotosintética de 300 μmol m−2 s−1 proporcionado por luz fluorescente blanca (10,000 lux) (Lucena et al., 2006). Para el mantenimiento del sistema hidropónico se utilizó la solución nutritiva Romheld & Marschner (R&M) (Römheld & Marschner, 1981). Después de 10 días (en el caso del pepino) y 13 días (en el caso del melón) de crecimiento, las plantas se separaron en cuatro grupos que posteriormente constituyeron los 4 tratamientos, como se describe a continuación.
Preparación del inóculo e inoculación por inmersión. La cepa EAMa 01/58-Su de M. brunneum fue elegida para esta parte del estudio debido a las propiedades previamente demostradas para solubilizar Fe. El inóculo se preparó como se describió anteriormente y se ajustó a 1×107 conidios/ml mediante la adición de solución estéril de agua destilada con 0.1% Tween 80.
Las plantas con dos hojas verdaderas fueron seleccionadas y colocadas en bandejas con 2,5 l de solución de inóculo. Las plantas control (no inoculadas) se colocaron en bandejas con 2,5 l de Tween 80% al 0.1%. Todas las plantas se mantuvieron en agitación continua durante 30 min. Después de eso, las plantas inoculadas y no inoculadas se transfirieron a dos condiciones nutricionales diferentes, Fe suficiente (+ Fe40μM) y deficiente (-Fe) para que finalmente se usaran cuatro tratamientos con 42 plantas: Control + Fe40μM (no inoculado), Inoculado + Fe40μM, Control - Fe (no inoculado), Inoculado - Fe. Cada ensayo con ambas especies se repitió dos veces.
Determinación de la actividad de la reductasa férrica (FRA). La FRA se determinó tal y como se describe en García et al., (2022) por el método colorimétrico de la Ferrozina. Tras medir la absorbancia a 562nm, las raíces se cortaron y pesaron. Los resultados se expresaron en relación con el peso fresco de raíz. Además, se tomaron los valores de SPAD diariamente (como un proxy de la concentración de clorofila en la hoja) (SPAD 502 Minolta Camera Co., Osaka, Japón).
Aislamiento de ARN, síntesis de ADNc y análisis de qRT-PCR. El análisis de PCR en tiempo real se llevó a cabo tal y como describe García et al., (2021). Las raíces y las hojas verdaderas se homogenizaron con nitrógeno líquido en un mortero hasta obtener un polvo fino. Para el aislamiento de ARN se utilizó Tri Reagent (Molecular Research Center, Inc., Cincinnati, OH, EUA) y para la síntesis de ADNc se partió de 3μg de ARN total y se usó el kit iScriptTM cDNA Synthesis (Bio-Rad laboratories, Inc, Hercules, CA, EUA) siguiendo la metodología propuesta por García et al., (2011, 2013).
El estudio de la expresión génica mediante qRT-PCR se realizó en un termociclador Bio-Rad CFX, utilizando para ello la máster mix SYBR Green de Bio-Rad siguiendo las instrucciones del fabricante [19,58]. Cada reacción se realizó en un volumen final de 25 μL de los que 2 μL eran de ADNc. Se estudió la expresión relativa de los genes FRO1, IRT1 y HA1 (Aparicio et al., 2023) en pepino, mientras que, en melón, se estudiaron los genes FRO1, FRO2, FRO3, FRO4, IRT1 y FIT (Aparicio et al., 2023; Waters et al., 2014). Los niveles de expresión relativa se calcularon a partir de los valores de los ciclos umbral (Ct) y la eficiencia de los primeros por el método Pfaffl (Pfaffl, 2001). Cada análisis de PCR se realizó en tres réplicas biológicas y cada reacción de PCR se repitió dos veces.
Análisis de datos. Los datos de producción de sideróforos de hierro, el contenido total y relativo de Fe en materia seca y sustrato y los datos de FRA se analizaron mediante análisis de varianza (ANOVA) seguido de una prueba de rango múltiple de Tukey, diferentes letras sobre las barras indican diferencias significativas (p < 0.05) entre los tratamientos (Statistix 9.0®, Analytical Software, Tallahassee, FL, EUA). Los resultados de las expresiones génicas relativas se analizaron mediante análisis unidireccional de varianza (ANOVA) seguido de una prueba de Dunnett, * (p < 0.05), ** (p < 0.01) o *** (p < 0.001) sobre las barras indican diferencias significativas en relación con el tratamiento de control (GraphPad Prism 9.4.0, GraphPad Software, LLC, 2365 Northside Dr., Suite 560, San Diego, CA 92108 USA). Los datos de expresión génica representan la media de tres réplicas técnicas independientes.

Resultados
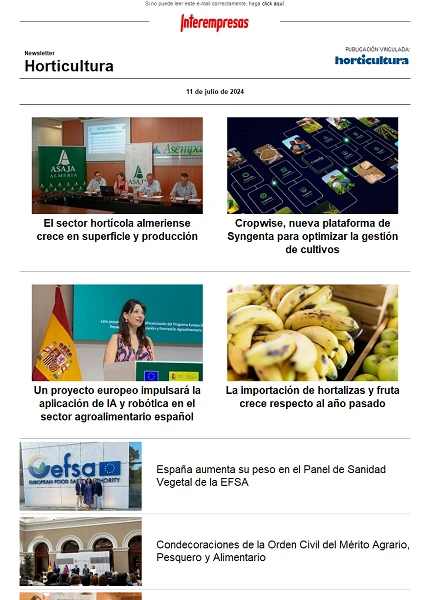
Exudación de sideróforos. Los resultados demostraron diferencias significativas entre las tres cepas en la producción de sideróforos a los 10 dpi (F2,21 = 117.73, p = 0.001); la cepa EAMa 01/58-Su de M. brunneum demostró mayor capacidad de cambiar de color el área del medio CAS agar de azul a naranja (58.4%), mientras que las cepas EABb 04/01-Tip y EABb 01/33-Su de B. bassiana cambiaron el color de solo 24.35% y 17.88%, respectivamente (Figura 1A). En la Figura 1B se observa la evolución de la exudación de sideróforos de Fe, misma que revela diferencia entre la cepa de M. brunneum y los otros a desde los 3 dpi.
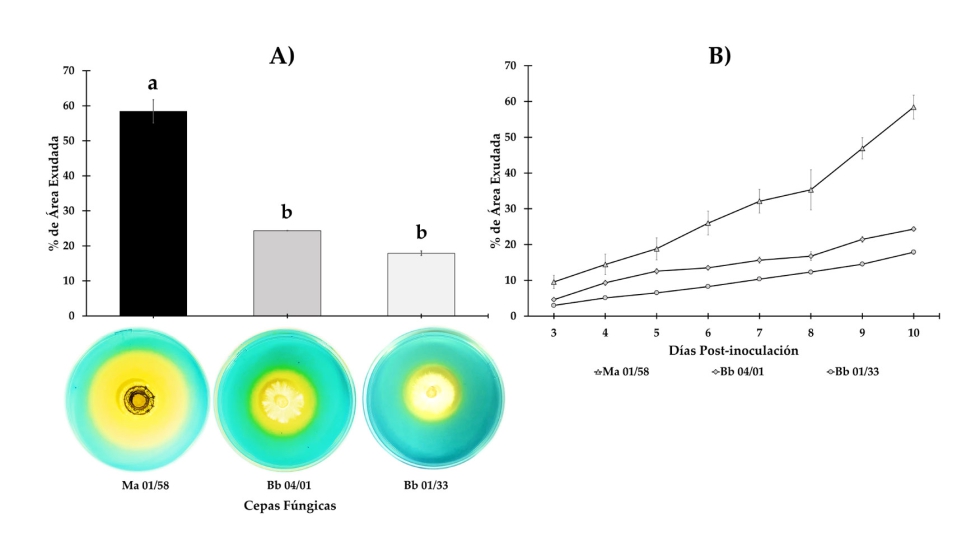
Contenido total de materia seca y Fe en materia seca y sustrato. Se observaron diferencias significativas en la materia seca cuando se compararon los tratamientos con EAMa 01/58-Su (F1,8 = 10.63, p = 0.0115), EABb 04/01-Tip (F1,8 = 5.88, p = 0.0416) y EABb 01/33-Su (F1,8 = 6.78, p = 0.0314) vs. control, sin embargo, podemos ver que las plantas inoculadas con EAMa 01/58-Su produjeron el mayor contenido de materia seca (Figura 2A). Por otro lado, no se observaron diferencias significativas en el contenido de Fe en materia seca cuando comparamos cada tratamiento vs. control [(F1,8 = 2.68, p = 0.1400), (F1,8 = 2.08, p = 0.1870), (F1,8 = 3.0, p = 0.1213), para EAMa 01/58-Su, EABb 04/01-Tip y EABb 01/33-Su, respectivamente] (Figura 2B). En el caso del contenido relativo de Fe en el sustrato, solo el tratamiento con EAMa 01/58-Su vs. control presentó diferencia significativa (F1,6 = 7.77, p = 0.0317) (Figura 2C).
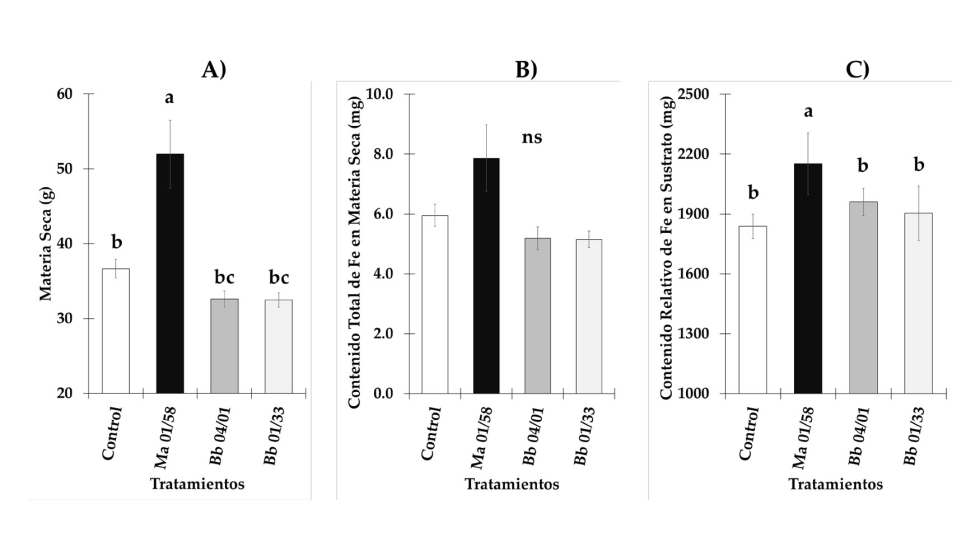
Actividad de la reductasa férrica y genes responsables de la reducción y el transporte de hierro. En general, FRA presentó valores más altos en plantas de pepino y melón cultivadas en condiciones deficientes de Fe. En plantas de pepino, la actividad reductasa fue mayor en plantas deficientes en Fe inoculadas con la cepa EAMa 01/58-Su de M. brunneum en comparación con sus respectivos controles durante los siete días del estudio (Figura 3A). Sin embargo, se detectaron diferencias significativas entre plantas de pepino deficientes en Fe inoculadas y no inoculadas a 4, 5 y 7 dpi [(F3,22 = 13.68, p = 0.001), (F3,20 = 35.3, p = 0.001) y (F3,19 = 74.68, p = 0.001), respectivamente] (Figura 3A). En el caso del melón, se encontraron diferencias significativas entre las plantas deficientes en Fe inoculadas a 3 dpi en relación con las plantas deficientes en Fe no inocu-ladas (F3,20 = 61.23, p = 0.001) (Figura 4A).
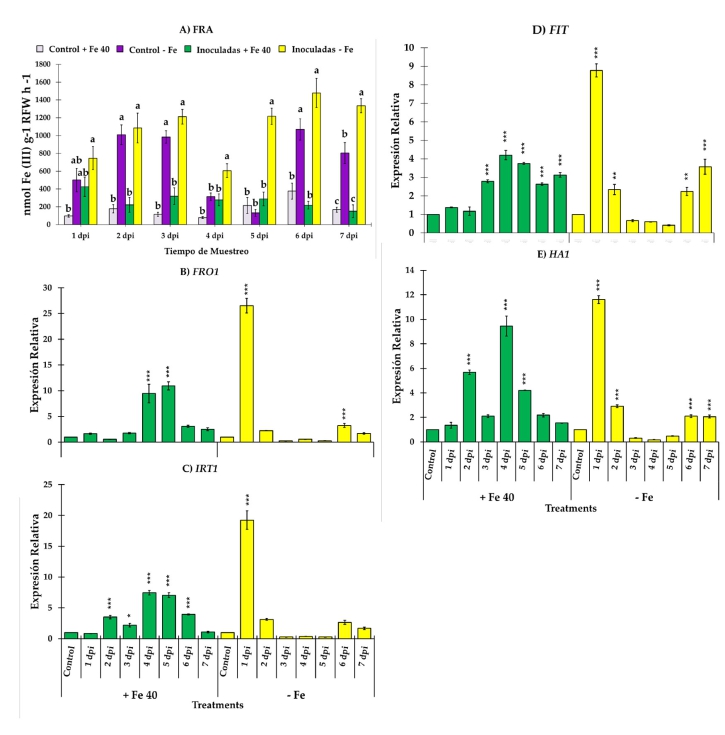
Figura 3. Evolución de FRA a lo largo de siete días de observación y expresión relativa de FRO1, IRT1, FIT y HA1 en raíces de pepino. Se utilizaron cuatro tratamientos, a saber, (i) Control + Fe40μM (no inoculado), (ii) Inoculado + Fe40μM, (iii) Control - Fe (no inoculado) y (iv) Inoculado - Fe. Los datos de expresión génica representan la media de tres réplicas técnicas independientes, según la prueba de Dunnett, * (p < 0.05), ** (p < 0.01) o *** (p < 0.001) sobre las barras indican diferencias significativas en relación con el tratamiento control. En el caso de FRA, la letra sobre las barras denota diferencia significativa entre las plantas inoculadas y las plantas control analizadas por ANOVA completamente aleatorizado seguido de una prueba de Tukey (p < 0.05).
Los niveles de expresión relativa de los genes de adquisición de Fe, FRO1, IRT1, FIT y HA1 en pepino se representan en la figura 3B–E. Los genes de adquisición de Fe experimentaron un au-mento de sus niveles de expresión tras la inoculación con la cepa EAMa 01/58-Su de M. brunneum en ambas condiciones, Fe suficiente y deficiente, en comparación con sus respectivos controles no inoculados en diferentes momentos (Figura 3B–E). Aunque en condiciones de Fe suficiente se observó un aumento de la expresión relativa de los genes estudiados, en ningún caso los valores alcanzados fueron similares a los observados en condiciones deficientes de Fe. En el caso del melón se estudiaron tres genes diferentes que codifican la enzima reductasa férrica como FRO1, FRO2 y FRO3 además de IRT1 y FIT. Al igual que ocurre en las raíces de pepino, la expresión relativa de todos los genes estudiados fue mayor en condiciones de deficiencia de Fe, excepto en el caso de IRT1, en el que no se encontraron diferencias significativas entre plantas cultivadas en condiciones de Fe suficiente y deficiente (Figure 4E). FRO1, FRO3 y FIT alcanzaron su valor máximo de ex-presión relativa al segundo día después de la inoculación (Figure 4B, D–F) mientras que FRO2 lo hizo el tercer día e IRT1 el sexto (Figura 4C y E).
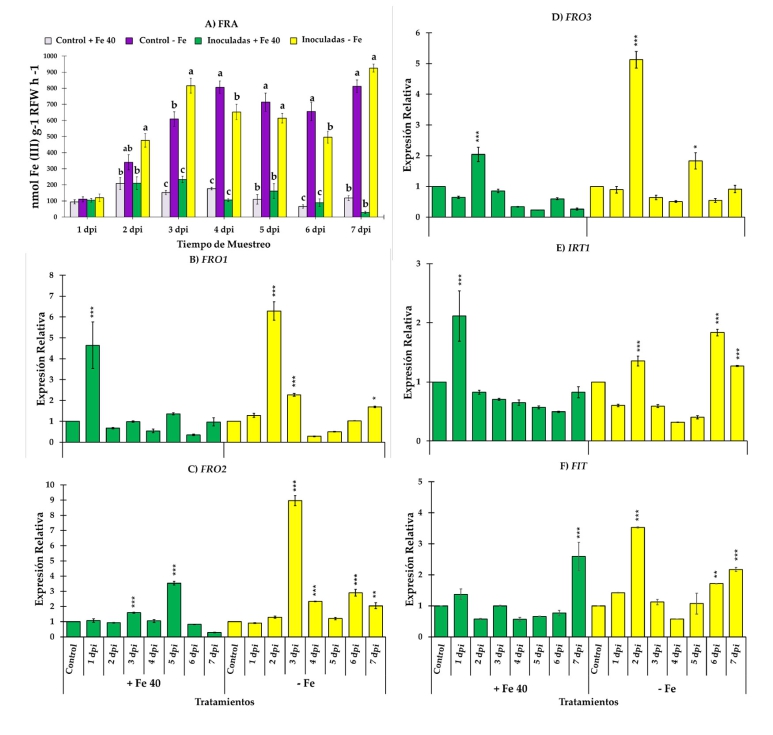
Figura 4. Evolución de FRA a lo largo de siete días de observación y expresión relativa de FRO1, FRO2, FRO3, IRT1 y FIT, en raíces de melón. Se utilizaron cuatro tratamientos, a saber, (i) Control + Fe40μM (no inoculado), (ii) Inoculado + Fe40μM, (iii) Control - Fe (no inoculado) y (iv) Inoculado - Fe. Los datos de expresión génica representan la media de tres réplicas técnicas independientes, según la prueba de Dunnett, * (p < 0.05), ** (p < 0.01) o *** (p < 0.001) sobre las barras indican diferencias significativas en relación con el tratamiento control. En el caso de FRA, la letra sobre las barras denota diferencia significativa entre las plantas inoculadas y las plantas control analizadas por ANOVA completamente aleatorizado seguido de una prueba de Tukey (p < 0.05).
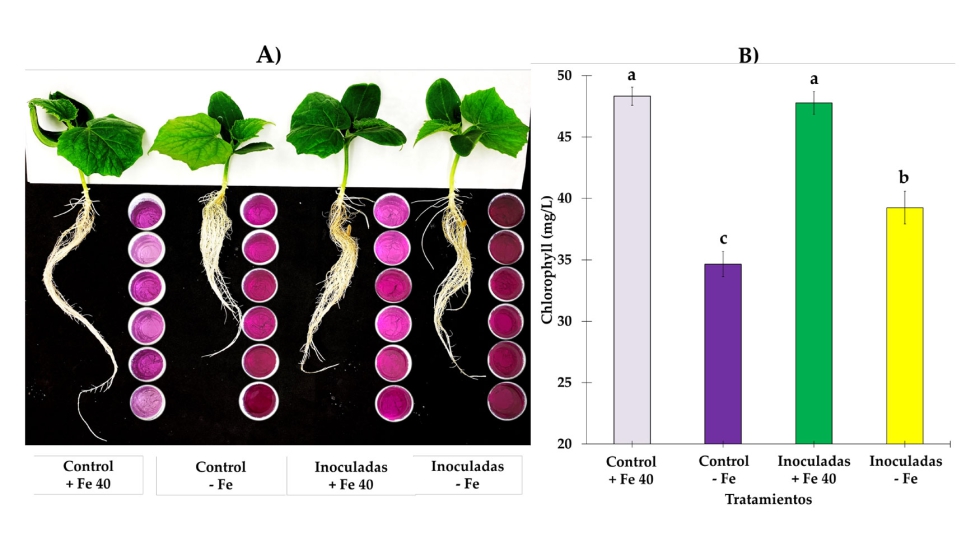
Figura 5. A) Panorama de la actividad de la reductasa férrica (FRA) en raíces de pepino. En el lado derecho de las raíces se pueden ver los contenedores de la solución indicadora a 5 dpi, FRA, en general está muy inducida, sin embargo, como se puede ver en el color púrpura intenso, las plantas inoculadas rebasan su respectivo control; los brotes de plantas inoculadas no mostraron síntomas severos de clorosis como ocurrió en las plantas sin inocula-ción. B) Las medias de los valores de SPAD de 7 dpi mostraron diferencia significativa entre las plantas control y plantas inoculadas cultivadas en condiciones deficientes de Fe. Se utilizaron cuatro tratamientos, a saber, (i) Control + Fe40μM (no inoculado), (ii) Inoculado + Fe40μM, (iii) Control - Fe (no inoculado) y (iv) Inoculado - Fe.
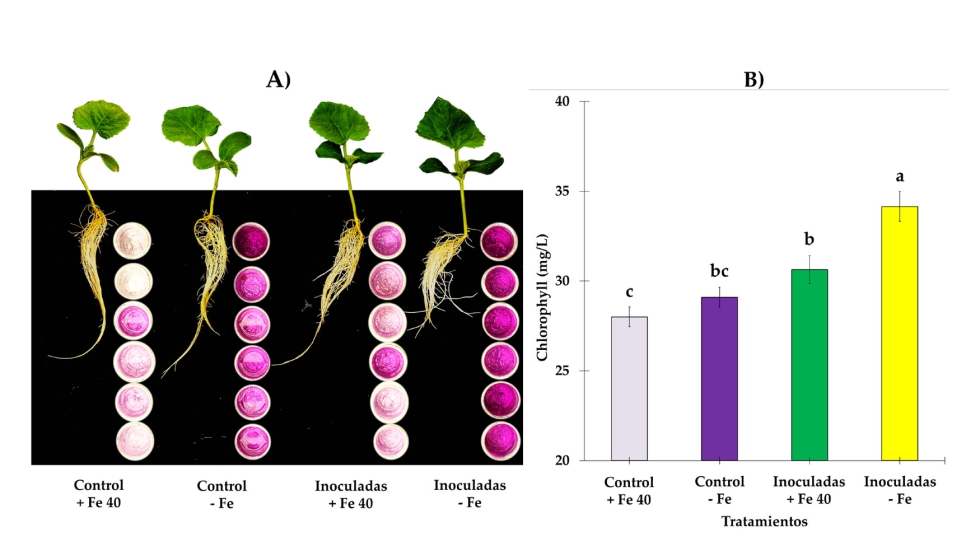
Figura 6. A) Panorama de la actividad de la reductasa férrica (FRA) en raíces de melón. En el lado derecho de las raíces se pueden ver los contenedores de solución indicadora a 5 dpi, FRA presenta claramente diferencia significativa entre los controles y las plantas inoculadas. Se puede observar también un abundante crecimiento de raíces secundarias; los brotes de plantas inoculadas no mostraron síntomas de clorosis. B) Las medias de los valores de SPAD a 7 dpi revelaron diferencia significativa en plantas inoculadas que superan sus respectivos controles, siendo las plantas cultivadas en condiciones deficientes en Fe las que alcanzaron valores más altos en contenido de clorofila. Se utilizaron cuatro tratamientos, a saber, (i) Control + Fe40μM (no inoculado), (ii) Inoculado + Fe40μM, (iii) Control - Fe (no inoculado) y (iv) Inoculado - Fe.
Discusión
Muchos estudios han demostrado que los HE representan una excelente alternativa para el control de plagas de insectos y ácaros en cultivos herbáceos y leñosos claves para la agricultura plagas (Quesada-Moraga et al., 2020). Además, el descubrimiento de nuevas funciones para los HE como endófitos y promotores del crecimiento vegetal, y su competencia en la rizosfera han permi-tido la ampliación de su uso, proporcionando así un valor añadido a su uso principal como agentes de control microbiano de plagas (Quesada-Moraga, 2020; Quesada-Moraga et al., 2020). Más allá, los HE pueden llevar asociados otros beneficios directos e indirectos para el crecimiento de las plantas a través de la movilización de nutrientes y/o la mediación de las relaciones tróficas (Mi-randa-Fuentes et al., 2021; Moonjely & Bidochka, 2019; Quesada-Moraga et al., 2022; Raya-Díaz et al., 2017; Sánchez-Rodríguez et al., 2018). El aumento de la biodisponibilidad de nutrientes a través de la producción de fitohormonas y la mejora del transporte de agua son formas en las que los HE promueven directamente el crecimiento de las plantas; también benefician a las plantas a través de mecanismos indirectos que implican la inducción de resistencia sistémica frente a estreses bióticos (Barra-Bucarei et al., 2020).
Aunque hay estudios previos en los que se muestra un alivio de los síntomas de clorosis férrica tras el tratamiento con HE (Raya-Díaz et al., 2017; Raya–Díaz et al., 2017), muy poco se conoce acerca de los mecanismos directos e indirectos utilizados por los HE para promover la adquisición de Fe en plantas, motivo por el cual ese ha sido el principal objetivo de este trabajo. En un trabajo de Raya-Díaz et al., (2017) mostraron que M. brunneum EAMa 01/58-Su aplicado al suelo en dosis altas (5 × 108 conidios ml−1) alivió los síntomas de clorosis de Fe en plantas de sorgo cultivadas en suelos calcáreos, y aumentó la altura de las plantas y la producción de inflorescencia de girasoles cultivados en suelos calcáreos y no calcáreos.
Nuestro estudio in vitro demostró la capacidad de la cepa EAMa 01/58-Su de M. brunneum para desmineralizar el Fe siendo la más efectiva en la producción de sideróforos de Fe, con un 58.4% de exudación de sideróforos superficiales de 10 dpi, mientras que las cepas de B. bassiana EABb 04/01-Tip y EABb 01/33-Su solo lograron el 24.3% y el 17.8% de exudación de sideróforos superficiales, respectivamente. El aumento de la disponibilidad de Fe resultante de la aplicación de una cepa específica podría deberse a la secreción de ácidos orgánicos, reduciendo así el pH del medio, o a través de la liberación de sideróforos que quelatan no solo Fe sino también otros elementos como Zn, Mn y Cu (Krasnoff et al., 2014; Raya-Díaz et al., 2017). Algunos estudios mostraron datos similares utilizando el conocido género Trichoderma (Sánchez-Montesinos et al., 2020) y otros utilizando el saprofito Aspergillus niger mostrando habilidades como solubilizadores de fósforo (Baron et al., 2018, 2020; Naeem et al., 2022; Pal & Ghosh, 2018). Estudios recientes de Ba-rra-Bucarei et al., (2020) mostraron diferencias entre cinco cepas de B. bassiana, aunque cuatro de ellos fueron capaces de producir sideróforos, las cepas RGM-731 y RGM-644 destacaron por su alta capacidad de exudación de sideróforos, 73% y 81%, respectivamente. Nuestros resultados muestran la capacidad de los HE para solubilizar nutrientes como el Fe a nivel específico de cepa, así como la inducción de respuestas de deficiencia de Fe. Este hallazgo supone un importante avance en el conocimiento de nuevas aptitudes de estos hongos y su función como promotores de crecimiento de las plantas.
Conclusiones
En este trabajo se ha estudiado la capacidad de la cepa M. brunneum 01/58-Su para inducir respuestas de deficiencia de Fe en dos especies de Cucurbitaceae, C. sativus y C. melo. Los resul-tados obtenidos muestran que la cepa EAMa 01/58-Su de M. brunneum indujo claramente la acti-vidad de la reductasa férrica y la expresión relativa de los genes de adquisición de Fe, FRO, IRT1, HA1 y FIT en ambas especies. Estas nuevas habilidades de la cepa EAMa 01/58-Su de M. brunneum le confieren un valor añadido a su uso como excelente agente de control biológico y ponen de ma-nifiesto los mecanismos directos e indirectos implicados en la adquisición de Fe mediada por un HE.
Agradecimientos
El presente estudio ha sido apoyado por los proyectos PYC20 RE 067 UCO de la Junta de Andalucía (Consejería de Economía, Conocimiento, Empresas y Universidad) y PID2019-103844RB-I00 del Ministerio de Ciencia e Innovación. Asimismo, agradecemos el apoyo financiero del Ministerio de Ciencia e Innovación, la Agencia Estatal de Investigación, a través del Programa Severo Ochoa y María de Maeztu para Centros y Unidades de Excelencia en Investigación y Desarrollo (Ref. CEX2019-000968-M). Los autores agradecen al personal del laboratorio de la Unidad de Edafología Agrícola (AGR-165) del Departamento de Agronomía de la Universidad de Córdoba por las facilidades y ayuda prestadas en el presente trabajo.
Referencias
Consultar con los autores.
DECLARACIÓN
El presente trabajo es una adaptación del trabajo original titulado “Entomopathogenic FungiMediated Solubilization and Induction of Fe Related Genes in Melon and Cucumber Plants” publicado recientemente en el Journal of Fungi (https://doi.org/10.3390/jof9020258).