Los frutos más maduros presentan mayor contenido de compuestos con actividad antioxidante que los hacen más saludables
Cómo afecta el momento de recolección en el sabor y los compuestos saludables de la fruta
A.M., Fernández-León1, M.C., Ayuso Yuste2, M.J. Bernalte García3, M. J. Serradilla1, B., Velardo-Micharet1*
1Área de Postcosecha, Instituto Tecnológico Agroalimentario de Extremadura, Centro de Investigaciones Científicas y Tecnológicas de Extremadura, Avd. Adolfo Suárez s/n, 06007, Badajoz, España. Email: belen.velardo@juntaex.es
2Departamento de Ingeniería del Medio Agronómico y Forestal, Escuela de Ingenierías Agrarias, Universidad de Extremadura. Avd. Adolfo Suárez, s/n. 06007, Badajoz, España.
3Departamento de Biología Vegetal, Ecología y Ciencias de la Tierra, Escuela de Ingenierías Agrarias, Universidad de Extremadura. Avd. Adolfo Suárez, s/n. 06007, Badajoz, España.
20/03/2023El momento de recolección determina la calidad de la fruta y su aptitud al almacenamiento postcosecha, pero también la cantidad de compuestos bioactivos, que hacen que el consumo de frutas sea saludable. El objetivo de este trabajo fue estudiar la evolución de la calidad sensorial y bioactiva de cerezas y ciruelas a lo largo de su maduración.
Introducción
La evolución de la fruta a lo largo de la maduración, así como el momento óptimo de recolección, son cuestiones muy importantes para el sector frutícola, ya que determinan la calidad y la vida útil de la fruta (Fernández León et al., 2019). En general, una recolección temprana, minimiza los problemas postcosecha a costa de la calidad sensorial de la fruta y, por el contrario, una recolección tardía, garantiza el sabor de la fruta, pero limita su comercialización a mercados cercanos, por su menor vida útil. Además de sus propiedades fisicoquímicas, que tienen una importante repercusión en la calidad nutritiva y sensorial de la fruta, existen otros compuestos, generalmente conocidos como compuestos bioactivos, que son responsables de que el consumo de fruta sea saludable. Se trata de compuestos con efectos beneficiosos para la salud, tales como el contenido de fibra, vitaminas, compuestos fenólicos y carotenos. La cereza y la ciruela japonesa son frutas de hueso que pertenecen al mismo género (Prunus spp). Además de ser fuente de compuestos fenólicos que aportan actividad antioxidante, la cereza destaca por su contenido natural de melatonina, la hormona del sueño (González-Gomez et al., 2009), y la ciruela por su elevado contenido en sorbitol (Singh & Singh, 2008), con reconocidos efectos laxantes.
Extremadura es el principal productor de ciruela japonesa y segundo productor de cereza a nivel nacional (MAPA, 2021). De ahí que el objetivo de este trabajo fuera establecer la evolución de la calidad sensorial y bioactiva de cereza y ciruela a lo largo de su maduración en el árbol.
Materiales y métodos
Material vegetal
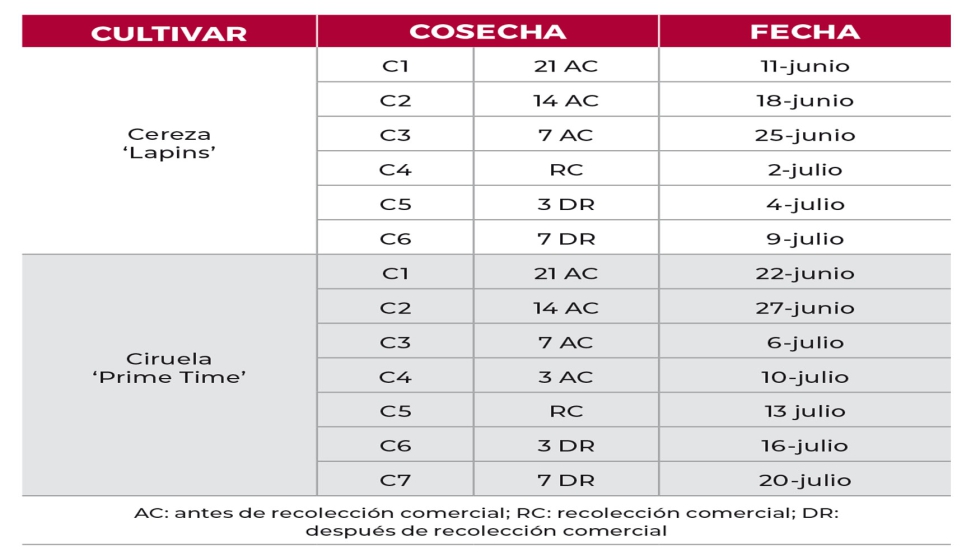
El ensayo se realizó en cereza ‘Lapins’ y ciruela japonesa de piel y pulpa roja ‘Prime Time’, cultivadas en fincas comerciales del Valle del Jerte (Cáceres) y de las Vegas Bajas del Guadiana (Badajoz), respectivamente. Se marcaron un total de 60 frutos procedentes de 3 árboles por cultivar, sobre los que se realizó un seguimiento periódico de la maduración del fruto en el árbol, desde 21 días antes de recolección comercial hasta que la fruta alcanzó la madurez organoléptica, 7 días después de la recolección comercial (Tabla 1).
Métodos de análisis
La evolución de la calidad físicoquímica (peso, calibre, firmeza, color, acidez titulable y contenido en sólidos solubles totales) se realizó según los métodos descritos por Fernández-León et al. (2019). La extracción y cuantificación de clorofila a (mg 100 g-1) se hizo siguiendo el método de Fernández-León et al. (2010). La extracción de compuestos carotenoides se realizó con el mismo método que el de las clorofilas, y su cuantificación con el método descrito por Dragovic-Uzelac et al. (2007). La extracción, separación e identificación de los compuestos fenólicos (mg 100 g-1) se realizó según el método descrito por Manzano-Durán et al. (2019). La actividad antioxidante (mg Trolox 100 g-1) se realizó siguiendo el método de Serrano et al. (2009). Para el tratamiento estadístico de los resultados se empleó el programa informático SPSS 20.0 (IBM Statistics, Chicago, IL, USA).
Resultados y discusión
Cereza ‘Lapins’
El proceso madurativo de las cerezas en el árbol estuvo definido por una disminución paulatina de la firmeza, junto con una pérdida gradual del contenido en clorofila a (Tabla 2). La acidez titulable de los frutos aumentó hasta la cosecha 3, debido a los procesos de pigmentación de las cerezas (Díaz Mula et al., 2009), y a partir de ese momento el porcentaje de acidez se mantuvo sin diferencias significativas (p>0,05), con valores medios de 0,6 g ácido málico 100 g-1. Con la maduración, los frutos fueron ganando en tamaño, color (mayor relación a*/b*) y en contenido de sólidos solubles totales (SST). Desde el punto de vista gustativo, las cerezas maduradas en el árbol presentaron características más atrayentes para el consumidor, dado su mayor calibre, coloración más oscura y mayor relación SST/Acidez (Tabla 2).
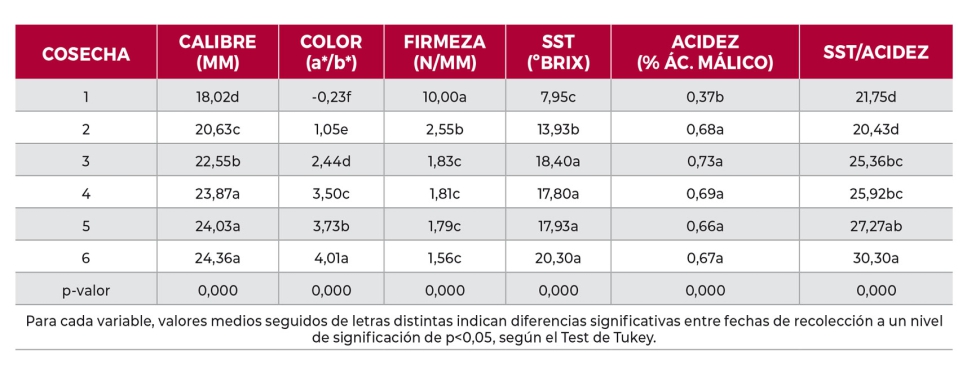
Desde el punto de vista bioactivo, los carotenos fueron minoritarios y no presentaron una tendencia clara con la maduración de los frutos. Sin embargo, los compuestos fenólicos aumentaron significativamente (p<0,05) a lo largo de la maduración. Las familias de compuestos fenólicos más abundantes en cereza fueron los ácidos hidroxicinámicos y las antocianinas (Fig. 1). Los flavonoles (catequina y epicatequina) y flavanoles (quercetina 3-O-rutinósido) fueron minoritarios y presentaron un comportamiento errático a la largo de la maduración. Se identificaron cuatro ácidos hidroxicinámicos: neoclorogénico, p-cumaroilquínico, clorogénico y p-cumárico, cuyo contenido disminuyó a lo largo de la maduración. De las tres antocianinas identificadas, la cianidina 3-O-rutinósido fue la mayoritaria, seguida de la cianidina 3-O-glucósido y la peonidina 3-O-glucósido. El contenido en antocianinas, los pigmentos responsables del color rojo de las cerezas, aumentó significativamente (p<0,05) durante el proceso de maduración, acorde a lo descrito por Serradilla et al. (2012). La actividad antioxidante aumentó considerablemente con la maduración de los frutos (Fig. 2), presentando las cerezas recolectadas 3 y 7 días después de la recolección comercial un 18 y 29% más de actividad antioxidante, respectivamente.
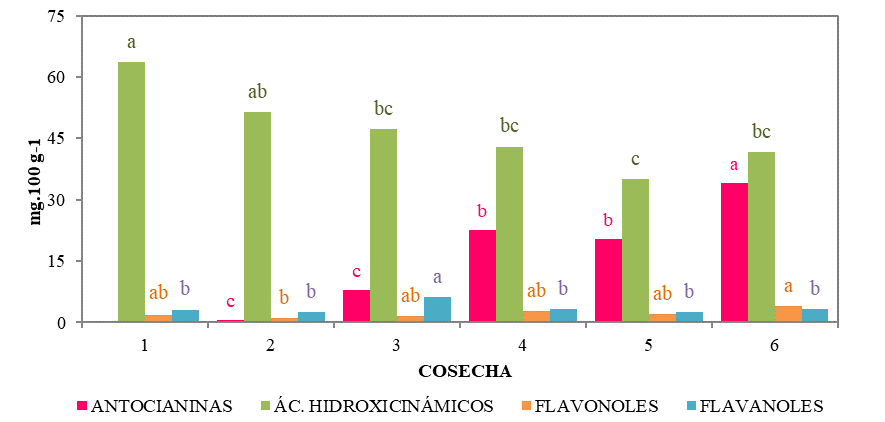
Fig. 1. Evolución de la concentración de las diferentes familias de compuestos fenólicos de cereza ‘Lapins’ durante su maduración. Para cada variable, datos marcados con letras diferentes implican diferencias significativas entre fechas (p<0,05 según el test de Tukey HSD).
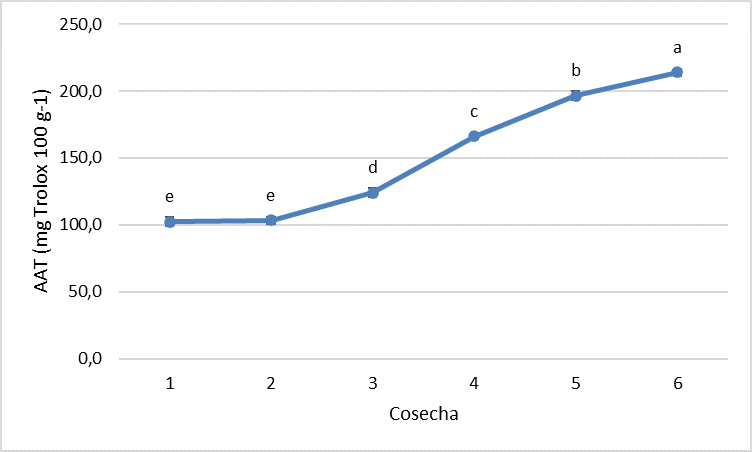
Fig. 2. Evolución de la actividad antioxidante total de cerezas ‘Lapins’ a lo largo de su maduración en el árbol. Datos marcados con letras diferentes implican diferencias significativas entre fechas (p<0,05 según el test de Tukey HSD).
Ciruela ‘Prime Time’
La maduración de la ciruela estuvo marcada por un descenso de la firmeza y acidez de los frutos, acompañada de un aumento de tamaño, del contenido en sólidos solubles totales y de una mayor pigmentación (índice CIRG) de los frutos a medida que avanzaba la maduración (Tabla 3).
La determinación de los compuestos bioactivos en ciruela se hizo en piel y pulpa por separado, ya que el consumo de la ciruela puede incluir la piel o no, dependiendo del gusto del consumidor. En general, los compuestos identificados en este trabajo estuvieron en mayor concentración en la piel que en la pulpa de los frutos, por lo que, desde el punto de vista bioactivo, se recomienda el consumo de ciruelas con piel. La clorofila a disminuyó significativa y paulatinamente, desde la cosecha 1 hasta el final de la maduración. Los carotenos presentes en la piel se mantuvieron en un valor medio y estable de 1,72 mg 100 g-1 durante todo el proceso de maduración de los frutos, a diferencia de la pulpa donde hubo un incremento significativo (p<0,05) del contenido de carotenos en los frutos más maduros. Los compuestos fenólicos también aumentaron de forma significativa (p<0,05) en los frutos más maduros (Fig. 3). Las antocianinas (cianidina 3-O-glucósido y cianidin 3-O-rutinósido) y los flavonoles (quercetinas 3- rutinósido, glucósido, galactósido y arabinósido, kaempferol 3-O-rutinósido e isorhamnetín 3-O-rutinósido) fueron las familias mayoritarias en la piel. Los ácidos hidroxicinámicos (neoclorogénico, clorogénico, p-cumárico y t-ferúlico) y los flavanoles (catequina y epicatequina) fueron minoritarios y no presentaron una tendencia clara con la maduración de los frutos. La actividad antioxidante total de la piel aumentó en los frutos más maduros, manteniéndose en valores estables en la pulpa (Fig. 4). Se encontraron claras diferencias entre los valores de actividad antioxidante de la piel (1002,9 mg Trolox 100g-1) frente a los de la pulpa (176,7 mg Trolox 100g-1).
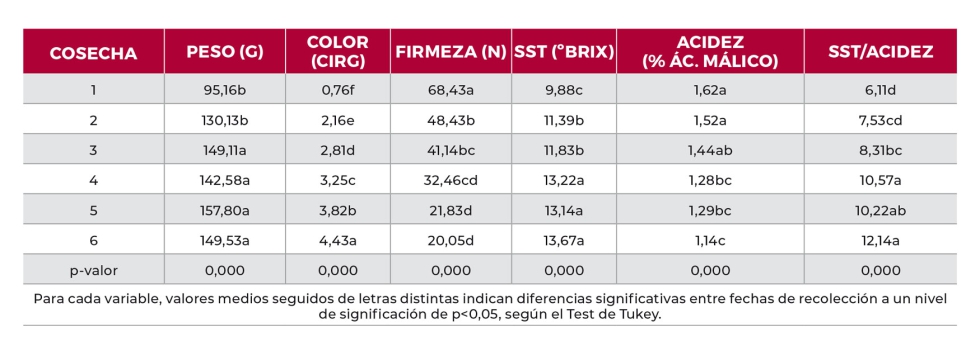
Tabla 3. Evolución de las características físicoquímicas de ciruela ‘Prime Time’ a lo largo de su maduración en el árbol.
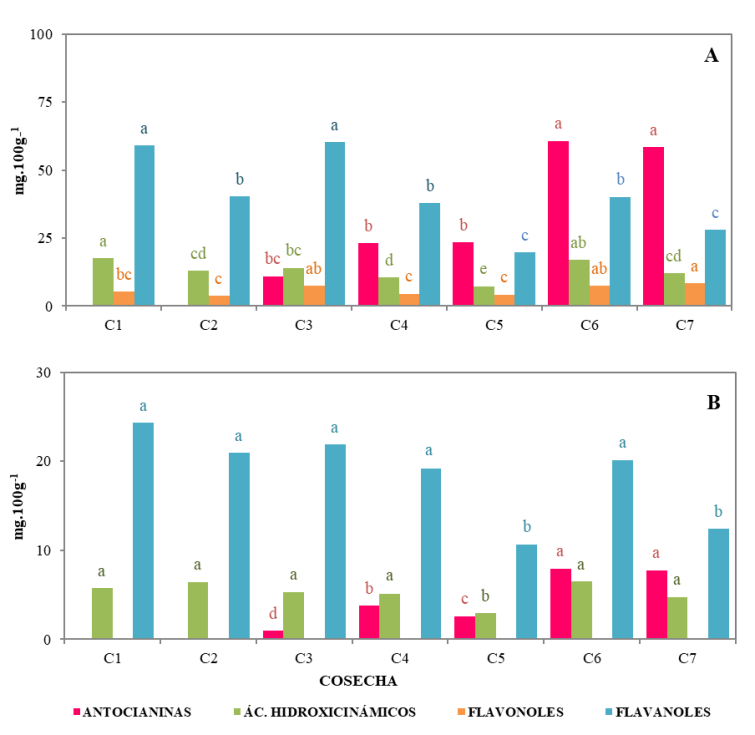
Fig. 3. Evolución del contenido de compuestos fenólicos en piel (A) y en pulpa (B) de ciruela ‘Prime Time’ durante su maduración. Para cada variable, datos marcados con letras diferentes implican diferencias significativas entre fechas (p<0,05 según el test de Tukey HSD).
Conclusiones
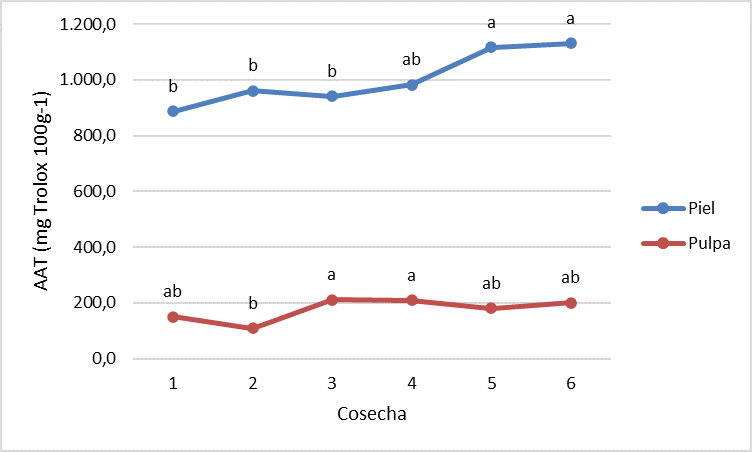
Fig. 4. Evolución de la actividad antioxidante total de ciruela ‘Prime Time’ a lo largo de su maduración en el árbol. Datos marcados con letras diferentes implican diferencias significativas entre fechas (p<0,05 según el test de Tukey HSD).
Agradecimientos
Al Proyecto INNOACE, Innovación Abierta e Inteligente en la EUROACE, financiado por el Programa Operativo de Cooperación Transfronteriza España Portugal (POCTEP) de la Unión Europea (2017-2019).
Referencias
Díaz-Mula, H.M., Castillo, S., Martínez-Romero, D., Valero, D., Zapata, P.J., Guillén, F., and Serrano, M. (2009). Sensory, nutritive and funcional properties of Sweet Cherry as affected by cultivar and ripening stage. Food Sci Tech Int. 15 (6):0535-543.
Dragovic-Uzelac, V., Levaj, B., Mrkic, V., Bursac, D., Boras, M. (2007). The content of polyphenols and carotenoids in three apricot cultivars depending on stage of maturity and geographical region. Food Chem., 102:966-975.
Fernández León, A.M., Ramírez, M.R., Ayuso Yuste, M.C., Serradilla, M.J., Velardo Micharet, B. (2019). “INNOACE: aplicación de tecnologías no destructivas para la monitorización de la maduración en árbol de fruta de hueso”. Horticultura, 343:14-19
Fernández-León, M.F. Lozano M., Ayuso M.C., Fernández-León A.M., González-Gómez D. (2010). Fast an accurate alternative UV-chemometric method for the determination of chlorophyll A and B in broccoli (Brassica oleracea Italica) and cabbage (Brassica oleracea Sabauda) plants. J. Food Composit. Anal., 23: 809-813.
González-Gómez, D., Lozano, M., Fernández-León, M.F., Ayuso, M.C., Bernalte, M.J., Rodríguez, A.B. (2009). Detection and quantication of melatonin and serotonin in eight Sweet Cherry cultivars (Prunus avium L.). Eur. Food Res. Technol., 229:223–229.
MAPA (2021). https://www.mapa.gob.es/es/estadistica/temas/estadisticas-agrarias/agricultura/superficies-producciones-anuales-cultivos/
Manzano Durán, R., Fernández Sánchez, J.E., Velardo-Micharet, B., Rodríguez Gómez, M.J. (2019). Multivariate optimization of ultrasound-assisted extraction for the determination of phenolic compounds in plums (Prunus salicina Lindl.) by high-performance liquid chromatography (HPLC). Instrum. Sci. Technol. DOI:10.1080/10739149.2019.1662438
Serradilla, MJ., Martín, A., Ruiz-Moyano, S., Hernández, A., López-Corrales, M., Córdoba, M.G. (2012). Physicochemical and sensorial characterisation of four sweet cherry cultivars grown in Jerte Valley (Spain). Food Chem., 133:1551–1559.
Serrano, M., Díaz-Mula, H. M., Zapata, P.J., Castillo, S., Guillén, F., Martínez-Romero, D., Valverde, J.M., Valero, D. (2009). Maturity stage at harvest determines the fruit quality and antioxidant potential after storage of sweet cherry cultivars. J. Agric Food Chem, 57:3240-3246.
Singh, S.P. and Singh, Z. (2008). Major flavor components in some commercial cultivars of Japanese plum. J. Amer. Pomological Soc., 62(4):185-190.