Respuesta adaptativa a sequía en dos cultivares de melocotonero en condiciones de aridez
B. Bielsa1, J. García-Brunton2, M.A. Sanz3 y M.J. Rubio-Cabetas1
1Unidad de Hortofruticultura, Centro de Investigación y Tecnología Agroalimentaria de Aragón, Instituto Agroalimentario de Aragón – IA2 (CITA-Universidad de Zaragoza)
2Departamento de Producción Vegetal y Agrotecnología, Instituto Murciano de Investigación y Desarrollo Agrario y Alimentario (IMIDA) 3Área de Laboratorios de Análisis y Asistencia Tecnológica. Centro de Investigación y Tecnología Agroalimentaria de Aragón (CITA)
09/09/2019El comportamiento de las plantas frente a el estrés por sequía es diferente en función tanto de la naturaleza del material (plantas vs. árboles) como de las condiciones experimentales (controladas vs. campo). Por ello, desde la Unidad de Hortofruticultura del Centro de Investigación y Tecnología Agroalimentaria de Aragón (CITA de Aragón) se ha estudiado la respuesta fisiológica bajo condiciones de sequía y un posterior periodo de recuperación de riego de dos cultivares de melocotonero con diferentes necesidades de frío, 'Ufo-3' y 'Fergold', injertados sobre el híbrido 'Garnem' en una de las regiones más áridas de España. También se analizó el papel de una de las fitohormonas más importantes en la respuesta a estrés, el ácido abscísico (ABA), y su relación con la respuesta fisiológica bajo nuestras condiciones experimentales.
El melocotonero ha sido una de las especies con mayor importancia económica dentro de los frutales de hueso (Prunus L.). España sigue siendo el segundo productor a nivel mundial de melocotón solo por detrás de China (FAOSTAT, 2019). Las principales zonas españolas productoras de melocotón son el Valle del Ebro y Murcia con un 78% de la producción total nacional en 2018 (MAPA, 2019). Estas regiones destacan a nivel edafoclimatológico por sus largos períodos secos con alta radiación y temperatura, y la semiaridez de sus suelos características favorables para el desarrollo de diferentes estreses abióticos y entre ellos el más importante la sequía. Aunque el cultivo del melocotonero se realiza en regadío, la producción de fruta se ve afectada bajo estas condiciones ambientales limitantes (Romero y Botía, 2006).

Debido a que el sistema radicular de las plantas es el responsable de la absorción de agua y nutrientes, es imprescindible seleccionar patrones adaptados a las condiciones de cultivo desfavorables, como el estrés hídrico provocado por la sequía y la influencia que ejerce sobre la variedad injertada en cuanto a transpiración y balance hídrico. Uno de los principales retos en la mejora genética de patrones es la creación de híbridos que combinen caracteres de interés de diferentes especies de Prunus. Entre estas destacan los híbridos interespecíficos, del cruzamiento entre el almendro 'Garfi' [Prunus amygdalus Batsch, syn P. dulcis (Mill.)] y el melocotonero 'Nemared' [P. persica (L.) Batsch], 'Garnem', 'Felinem' y 'Monegro', seleccionadas en el Centro de Investigación y Tecnología Agroalimentaria de Aragón (CITA) cuyas características principales son el vigor, la resistencia a nematodos y la adaptación a suelos calcáreos (Felipe, 2009), así como su tolerancia a la sequía (Bielsa et al., 2016, y 2018).
En periodos de sequía, como consecuencia de la falta de agua en el suelo, las plantas disminuyen su estado hídrico, provocando la puesta en marcha de diferentes mecanismos de respuesta en función de su estrategia: de escape, de evitación o de tolerancia al estrés (Blum, 2016). Estos mecanismos están asociados a la regulación de procesos fisiológicos y bioquímicos tales como el cierre estomático, el ajuste osmótico, la estabilidad de las membranas celulares y modificaciones en el crecimiento (Verslues et al., 2006; Blum, 2016). Esta información fisiológica y bioquímica generalmente se ha obtenido en condiciones experimentales específicas y controladas. Sin embargo, es conocido que los árboles se comportan de forma diferente en condiciones de campo. Corroborando esta afirmación, Arndt et al. (2000) descubrieron un grado de tolerancia a la sequía en melocotoneros en condiciones de campo. En cambio, evidenciaron una falta de ajuste osmótico en plantas de melocotonero bajo condiciones controladas de sequía en invernadero. Así pues, comprender la respuesta fisiológica en campo es una cuestión crucial en los programas de mejora genética de portainjertos.
En este contexto, el objetivo de nuestro estudio fue determinar la respuesta fisiológica y bioquímica en condiciones de campo al estrés hídrico provocado por la sequía, así como comprender su comportamiento en el proceso de recuperación de sus funciones homeostáticas una vez restaurado el aporte hídrico.
Material y métodos
La evaluación de la respuesta a sequía se llevó a cabo en dos cultivares de melocotonero [Prunus persica (L.) Batsch] con diferentes necesidades de frío y épocas de maduración de fruto 'Ufo-3' (500 c.u. - maduración a finales de mayo) y 'Fergold' (750 c.u. - maduración a principios de julio), injertados en el verano de 2013 sobre el patrón híbrido 'Garnem'. En 2014, se establecieron en campo con un marco de plantación de 5×2,5 m en una parcela experimental localizada en las instalaciones del IMIDA en El Jimenado (Torre Pacheco, Murcia). El sistema de riego fue goteo automatizado, incluyendo dos líneas de irrigación por fila y cuatro goteros con un caudal de 2 l h–1 por cada árbol. La cosecha se realizó en dos fechas distintas para cada año experimental (2015: 'Ufo-3' en los días 25 y 30 de mayo; 'Fergold' en los días 2 y 6 de julio; 2016: 'Ufo-3' en los días 22 y 27 de mayo; 'Fergold' en los días 27 junio y 1 julio). Tras dicha cosecha, el nivel de riego se redujo al 50% de su capacidad de campo (CC) ya que, una vez realizada la recolección, los requerimientos hídricos disminuyen, pudiendo así controlar el crecimiento vegetativo en poscosecha. El tiempo de riego establecido en el momento del experimento fue en 2015 de 2 h / día y en 2016 de 1,5 h / día desde las 9:00 (UTC +2) en ambos años.
El experimento se llevó a cabo con un diseño experimental aleatorio de 12 bloques completos (6 por cada experimento) con 10 repeticiones, y dos guardas por cada cultivar y bloque de tratamiento, llegando a un número total de 135 árboles, en dos años consecutivos: en 2015, del 10 al 20 de julio y en 2016, del 16 al 26 de septiembre, en poscosecha debido a que esta fase es clave para mantener la absorción de nutrientes, así como la producción de fotoasimilados que se utilizarán en el período de formación y desarrollo de yemas y en la posterior floración (Timm et al., 2007). Se determinaron dos tratamientos de irrigación: control y estresado. Los árboles control mantuvieron el nivel de riego deficitario al 50% de su CC establecido tras la cosecha a lo largo del experimento, mientras que los árboles pertenecientes al grupo estrés fueron sometidos a 5 días sin riego. Tras estos 5 días sin suministro de agua, el riego fue reestablecido con el mismo régimen hídrico que los árboles control.
Determinación del contenido hídrico del suelo y el árbol
La humedad del suelo fue calculada mediante un sensor portátil de capacitancia. Para ello se colocaron tubos de acceso de 1 m de profundidad a 30 cm del emisor y 20 cm de la línea portagotero, en la zona de influencia del bulbo húmedo y del sistema radicular para cada uno de los bloques tratamiento.
El estado hídrico del árbol se estudió en cada bloque de tratamiento calculando el potencial hídrico foliar (PHF) mediante una cámara de presión de Scholander. El intercambio gaseoso foliar a lo largo del experimento se evaluó a partir de diferentes parámetros fisiológicos: conductancia estomática (gs), fotosíntesis neta o asimilación de CO2 (An), transpiración (E) y concentración de CO2 intracelular (Ci) que fueron medidos mediante el sistema portátil de Li-6400XT. Asimismo, el índice de uso eficiente del agua intrínseco (UEAi) se calculó como la relación An/gs.
Determinación del contenido de ácido abscísico foliar
Una vez realizada la extracción del ácido abscísico de las muestras de hojas tomadas a lo largo del experimento para cada bloque del tratamiento control y estresado, se llevó a cabo su determinación mediante un sistema de cromatografía líquida de ultra eficacia de triple cuadrupolo (UPLC-TQD). Finalmente, para la cuantificación se utilizó el método de adición estándar.
Análisis estadístico
Los resultados obtenidos se analizaron con el paquete estadístico SPSS21 mediante dos tipos de pruebas: (i) para los datos que presentaban una distribución normal (datos paramétricos) se realizó un análisis de la variancia de una vía (ANOVA), en el cual las diferencias significativas fueron obtenidas mediante la prueba de Duncan (p ≤ 0,05); (ii) para los datos en los que la hipótesis de normalidad fuese descartada con un nivel de confianza del 95% (datos no paramétricos), se realizó la prueba no paramétrica de Kruskal-Wallis (p < 0,05). Por otra parte, las diferencias significativas para las variables estudiadas entre los dos cultivares y entre los dos tratamientos para cada día del experimento fueron determinadas mediante la prueba t de Student (p ≤ 0,05).
Resultados y discusión
Efectos del estrés por sequía en el contenido de humedad del suelo y el estado hídrico del árbol
La disminución de la disponibilidad de agua en el periodo de sequía revelada por el menor contenido hídrico del suelo (CHS) acumulado en los primeros 30 cm de profundidad, junto con los valores de potencial hídrico foliar (PHF) significativamente inferiores llegando hasta –2,3 MPa en los árboles estresados ponen de manifiesto el estrés hídrico al que fueron sometidos (Figuras 1, 2A y 2B). El descenso del CHS en los árboles estresados fue diferente en función del cultivar. En 'Fergold' (cultivar con época de maduración de fruto más tardía) el descenso fue ligeramente superior llegando a un CHS de 30% y un 28% para el primer y segundo año, respectivamente (Figura 1). Las diferencias en la demanda hídrica de cada cultivar, basado en sus distintas fechas de maduración de fruto, y el grado de adaptación al ambiente estresante de la zona del experimento, podrían explicar las diferencias encontradas en el CHS. 'Ufo-3' madura un mes antes que 'Fergold', por tanto, el consumo de agua por parte de 'Ufo-3' sería menor que en 'Fergold' en el momento del experimento. Como consecuencia, el descenso en CHS sería menos pronunciado en 'Fergold'.
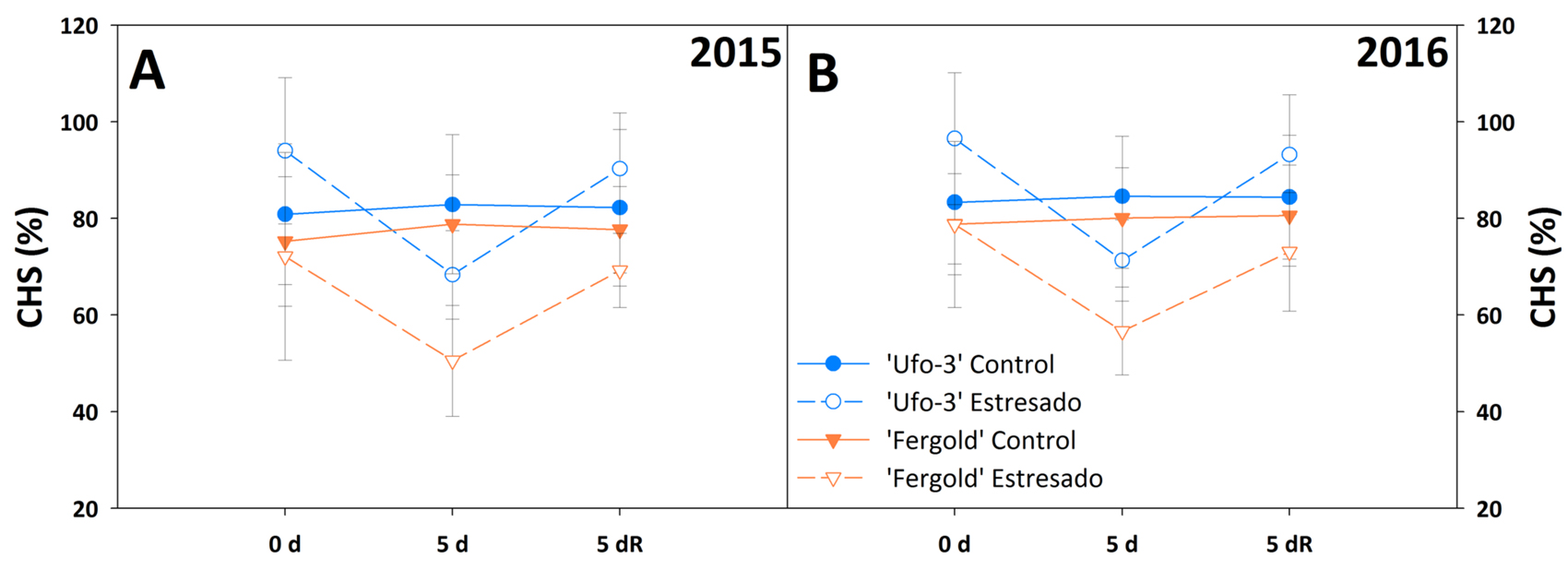
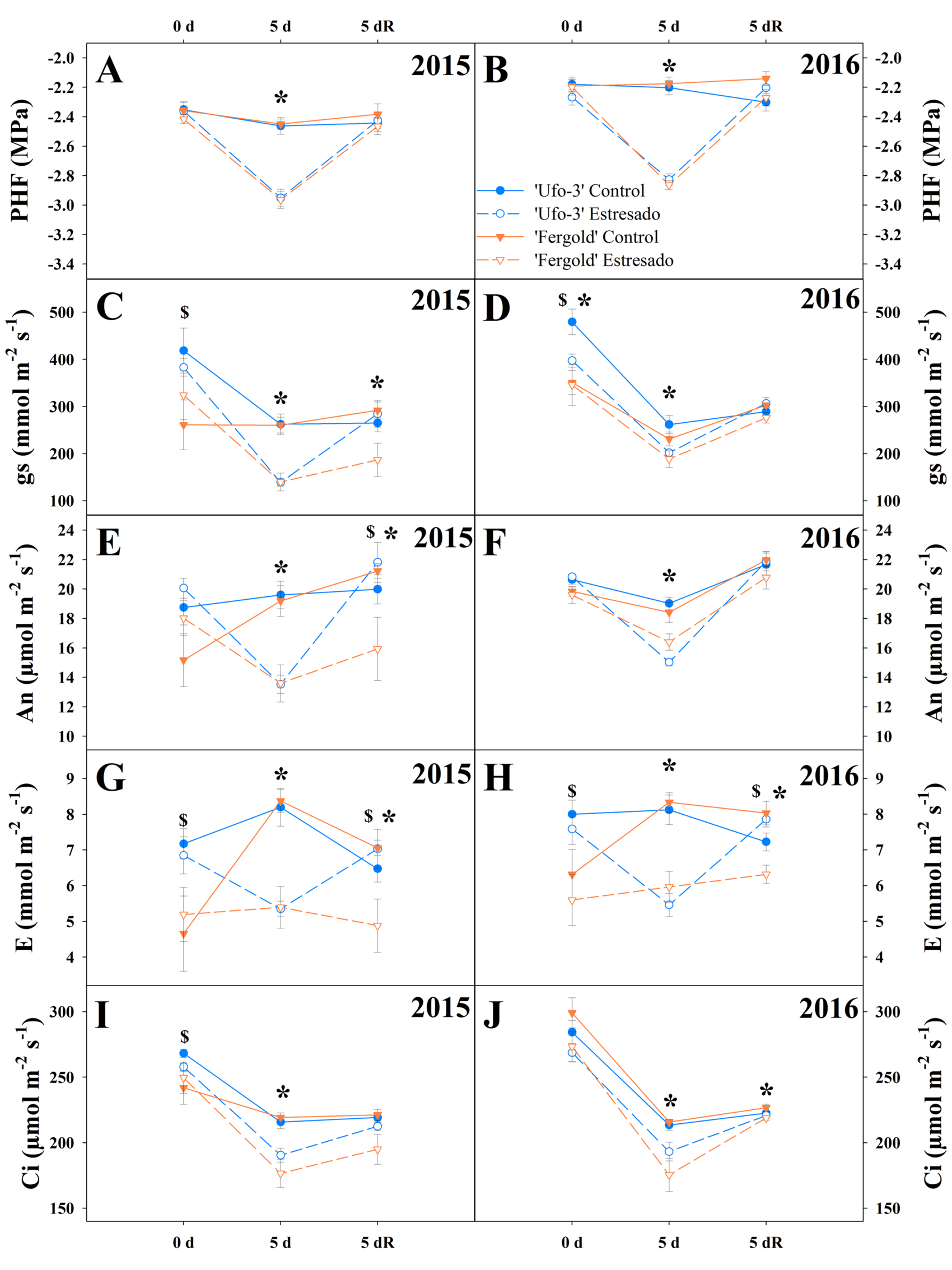
Figura 2. Evolución del (A y B) potencial hídrico foliar al mediodía (PHF), (C y D) conductancia estomática (gs), (E y F) fotosíntesis neta (An), (G y H) transpiración (E) e (I y J) concentración de CO2 intracelular (Ci) durante el experimento de sequía en los años 2015 y 2016. Las barras de error representan el error estándar de la media. *: diferencias significativas (p = 0,05) entre tratamientos para cada punto temporal del experimento según la prueba t de Student; $: diferencias significativas (p = 0,05) entre cultivares para cada punto temporal del experimento según la prueba t de Student. d = día; R = recuperación.
La restauración del riego en los árboles estresados aumentó el CHS en ambos años (Figura 1). Asimismo, el PHF de los árboles estresados alcanzó valores semejantes a los registrados por su control en ambos años (Figura 2A y B). Una tendencia similar de disminución en los valores de PHF también ha sido descrita en estudios anteriores llevados a cabo tanto en almendro, como en otros híbridos de Prunus (Isaakidis et al., 2004; Yadollahi et al., 2011), y también en melocotonero sobre 'GF-677' (Mellisho et al., 2011).
Efectos del estrés por sequía en el intercambio gaseoso
La ausencia de riego provocó diferencias en el intercambio gaseoso de los árboles. Se observó un descenso significativo en los valores de conductancia estomática (gs), fotosíntesis neta (An), transpiración (E) y concentración de CO2 intercelular (Ci) a los 5 días de estrés hídrico (Figura 2). La caída del PHF por la escasez de agua provoca un fallo hidráulico como consecuencia de un probable embolismo inducido en vasos de xilema (Brodribb et al., 2016). Para evitar este fallo, la planta es capaz de regular el cierre estomático, provocando cambios en el intercambio gaseoso, controlando así las pérdidas de agua y llevando a la planta a un ajuste osmótico (Jones y Sutherland, 1991). Por tanto, la planta es capaz de adaptarse a las nuevas condiciones desfavorables de estrés. Los árboles estresados, para mantener sus reservas hídricas, cerraron sus estomas, provocando la caída de gs (Figura 2C y D). De la misma manera, el flujo de CO2 se vio restringido, causando una reducción en E (Figura 2G y H) y limitando también los procesos fotosintéticos, reflejados en el descenso de An (Figura 2E y F) (Verslues et al., 2006). Resultados similares han sido encontrados en estudios anteriores en los que diferentes especies de Prunus como almendro (Isaakidis et al., 2004; Romero et al., 2004; Espadafor et al., 2017), melocotonero (Mellisho et al., 2011; Rickes et al., 2017) y patrones híbridos de Prunus (Martinazzo et al., 2011; Jiménez et al., 2013) sometidos a estrés hídrico a largo plazo han mostrado un descenso significativo en los parámetros estudiados relacionados con el intercambio gaseoso.
Pasados los 5 días tras el restablecimiento del sistema de riego en el grupo estresado, tanto el estado hídrico como las tasas de intercambio gaseoso alcanzaron valores similares que los árboles del grupo control, a excepción de los valores de gs, An y E en 'Fergold' (Figura 2C, E, G y H). Las diferencias encontradas en los valores de gs, An y E en el día 5 de recuperación entre los árboles control y estresados de ‘Fergold’ podría indicar un daño irreversible en el aparato fotosintético durante el periodo de estrés, el cual no le permitiría recuperar la absorción de CO2 de la misma manera que a 'Ufo-3' (Romero et al., 2004). La mejor recuperación del estado hídrico, así como de sus funciones fotosintéticas en el cultivar 'Ufo-3' injertado sobre ‘Garnem’ con respecto a 'Fergold', representaría una estrategia de tolerancia al estrés seguida por este cultivar como respuesta a sequía. La falta de recuperación inmediata en las tasas de intercambio gaseoso también fue observada en almendro sometido a sequía en condiciones de campo, donde a los 15 días de recuperación los valores de gs, E y An seguían por debajo de los valores control (Romero et al., 2004).
Las diferencias significativas observadas en los árboles control en ambos años, pero más evidentes en el primer año (Figura 2), sugieren que existen otros factores que afectan al estado hídrico de la planta. Entre ellos destacan condiciones ambientales como temperatura, luz, humedad y CO2, además del papel de diferentes fitohormonas en la regulación de procesos como el cierre estomático, generando cambios en los mecanismos de transpiración y fotosíntesis (Assmann y Shimazaki, 1999), y de aspectos morfológicos como la dimensión de la copa del árbol y la carga de frutos de cada cultivar. Sin embargo, aunque las tasas de intercambio gaseoso de estos árboles control no se mantuvieron estables durante el experimento, sí permanecieron por encima de los valores alcanzados por los árboles estresados (Figura 2). Por otra parte, cabe destacar que al evaluar el posible efecto del año (posible efecto debido a la distinta fecha de realización del experimento en cada año) en las diferentes variables analizadas, se comprobó que este no fue significativo y, por tanto, no explicaría las diferencias encontradas en el intercambio gaseoso de los árboles control.
Al analizar la relación An/gs entendida como uso eficiente del agua intrínseco (UEAi), se observó que el UEAi en 2015 fue significativamente mayor en los árboles estresados (97,13%) que en los control (74,13%) a los 5 días de estrés (Figura 3A). Sin embargo, en 2016 no se encontraron diferencias significativas entre tratamientos después de 5 días sin riego, momento en que el ratio de UEAi alcanzó valores de 76,19% en los árboles control y de 80,69% en los árboles estresados (Figura 3B). Los árboles con disponibilidad de agua no necesitan regular sus recursos. En condiciones ambientales adversas, en lugar de cerrar sus estomas para conservar sus reservas hídricas, los mantienen abiertos continuando con su actividad fotosintética, a expensas del gasto hídrico en la transpiración, lo que se traduce en un efecto negativo en su UEA. En cambio, los árboles sin recursos hídricos en este estudio, a pesar de disminuir su PHF, trataron de hacer más eficiente su reserva hídrica mediante el cierre de estomas y evitar las pérdidas por transpiración, a costa de reducir su capacidad fotosintética (Figuras 1 y 2) y, por tanto, aumentado su UEAi (Figura 3). Este tipo de comportamiento es propio de plantas con una estrategia de tolerancia a la sequía (Blum, 2009). Estos resultados coinciden con estudios previos en vid (Medrano et al., 2015) y en diferentes patrones de Prunus (Jiménez et al., 2013).
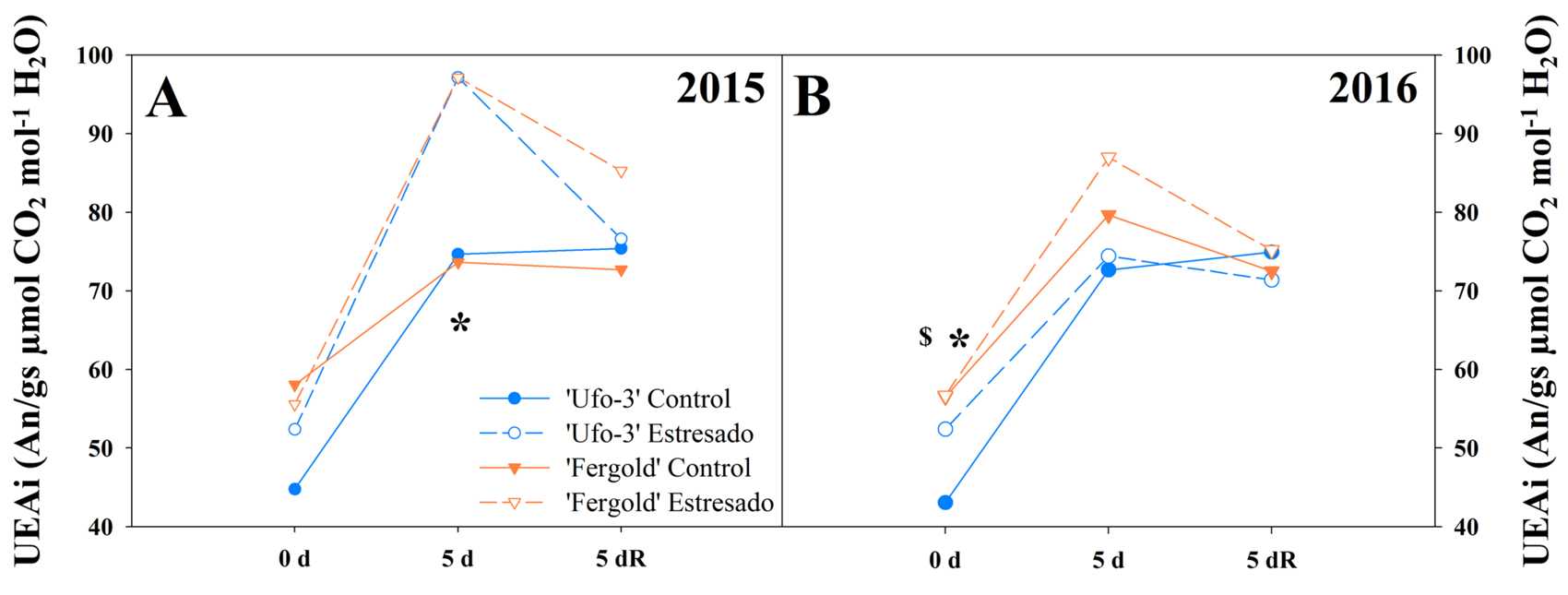
Acumulación de ácido abscísico (ABA) foliar durante el estrés
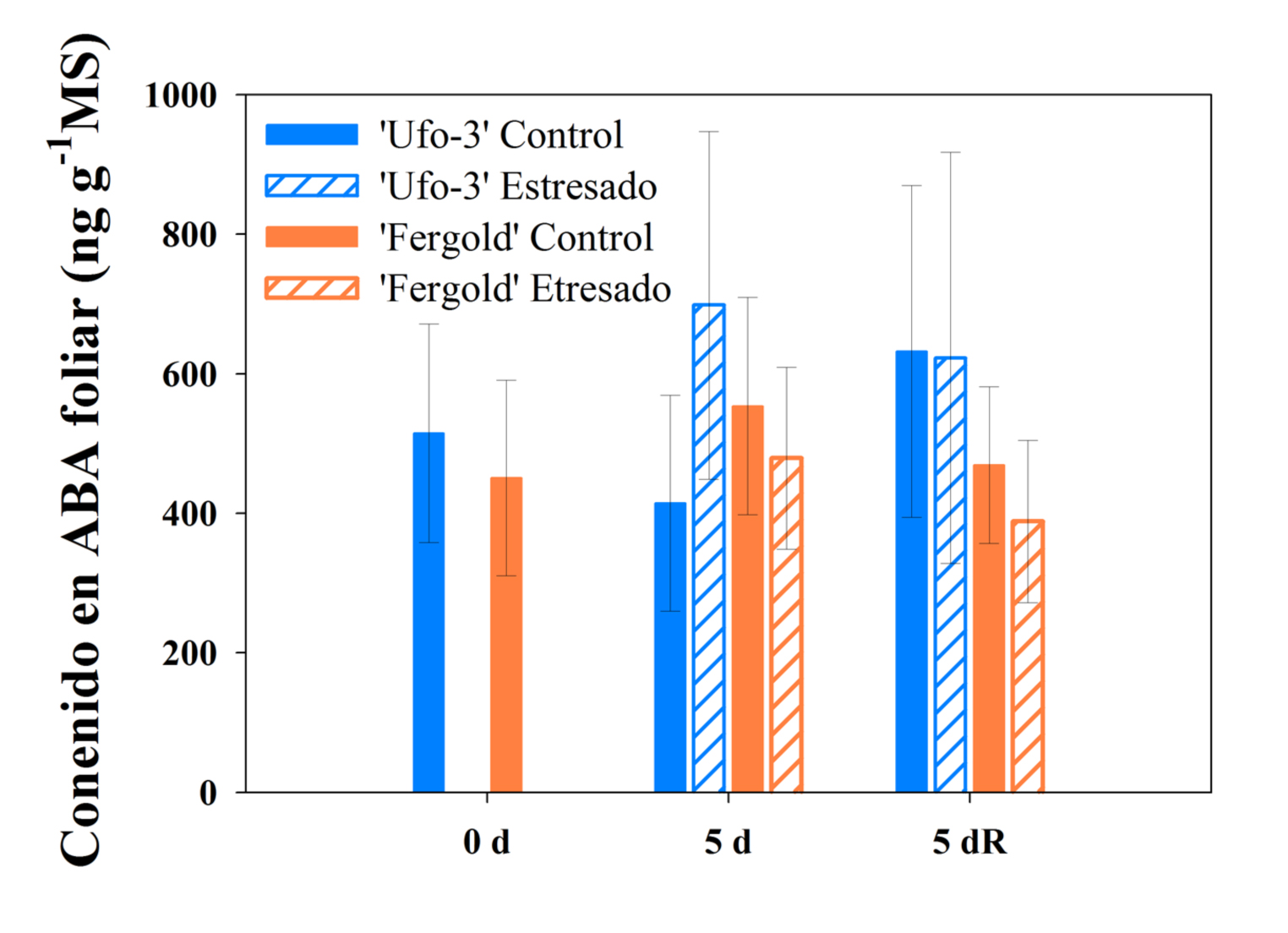
En nuestro estudio, observamos niveles de ABA altos en los árboles control a lo largo de todo el experimento (Figura 4), los cuales podrían deberse a los bajos valores de PHF presentes en estos árboles control (Figura 2A y B). Sin embargo, este contenido en ABA foliar no estaría implicado en la regulación del cierre estomático ya que este no se dio. Hecho confirmado con los valores encontrados en las tasas de intercambio gaseoso (Figura 2C-J). Las diferencias entre las concentraciones de ABA entre los árboles control y los estresados no fueron significativas (Figura 4), sugiriendo que el nivel de estrés experimentado durante los 5 días sin riego no fue percibido como severo por los árboles estresados. Son numerosos los estudios realizados hasta el momento en cuanto a la relación entre el contenido en ABA y la respuesta a estrés por sequía en diferentes especies (Forner-Giner et al., 2011; Seiler et al., 2014; Zandalinas et al., 2016). Sin embargo, la mayoría de ellos se han llevado a cabo con plantas en maceta y condiciones controladas en invernadero, no en campo. Los resultados obtenidos en nuestro estudio en relación al contenido de ABA sugieren una clara diferencia en el comportamiento en función de las condiciones de cultivo y ambientales, maceta en invernadero frente a árboles en campo. Un entorno seco y árido como la región de Murcia, donde los árboles con suministro de agua alcanzaron valores de PHF ya cercanos a –2 MPa (Figura 2A y B), crea una respuesta fisiológica rápida en árboles sin disponibilidad de agua, pero un periodo de 5 días sin riego no es suficiente para desencadenar una respuesta bioquímica en la que esté implicado el ABA.
Conclusiones
Los dos cultivares de melocotonero, 'Ufo-3' y 'Fergold' injertados sobre el híbrido 'Garnem', bajo condiciones de campo y sin riego durante 5 días, pusieron en marcha diversos mecanismos de respuesta fisiológica que permitieron realizar una estrategia de evitación a la sequía. Esta respuesta se ve reflejada en los bajos valores de potencial hídrico foliar (PHF) y las bajas tasas de intercambio gaseoso encontradas. Todo ello tiene como consecuencia que estos árboles estresados sean capaces de realizar un ajuste osmótico, que permitió preservar la homeostasis de las células. Así, los árboles estresados fueron capaces de dar un uso más eficiente a la escasa reserva hídrica que poseía el suelo. Con todo ello, se puede afirmar que los dos cultivares mostraron adaptabilidad a la sequía resultante de su estrategia de evitación. Cabe señalar que debido a la menor capacidad fotosintética observada en 'Fergold' una vez restaurado el riego, se puede considerar que esta adaptabilidad es mayor en el cultivar 'Ufo-3'. La falta de variabilidad encontrada en el contenido de ácido abscísico (ABA) foliar de los árboles estresados frente al contenido de ABA en los árboles control, ponen de manifiesto que el ABA no estuvo implicado en la regulación estomática llevada a cabo por los árboles estresados.
Agradecimientos
Este estudio ha sido subvencionado por el Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (RTA2014-00062). B. Bielsa fue beneficiaria de una beca predoctoral FPI-INIA.
Referencias bibliográficas
- Arndt SK, Wanek W, Clifford SC, Popp M (2000). Contrasting adaptations to drought stress in field-grown Ziziphus mauritiana and Prunus persica trees: water relations, osmotic adjustment and carbon isotope composition. Australian Journal of Plant Phisiology 27: 985-996. https://doi.org/10.1071/PP00022
- Assmann SM, Shimazaki K (1999). The multisensory guard cell. Stomatal responses to blue light and abscisic acid. Plant Physiology 119(3): 809-815. https://doi.org/10.1104/pp.119.3.809
- Bielsa B, Leida C, Rubio-Cabetas MJ (2016). Physiological characterization of drought stress response and expression of two transcription factors and two LEA genes in three Prunus genotypes. Scientia Horticulturae 213:260-269. https://doi.org/10.1016/j.scienta.2016.11.006
- Bielsa B, Hewitt S, Reyes-chin-wo S, Dhingra A, Rubio-Cabetas MJ (2018b). Identification of water use efficiency related genes in ‘Garnem’ almond-peach rootstock using time-course transcriptome analysis. PLoS One 13(10): e0205493. https://doi.org/10.1371/journal.pone.0205493.
- Blum A (2009). Effective use of water (EUW) and not water-use efficiency (WUE) is the target of crop yield improvement under drought stress. Field Crops Research 112(2-3): 119-123. https://doi.org/10.1016/j.fcr.2009.03.009
- Blum A (2016). Stress, strain, signaling, and adaptation - Not just a matter of definition. Journal of Experimental Botany 67(3): 562-565. https://doi.org/10.1093/jxb/erv497
- Brodribb TJ, Bienaimé D, Marmottant P (2016). Revealing catastrophic failure of leaf networks under stress. Proceedings of the National Academy of Sciences 113(17): 4865-4869. https://doi.org/10.1073/pnas.1522569113
- Espadafor M, González-Dugo V, Orgaz F, Testi L, López M, Fereres E (2017). Water relations in almond trees under moderate water deficits. Acta Horticulturae 1150: 113-118. https://doi.org/10.1093/aob/mcn125
- FAOSTAT (2018). Food and Agriculture Organization of the United Nations Statistics Division. Disponible en: http://www.fao.org/faostat/en/#data/QC (Consultado: 4 junio 2018)
- Felipe AJ (2009). ‘Felinem’, ‘Garnem’, and ‘Monegro’ almond × peach hybrid rootstocks. HortScience 44(1): 196-197. https://doi.org/10.21273/HORTSCI.44.1.196
- Forner-Giner MA, Rodríguez-Gamir J, Primo-Millo E, Iglesias DJ (2011). Hydraulic and Chemical Responses of Citrus Seedlings to Drought and Osmotic Stress. Journal of Plant Growth Regulation 30(3): 353-366. https://doi.org/10.1007/s00344-011-9197-9
- Gómez-Cadenas A, Pozo OJ, García-Augustín P, Sancho JV (2002). Direct analysis of abscisic acid in crude plant extracts by liquid chromatography-electrospray/tandem mass
- Isaakidis A, Sotiropoulos T, Almaliotis D, Therios I, Stylianidis D (2004). Response to severe water stress of the almond (Prunus amygdalus) ‘Ferragnès’ grafted on eight rootstocks. New Zealand Journal of Crop and Horticultural Science 32(4): 355-362. https://doi.org/10.1080/01140671.2004.9514316
- Jiménez S, Dridi J, Gutiérrez D, Moret D, Irigoyen JJ, Moreno MA, Gogorcena Y (2013). Physiological, biochemical and molecular responses in four Prunus rootstocks submitted to drought stress. Tree physiology 33(10): 1061-1075. https://doi.org/10.1093/treephys/tpt074
- Jones HG, Sutherland RA (1991). Stomatal control of xylem embolism. Plant, Cell and Environment 14(6): 607-612. https://doi.org/10.1111/j.1365-3040.1991.tb01532.x
- MAPA (2019). Anuario de Estadística. Avance 2018. Disponible en: https://www.mapa.gob.es/estadistica/pags/anuario/2018-Avance/avance/AvAE18.pdf (Consultado: 15 julio 2019)
- Martinazzo EG, Perboni AT, Farias ME, Bianchi VJ, Bacarin MA (2011). Photosynthetic activity in the rootstock of hybrid peach trees submitted to water restriction and flooding. Brazilian Journal of Plant Physiology 23(3): 231-236. http://dx.doi.org/10.1590/S1677-04202011000300007
- Medrano H, Tomás M, Martorell S, Flexas J, Hernández E, Rosselló J, Pou A, Escalona JM, Bota J (2015). From leaf to whole-plant water use efficiency (WUE) in complex canopies: Limitations of leaf WUE as a selection target. The Crop Journal 3(3): 220-228. https://doi.org/10.1016/j.cj.2015.04.002
- Mellisho CD, Cruz ZN, Conejero W, Ortuño MF, Rodríguez P (2011). Mechanisms for drought resistance in early maturing cvar Flordastar peach trees. The Journal of Agricultural Science 149(5): 609-616. https://doi.org/10.1017/S0021859611000141
- Rickes LN, Klumb EK, Silva CDS, Bacarin MA, Bianchi VJ (2017). Water deficit affects gas exchange in peach trees cultivar ‘Chimarrita’ grafted onto different rootstocks. Irriga 22(1): 140-153. https://doi.org/10.15809/irriga.2017v22n1p140-153
- Romero P, Navarro JM, García F, Botía Ordaz P (2004). Effects of regulated deficit irrigation during the pre-harvest period on gas exchange, leaf development and crop yield of mature almond trees. Tree Physiology 24(3): 303-312. https://doi.org/10.1093/treephys/24.3.303
- Romero P, Botía P (2006). Daily and seasonal patterns of leaf water relations and gas exchange of regulated deficit-irrigated almond trees under semiarid conditions. Environmental and Experimental Botany 56(2): 158-173. https://doi.org/10.1016/j.envexpbot.2005.01.012
- Seiler C, Harshavardhan VT, Reddy PS, Hensel G, Kumlehn J, Eschen-Lippold L, Rajesh K, Korzun V, Wobus U, Lee J, Selvaraj G, Sreenivasulu N (2014). Abscisic acid flux alterations result in differential abscisic acid signaling responses and impact assimilation efficiency in barley under terminal drought stress. Plant Physiology 164(4): 1677-16796. https://doi.org/10.1104/pp.113.229062
- Timm LC, Tavares VEQ, Reisser C, Moro M (2007). Manejo de irrigação na cultura de pessegueiro: manual técnico. Ed. Universidade Federal de Pelotas. Pelotas, Brazil. 110 pp.
- Verslues PE, Agarwal M, Katiyar-Agarwal S, Zhu J, Zhu J-K (2006). Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. The Plant Journal 45(4): 523-39. https://doi.org/10.1111/j.1365-313X.2005.02593.x
- Yadollahi A, Arzani K, Ebadi A, Wirthensohn M, Karimi S (2011). The response of different almond genotypes to moderate and severe water stress in order to screen for drought tolerance. Scientia Horticulturae 129:403–413. https://doi.org/10.1016/j.scienta.2011.04.007
- Zandalinas SI, Rivero RM, Martínez V, Gómez-Cadenas A, ArbonaV (2016). Tolerance of citrus plants to the combination of high temperatures and drought is associated to the increase in transpiration modulated by a reduction in abscisic acid levels. BMC Plant Biology 16(1): 105. https://doi.org/10.1186/s12870-016-0791-7