Regulación del sistema de percepción del ácido abscísico (ABA) durante la deshidratación poscosecha de los frutos cítricos
Introducción
El ABA juega un papel crucial en el cierre estomático y, por tanto, es clave en el control de la pérdida de agua (Shinozaki and Yamaguchi-Shinozaki, 2007) en frutos, como los cítricos, que contienen un elevado número de estomas en las capas externas de la piel. De hecho, Romero et al. (2012b) demostraron que tanto rutas dependientes como independientes de ABA intervienen en la respuesta a la deshidratación postcosecha de los frutos cítricos. La obtención de mutantes artificiales de frutos en plantas leñosas es escasa. Por eso, el acceso a mutantes espontáneos es de un especial interés científico en este tipo de plantas. Distintos trabajos han tratado de entender los mecanismos fisiológicos (Alférez et al., 2005; Sala et al., 2005) y moleculares (Romero et al., 2012b) que vinculan el ABA y la deshidratación en frutos de Citrus haciendo uso de un mutante espontáneo específico de fruto y deficiente en ABA de la naranja ‘Navelate’ (Citrus sinensis L. Osbeck), llamado ‘Pinalate’ (Figura 1). Los frutos de este mutante presentan un bloqueo parcial en la ruta de biosíntesis de carotenoides, causando una coloración amarilla y una deficiencia en ABA específica de fruto (Rodrigo et al., 2003).

Materiales y métodos
Resultados y discusión
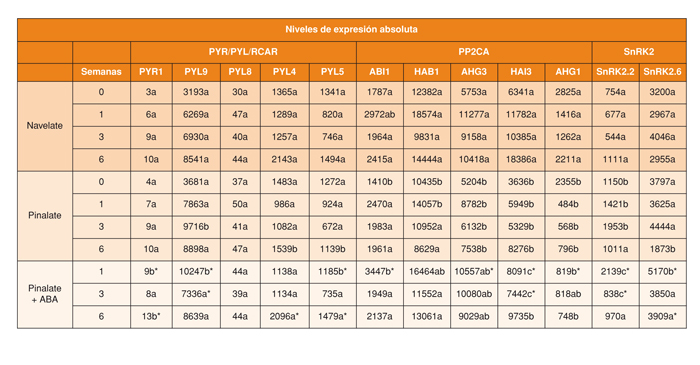
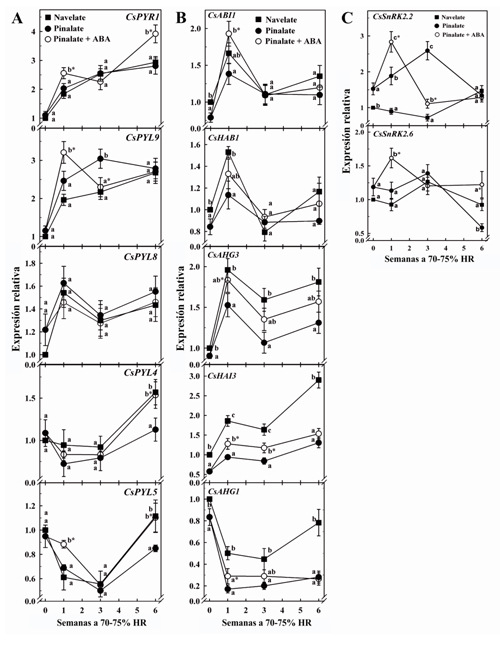
Los resultados indican que la expresión de algunos de los elementos del signalosoma de ABA están diferencialmente regulados en el flavedo de los frutos cosechados de ambos cultivares sometidos a estrés hídrico, lo que puede estar relacionado con la menor capacidad de los frutos del mutante para incrementar los niveles endógenos de ABA cuando se almacenan a 70-75% HR y/o con su mayor susceptibilidad a la deshidratación (Figura 2). Así, aunque sólo se encontraron pequeñas diferencias en la expresión de los receptores de ABA (CsPYR/PYL/RCARs) entre los frutos de ‘Navelate’ y ‘Pinalate’ en respuesta a la deshidratación para el mismo periodo de almacenamiento (Figura 3A), las diferencias en la expresión de los reguladores negativos (CsPP2CAs) fueron relevantes (Figura 3B).
Esto concuerda con observaciones previas que mostraban que la diferente capacidad de ambos cultivares para incrementar los niveles de ABA durante la maduración del frutos tenía poco efecto sobre la expresión de los reguladores positivos (CsPYR/PYL/RCARs and CsSnRK2s) de la ruta de señalización del ABA (Romero et al., 2012a). También es importante señalar que se observaron pocos cambios en la regulación de los receptores de ABA y las proteínas quinasas entre hojas de cítricos no estresadas y hojas sometidas a deshidratación severa que causaron un incremento de 15 veces en el contenido de ABA y una pérdida de peso del 20% (Romero et al., 2012a). Así pues, los resultados del presente trabajo apoyan la idea de que la expresión de los genes PYR/PYL/RCAR apenas se afectan por el contenido endógeno de ABA en ‘Citrus’, independientemente del tejido y de las condiciones fisiológicas o de estrés examinadas.
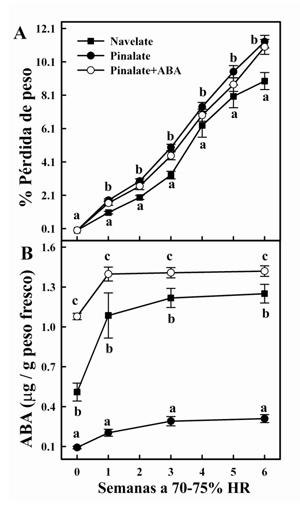
Las diferencias en los niveles de expresión de los genes CsPP2CAs entre los frutos de ‘Navelate’ y ‘Pinalate’ en respuesta a la deshidratación fueron relevantes, lo que concuerda con el hecho de que estos genes funcionan como reguladores negativos de la ruta de señalización del ABA y son altamente inducidos en respuesta a la hormona en plantas (Merlot et al., 2001; Saez et al., 2004; Li et al., 2009). Así, encontramos que el estrés hídrico moderado es capaz de inducir la expresión génica de las CsPP2CAs en los frutos de ‘Navelate’ y ‘Pinalate’ con la acumulación de ABA (Figura 2B), lo que está de acuerdo con resultados previos en hojas de Arabidopsis y tomate, y también con los cambios observados en la expresión de estos genes en frutos de fresa y tomate durante la maduración (Szostkiewicz et al., 2010; Chai et al., 2011; Sun et al., 2011). Como ocurrió durante la maduración del fruto (Romero et al., 2012a), todas las CsPP2CAs, excepto CsAHG1, siguieron un patrón de expresión similar en los frutos de ambos cultivares durante la deshidratación moderada (Figura 3B), aunque los niveles absolutos de transcritos en el mutante deficiente en ABA fueron significativamente menores a los observados en los frutos de la línea parental (Tabla 1). Del mismo modo, las hojas no deshidratadas mostraron patrones de expresión en las CsPP2CAs muy similares a los de las hojas estresadas, aunque la acumulación de transcritos fue inferior en las hojas control, lo que puede estar asociado a sus menores niveles de ABA (Romero et al., 2012a). Así pues, la expresión de las CsPP2CAs parece estar estrechamente regulada por los niveles endógenos de ABA bajo condiciones fisiológicas y de estrés, independientemente del tejido y de la severidad del estrés impuesto.
En resumen, los resultados de este trabajo exponen por primera vez la regulación transcripcional de los componentes del signalosoma de ABA en frutos sometidos a condiciones de estrés hídrico. Las diferencias en los niveles de transcritos de los receptores de ABA y las proteínas quinasas entre los frutos de ‘Navelate’ y su mutante deficiente en ABA ‘Pinalate’ en respuesta a la deshidratación son poco relevantes. Sin embargo, la expresión génica de las CsPP2CAs fue sustancialmente regulada por el contenido en ABA y mostró diferencias significativas entre ambas variedades. Además, los resultados indican que la regulación transcripcional de los receptores de ABA y las proteínas quinasas podría estar diferencialmente afectada por la especificidad de tejido, la severidad del estrés y la procedencia de la señal de ABA desde un estímulo de desarrollo o de estrés. En cambio, las CsPP2CAs, reguladores negativos de la ruta, han mostrado una respuesta consistente en todas las condiciones y tejidos ensayados, lo que sugiere que estos componentes son posibles dianas para mejorar la tolerancia a la deshidratación en cítricos.
Agradecemos al Dr. Luis Navarro (IVIA) que nos permitiera el uso del Banco de Germoplasma de Cítricos. Este trabajo ha sido financiado por el Ministerio de Ciencia y Tecnología (AGL2006-09496, AGL2009-11969 y AGL2009-11558) y por la Generalitat Valenciana (PROMETEO/2010/010). P. Romero es receptor de una beca FPI del Ministerio de Ciencia y Tecnología.
- Alférez, F., Lluch, Y., Burns, J.K., 2008. Phospholipase A2 and postharvest peel pitting in citrus fruit. Postharvest Biol. Technol. 49, 69-76.-
- Alférez, F., Sala, J.M., Sánchez-Ballesta, M.T., Mulas, M., Lafuente, M.T., Zacarías, L., 2005. A comparative study of the postharvest performance of an - ABA-deficient mutant of oranges: I. Physiological and quality aspects. Postharvest Biol. Technol. 37, 222-231.
- Chai, Y.M., Jia, H.F., Li, C.L., Dong, Q.H., Shen, Y.Y., 2011. FaPYR1 is involved in strawberry fruit ripening. J. Exp. Bot. 62, 5079-5089.
- Deluc, L., Quilici, D., Decendit, A., Grimplet, J., Wheatley, M., Schlauch, K., Merillon, J.M., Cushman, J., Cramer, G., 2009. Water deficit alters differentially metabolic pathways affecting important flavor and quality traits in grape berries of Cabernet Sauvignon and Chardonnay. BMC Genomics 10, 212.
- Kim, H., Hwang, H., Hong, J.W., Lee, Y.N., Ahn, I.P., Yoon, I.S., Yoo, S.D., Lee, S., Lee, S.C., Kim, B.G., 2012. A rice orthologue of the ABA receptor, OsPYL/RCAR5, is a positive regulator of the ABA signal transduction pathway in seed germination and early seedling growth. J. Exp. Bot. 63, 1013-1024.
- Lafuente, M.T., Martínez-Téllez, M.A., Zacarías, L., 1997. Abscisic acid in the response of 'Fortune' mandarins to chilling. Effect of maturity and high-temperature conditioning. J. Sci. Food Agric. 73, 494-502.
- Li, F.H., Fu, F.L., Sha, L.N., He, L., Li, W.C., 2009. Differential expression of serine/threonine protein phosphatase type-2C under drought stress in maize. Plant Mol. Biol. Rep. 27, 29-37.
- Li, G., Xin, H., Zheng, X.F., Li, S., Hu, Z., 2012. Identification of the abscisic acid receptor VvPYL1 in Vitis vinifera. Plant Biology 14, 244-248.
- Ma, Y., Szostkiewicz, I., Korte, A., Moes, D., Yang, Y., Alexander, C., Grill, E., 2009. Regulators of PP2C phosphatase activity function as abscisic acid sensors. Science 324, 1064-1068.
- Merlot, S., Gosti, F., Guerrier, D., Vavasseur, A., Giraudat, J., 2001. The ABI1 and ABI2 protein phosphatases 2C act in a negative feedback regulatory loop of the abscisic acid signalling pathway. Plant J. 25, 295-303.
- Nishimura, N. et al., 2010. PYR/PYL/RCAR family members are major in-vivo ABI1 protein phosphatase 2C-interacting proteins in Arabidopsis. Plant J. 61, 290-299.
- Park, S.Y. et al., 2009. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins. Science 324, 1068-1071.
- Rodrigo, M.J., Marcos, J.F., Alférez, F., Mallent, M.D., Zacarías, L., 2003. Characterization of 'Pinalate', a novel Citrus sinensis mutant with a fruit-specific alteration that results in yellow pigmentation and decreased ABA content. J. Exp. Bot. 54, 727-738.
- Romero, P., Lafuente, M.T., Rodrigo, M.J., 2012a. The Citrus ABA signalosome: Identification and transcriptional regulation during sweet orange fruit ripening and leaf dehydration. J. Exp. Bot. 63, 4931-4945.
- Romero, P., Rodrigo, M.J., Alférez, F., Ballester, A.R., González-Candelas, L., Zacarías, L., Lafuente, M.T., 2012b. Unravelling molecular responses to moderate dehydration in harvested fruit of sweet orange (Citrus sinensis L. Osbeck) using a fruit-specific ABA-deficient mutant. J. Exp. Bot. 63, 2753-2767.
- Saez, A., Apostolova, N., González-Guzman, M., González-García, M.P., Nicolas, C., Lorenzo, O., Rodríguez, P.L., 2004. Gain-of-function and loss-of-function phenotypes of the protein phosphatase 2C HAB1 reveal its role as a negative regulator of abscisic acid signalling. Plant J. 37, 354-369.
- Sala J.M., Sánchez-Ballesta M.T., Alférez F., Mulas M., Zacarías L., Lafuente M.T. 2005. A comparative study of the postharvest performance of an ABA-deficient mutant of oranges. II. Antioxidant enzymatic system and phenylalanine ammonia-lyase in non-chilling and chilling peel disorders of citrus fruit. Postharvest Biology and Technology 37, 232-240.
- Santiago, J., Rodrigues, A., Saez, A., Rubio, S., Antoni, R., Dupeux, F., Park, S.Y., Márquez, J.A., Cutler, S.R., Rodríguez, P.L., 2009. Modulation of drought resistance by the abscisic acid receptor PYL5 through inhibition of clade A PP2Cs. Plant J. 60, 575-588.
- Shinozaki, K., Yamaguchi-Shinozaki, K., 2007. Gene networks involved in drought stress response and tolerance. J. Exp. Bot. 58, 221-227.
- Sun, L., Wang, Y.P., Chen, P., Ren, J., Ji, K., Li, Q., Li, P., Dai, S.J., Leng, P., 2011. Transcriptional regulation of SlPYL, SlPP2C, and SlSnRK2 gene families encoding ABA signal core components during tomato fruit development and drought stress. J. Exp. Bot. 62, 5659-5669.
- Szostkiewicz, I., Richter, K., Kepka, M., Demmel, S., Ma, Y., Korte, A., Assaad, F.F., Christmann, A., Grill, E., 2010. Closely related receptor complexes differ in their ABA selectivity and sensitivity. Plant J. 61, 25-35.
- Umezawa, T., Sugiyama, N., Mizoguchi, M., Hayashi, S., Myouga, F., Yamaguchi-Shinozaki, K., Ishihama, Y., Hirayama, T., Shinozaki, K., 2009. Type 2C protein phosphatases directly regulate abscisic acid-activated protein kinases in Arabidopsis. PNAS 106, 17588-17593.