Alternativas de prevención y control de la enfermedad de Glässer
Se lleva a cabo un repaso de la enfermedad de Glässer, aportando información sobre la bacteria causante (Glaesserella parasuis), sus serotipos, principales factores de virulencia, diagnóstico, tratamiento y medidas de prevención y control. Se enumeran los principales tipos de vacunas estudiadas frente a la enfermedad y se concluye que en la actualidad no se dispone de ninguna vacuna eficaz que proteja con garantías frente a la enfermedad de Glässer.
Desde finales del siglo pasado, muchas enfermedades infecciosas ya no se entienden como producidas por un único microorganismo sino que se alude a complejos multifactoriales que contribuyen a su desencadenamiento, no solo por la acción de los diversos agentes etiológicos microbianos, sino también por efecto de los factores ambientales, la alimentación, la respuesta inmunitaria o la propia genética porcina. Este es el caso del “Complejo Respiratorio Porcino” (CRP), una de las enfermedades polimicrobianas más relevantes, en la que se implican diferentes virus (el virus del síndrome respiratorio y reproductor porcino, el virus influenza, el virus de la enfermedad de Aujeszky, el coronavirus respiratorio y el circovirus) y bacterias (Mycoplasma hyopneumoniae, M. hyorhinis, Bordetella bronchiseptica, Actinobacillus pleuropneumoniae, Pasteurella multocida, Streptococcus suis o Glaeserella parasuis).
Entre sus agentes patógenos secundarios bacterianos se sitúa Glaesserella parasuis, que, aunque es un comensal de las tonsilas y la cavidad nasal de los cerdos (coloniza rápidamente los lechones recién nacidos a partir de sus madres), puede sin embargo sufrir una difusión sistémica, lo que podría desencadenar cuadros septicémicos. Esta circunstancia suele relacionarse con situaciones de estrés: la mezcla de cerdos de edades y procedencias diferentes, una densidad elevada de animales en las explotaciones, un destete precoz o unas condiciones higiénicas deficientes, entre otros factores determinantes.
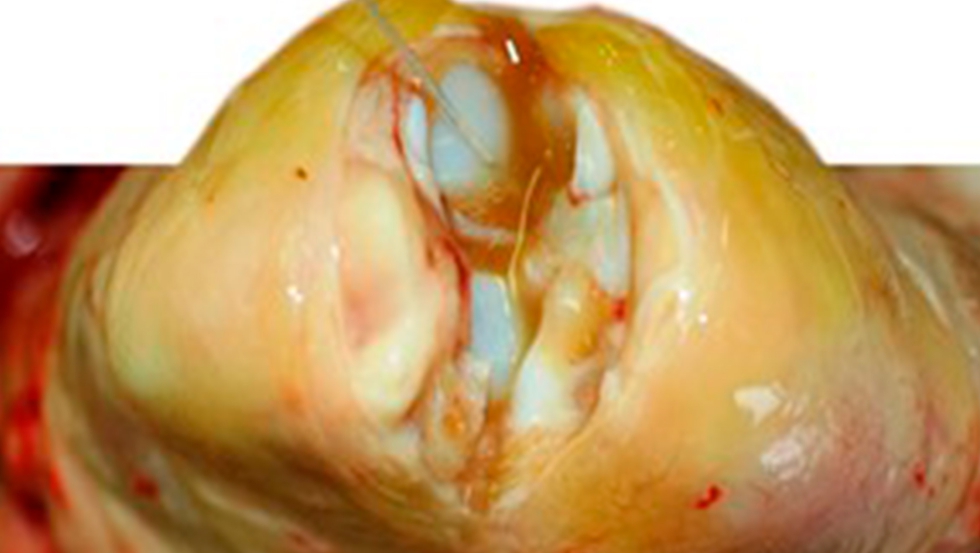
La enfermedad de Glässer se define como un proceso septicémico grave, que cursa con poliserositis fibrinosa, con lesiones distribuidas por todo el organismo (foto 1), pero principalmente en el cerebro (meningitis purulenta), en el aparato respiratorio (rinitis y bronconeumonía), en el aparato digestivo (inflamación y de hemorragias en diferentes tramos) y en el aparato locomotor (inflamación fibrinosa de las articulaciones, (foto 2)).

Origina graves pérdidas económicas en el sector intensivo, con menor presencia en el extensivo. Está producida por un cocobacilo de la familia Pasteurellaceae, negativo a la tinción de Gram e inmóvil. En el laboratorio, G. parasuis no crece en los medios de cultivo generales, sino que debe recurrirse a un enriquecimiento con el factor V sanguíneo, lo que se consigue habitualmente trabajando sobre ágar chocolate. En los aislamientos primarios, debe cultivarse en condiciones de microaerofilia, durante 48 horas. Se puede demostrar su dependencia del factor V mediante el satelitismo que se produce cuando la bacteria crece únicamente alrededor de una estría de una cepa nodriza de estafilococo. Se han descrito 15 serotipos y un número elevado de aislados que no han podido ser tipificados. Dentro de un mismo serotipo conviven cepas de virulencia muy diferente, desde las dotadas de una gran virulencia hasta las avirulentas. Por ello, el concepto de serotipo se encuentra en franco retroceso y se ha optado por el más preciso de patotipo. Con todo, los aislados adscritos al serotipo 5 suelen relacionarse con brotes graves de enfermedad.
Factores de virulencia, diagnóstico y tratamiento de la enfermedad de Glässer
Como en cualquier enfermedad infecciosa, su gravedad depende de la triada básica: características del microorganismo, respuesta inmunitaria del hospedador y factores ambientales de cada explotación. Respecto a la especificidad de hospedador de la bacteria, el cerdo fue considerado el único conocido hasta 2007, cuando se aisló por primera vez del jabalí, una especie sinantrópica cada vez más frecuente en nuestras áreas metropolitanas.
El esclarecimiento de los factores de virulencia de G. parasuis continúa siendo uno de los “talones de Aquiles” de esta bacteria y de la enfermedad que ocasiona, porque sigue sin tenerse una información exhaustiva acerca de ellos. Se sabe que la bacteria coloniza mediante la adherencia e invasión de las células epiteliales, que puede evadir la inmunidad de las mucosas mediante la degradación de las IgAs allí fijadas y que resiste la fagocitosis ejercida por los macrófagos y neutrófilos. Las cepas virulentas pueden formar biopelículas, unas estructuras que no pueden desarrollar las cepas avirulentas o que lo hacen con dificultad, por lo que este factor se ha relacionado claramente con la colonización de las mucosas del cerdo.
La adhesión e invasión de las células epiteliales se considera fundamental durante las primeras fases de la colonización. En este sentido, se ha demostrado la inducción de una apoptosis o “muerte celular programada” de las células del epitelio traqueal por medio de la activación de la cascada de las enzimas caspasas de las células diana, hasta desencadenar este daño en el epitelio traqueal. La cápsula característica de G. parasuis bloquea la fagocitosis de los macrófagos alveolares del pulmón, al tiempo que ralentiza su activación, lo que a su vez favorece la persistencia de la bacteria y, en consecuencia, su multiplicación en el parénquima pulmonar.
Además, las cepas virulentas pueden invadir las células de los endotelios vasculares, lo que contribuye a la diseminación sistémica y, por tanto, a la aparición de una septicemia en los cerdos. Nuestro grupo de investigación ha descrito minuciosamente el sistema de captación de hierro de G. parasuis, indispensable para la supervivencia bacteriana en el cerdo. Consiste en dos proteínas de la membrana externa de la pared celular Gram negativa receptoras de la transferrina porcina y, en menor medida, en la presencia de sideróforos en el interior bacteriano.
Pueden recapitularse los factores de virulencia en: el lipooligosacárido de la membrana externa Gram negativa, la cápsula, las fimbrias, algunas enzimas y diversas proteínas de la membrana externa (como la lipoproteína de unión a transferrina A, la proteína de unión a transferrina B o varios autotransportadores). Por el momento. no se ha descrito ninguna hemolisina secretada por G. parasuis, presente en otros patógenos bacterianos del CRP.
Numerosísimas son las posibilidades de diagnóstico de la enfermedad de Glässer, a través de la confirmación de la especie a partir de los aislados procedentes de las muestras clínicas obtenidas, cultivadas en ágar chocolate como medio de elección. Una de las más recientes permite de forma rápida y sencilla la diferenciación de G. parasuis de otras especies bacterianas próximas filogenéticamente, también responsables de cuadros respiratorios porcinos: se trata del análisis genético del ARN ribosómico 23S. Se han efectuado numerosos estudios respecto a la susceptibilidad de G. parasuis frente a los diferentes antibióticos.
En cualquier caso, especialmente en porcinocultura, el aumento de las resistencias de las diferentes bacterias desaconseja el uso indiscriminado de la antibioterapia y promueve la búsqueda de alternativas eficaces, como la prevención por medio de la utilización de vacunas.
En un estudio realizado con cepas clínicas británicas y españolas durante la primera década de este siglo, se obtuvieron mejores resultados de eficacia antibiótica entre los aislados procedentes del Reino Unido que entre los españoles, lo que puso de manifiesto una mayor transmisión de resistencias entre los aislados de G. parasuis hispanos, seguramente por una utilización mucho mayor de antibióticos.
Medidas de prevención y control
Las primeras valoradas fueron las bacterinas, que siguen utilizándose bastante y que se preparan a partir de, como mínimo, una cepa virulenta de G. parasuis. Algunas de las bacterinas comerciales contienen dos, tres o hasta cuatro serotipos diferentes, los más prevalentes en una región determinada, debido a que garantizan una protección cruzada escasa entre serotipos, que mejora incorporando los principales de una zona geográfica concreta. Se ha probado también alguna vacuna integrada por bacterias completas, pero desprovistas de su cromosoma (“vacunas fantasma”), con una desarrollo mejor de la respuesta humoral que las bacterinas tradicionales, pero sin que pasara de tratarse de un estudio preliminar.
El desarrollo de vacunas atenuadas se ha topado con un cierto desconocimiento de los factores de virulencia de G. parasuis, lo que no permitió hasta la década pasada el diseño de vacunas estables, basadas principalmente en la deleción de genes relacionados con la síntesis de polisacáridos o, alternativamente, con la promoción de la quimiotaxis bacteriana. Como ventaja, las vacunas atenuadas inducen un periodo de protección más prolongado que las bacterinas. Respecto a las vacunas de ADN, solo tenemos constancia de dos investigaciones, en las que se generó una protección parcial y se indujeron las ramas humoral y celular de la respuesta adquirida, pero utilizando ratones de laboratorio como modelo experimental en vez del hospedador natural.
Es sobre las vacunas de subunidades sobre las que han recaído los estudios más numerosos. Queremos destacar los de dos grupos españoles, el de V. Aragón (CRESA), sobre autotransportadores triméricos que inducían anticuerpos en lechones, pero no prevenían la colonización nasal de las cepas virulentas, y el de A.B. Schryvers (Universidad de Calgary) R. Frandoso (Universidad de Passo Fundo) y nosotros mismos. Hemos investigado exhaustivamente la proteína de unión a transferrina B (TbpB) y, en especial, la vacuna basada en el mutante Y167 (cuya TbpB apenas fijaba hierro porcino pero que conservaba el potencial inmunógeno de la cepa salvaje). Conseguimos una estimulación eficaz de las dos ramas de la respuesta inmunitaria adquirida y mejores resultados de protección que los de algunas vacunas comerciales.