La podredumbre del ajo causada por Fusarium proliferatum
Los síntomas de la enfermedad se manifiestan con podredumbres húmedas en los dientes, llegando a abarcar la totalidad del mismo; inicialmente se aprecian lesiones en la superficie de los dientes donde, en algunos casos, aparece un crecimiento miceliar blanco así como necrosis en el disco radicular (Figura 1). Tras un minucioso muestreo por las principales zonas productoras del ecotipo “Blancomor de Vallelado”, se aislaron, de los dientes sintomáticos, así como de las lesiones incipientes, diferentes hongos y bacterias.
Entre otros microorganismos, se aislaron diferentes bacterias y especies fúngicas tales como Fusarium solani, F. oxysporum, F. culmorum, Cladosporium spp. o Penicillium spp, pero en muy bajos porcentajes de dientes analizados y que, en ningún caso nos permitía explicar el origen de la patología. Aunque no podemos descartar un cierto efecto sobre la patología, aún por estudiar (Basallote et al., 2011).
Solo se aisló de manera constante en todas las muestras de ajo analizadas la especie Fusarium proliferatum. La identificación del patógeno se llevó a cabo mediante la observación microscópica de sus características taxonómicas (Leslie & Summerell, 2006). Fusarium proliferatum (Matsushima) Nirenberg presenta cadenas de microconidios en mono y polifiálidas y macroconidios curvados y normalmente con 3 a 5 septos. La correcta identificación taxonómica de los aislados se confirmó mediante técnicas moleculares (Jurado et al., 2006). Posteriormente, las inoculaciones sobre dientes sanos permitieron reproducir la sintomatología en laboratorio y el hongo fue de nuevo reaislado de los dientes sintomáticos, determinándose entonces como el agente causal de la podredumbre (Palmero et al., 2010).
Pormenorizadas prospecciones de diferentes productores de otras comarcas ajeras permitieron aislar de nuevo F. proliferatum. De igual manera a como había ocurrido en los análisis iniciales, aunque en alguna de ellas se aislaron diferentes micetos, de nuevo solo F. proliferatum se aisló indefectiblemente de todas las muestras analizadas.

Para dar respuesta a preguntas sobre si este hongo pudiera afectar, además de al ajo, a otros cultivos de liliáceas presentes en las zonas ajeras, se inocularon diferentes variedades de cebolla, puerro, cebolleta y cebollino con distintos aislados de F. proliferatum procedentes de ajos enfermos. Los resultados obtenidos en las pruebas de patogenicidad (Palmero et al., 2011) muestran la capacidad patógena de F. proliferatum sobre estos cultivos. Todos los aislados evaluados produjeron enfermedad en las variedades inoculadas. Este trabajo constituía la primera cita de la patogenicidad de F. proliferatum sobre puerro, cebollino y cebolleta. Los resultados nos permiten sugerir que los propágulos del patógeno podrían encontrar un huésped alternativo en los cultivos de otras especies cultivadas de la zona. Sin embargo, la diferente respuesta frente a la enfermedad observada en las distintas variedades utilizadas en el estudio indica que hay cierto grado de susceptibilidad varietal diferencial frente al patógeno.
Epidemiología
Una vez conocido el agente causal de la enfermedad y confirmada su patogenicidad es imprescindible conocer aspectos epidemiológicos para abordar su control efectivo. En este sentido, se abordó, por un lado, el posible origen del inóculo y por otro, el efecto de la temperatura y su relación con la supervivencia del hongo.
En los análisis microbiológicos llevados a cabo en los dientes de ajo utilizados como semilla por los propios agricultores se detectó la presencia del patógeno en todas las variedades analizadas, entre las que se encontraban variedades españolas, americanas y francesas de ajo blanco además de ajos de tipo chino. La propia semilla utilizada por los agricultores suponía así una vía de entrada de inóculo del patógeno en el ciclo productivo.
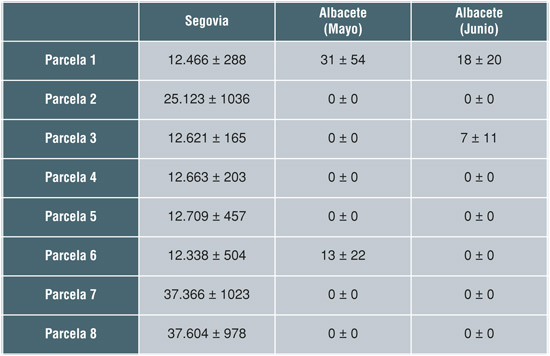
Para conocer la presencia del hongo en los terrenos de cultivo se realizaron análisis microbiológicos del suelo en dos de las principales zonas productoras: Castilla La Mancha (Albacete) y Castilla y León (Segovia). Los resultados de Segovia muestran una elevada presencia del hongo en los terrenos de cultivo; en cambio, en los análisis realizados en Albacete prácticamente no se detectó F. proliferatum ni en mayo ni en junio, fechas en las que se realizaron los muestreos (Tabla 1). En los terrenos de Albacete en los que se efectuaron los análisis de suelo, se suelen llevar a cabo rotaciones largas con cereal o adormidera, lo que, junto con el cambio de terreno de cultivo año tras año (las tierras son arrendadas), podría explicar la baja presencia del hongo en las muestras analizadas. Sin embargo, en Segovia, en muchos casos las tierras no son arrendadas, las rotaciones no son tan largas y además del ajo se cultiva mucho puerro en la misma zona mostrando los análisis una alta presencia de F. proliferatum en el suelo.
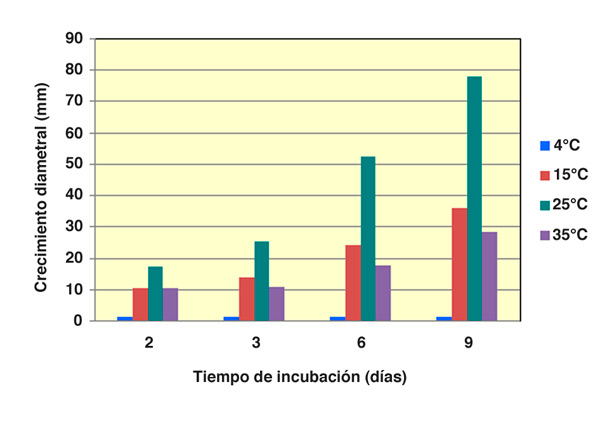
Conocida la presencia del hongo en el suelo y en el material vegetal de plantación, era necesario estudiar el efecto de la temperatura sobre los propágulos del hongo para poder evaluar su permanencia en el suelo y en las propias cabezas de ajo a lo largo del almacenamiento. De esta manera responderíamos algunas preguntas necesarias: ¿Sobrevive el patógeno en el suelo tras la cosecha hasta la siguiente siembra? ¿Cuál es el comportamiento del hongo durante el almacenamiento (20 °C) y/o durante la conservación del ajo en cámaras (4 °C)? Para ello se evaluó el efecto de la temperatura sobre el crecimiento fúngico y la viabilidad del hongo a lo largo del ciclo de cultivo así como durante su secado (30 °C), almacenamiento en cámara frigorífica (4 °C) o durante su almacenaje (15-25 °C). Se observaron diferencias en el crecimiento del hongo a lo largo de los días en función de la temperatura. Mientras que a 4 °C no había crecimiento alguno, éste fue máximo a 25 °C y se vio retrasado a 15 °C y más aún a 35°C (Figura 2). En cualquiera de las temperaturas estudiadas no se produjo la muerte del hongo, es decir, una vez transcurridos los días del estudio se colocaron las placas a 25 °C y todos los aislados que no crecieron a 4 °C eran viables, por tanto, el hongo es capaz de sobrevivir a estas temperaturas. Trasladado esto al cultivo, si el almacenamiento tiene lugar en cámara de conservación (4 °C) la podredumbre se frena pero el hongo no muere, retomando su actividad cuando se saca de la cámara para la comercialización del producto.
Estos datos fueron confirmados con los análisis de cabezas cosechadas mantenidas en condiciones de almacenamiento (20 °C) y de conservación (4 °C). Se etiquetaron lotes de 50 cabezas de cada una de las parcelas estudiadas antes de su conservación en almacén hasta dos meses después de la cosecha (primeros de septiembre). Cada uno de los bulbos se cubrió con papel de aluminio y se conservaron en cámara climática a 20 °C. Transcurridos uno y dos meses se evaluó el progreso de la podredumbre. Después se evaluó la presencia del patógeno y el porcentaje de dientes con síntomas de podredumbre en cada uno de los dientes de ajo de las diferentes parcelas. La fórmula aplicada para el cálculo de la severidad de la podredumbre de la muestra fue la siguiente:
Índice de Severidad de la Podredumbre (ISP) = [(N1x0)+(N2x1)+(N3x2)+(N4x3)]/NT
|
|
|
|
|
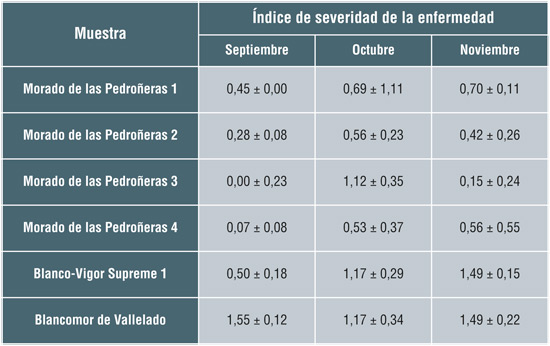
Los resultados mostraron un aumento de la podredumbre con el tiempo de almacenamiento, tras dos meses a 20 °C los ISP aumentaron en todos los casos (Tabla 2). Los ajos de tipo blanco son los que mayores porcentajes de ajos podridos presentaron, posiblemente debido a una predisposición de este tipo de variedades comerciales frente a las de tipo morado.
Control de la enfermedad
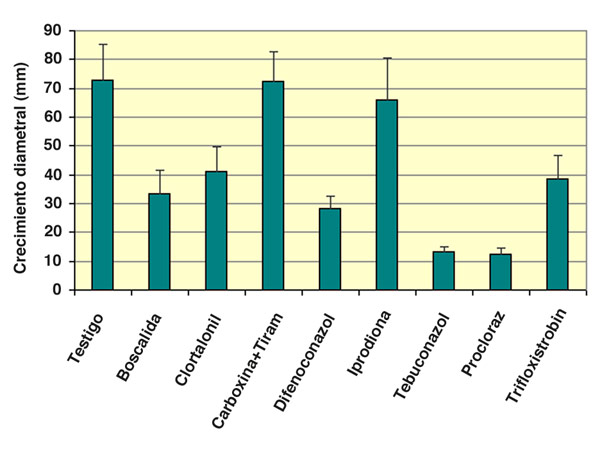
Para evaluar la eficacia de diferentes fungicidas, en nuestro grupo se han realizado estudios in vitro con distintas materias activas para comprobar si son capaces de reducir el crecimiento de F. proliferatum. Los fungicidas analizados fueron carboxina + tiram, procloraz, boscalida + piraclostrobina, iprodiona, trifloxistrobin, tebuconazol, difenoconazol y clortalonil. Al utilizar una concentración de 10 ppm de cada una de las materias activas, los mejores resultados se obtuvieron con tebuconazol y procloraz aunque también se redujo, en menor medida, el crecimiento fúngico con difenoconazol, boscalida, clortalonil y trifloxistrobin (Figura 3).
Por tanto, para poder controlar de manera efectiva esta enfermedad es imprescindible un control integrado del cultivo, que no sólo supone el uso de productos fitosanitarios sino también un correcto manejo del cultivo (elección adecuada del material vegetal, rotaciones, etc.). Además de la realización de tratamientos de desinfección del suelo para reducir la presencia del patógeno en el mismo y así disminuir la incidencia de la enfermedad en la campaña siguiente.
Bibliografía
• García, M., de Cara, M., Gálvez, L., Iglesias, C., Vares, L., Tello, J.C., Palmero, D. 2011. Especificidad parasitaria de aislados de Fusarium proliferatum (Matsushima) Nirenberg sobre especies del género Allium. Bol. San. Veg. Plagas (in press).
• Jurado M, Vázquez C, Marín S, Sanchis V, González-Jaén MT, 2006. PCR-based strategy to detect contamination with mycotoxigenic Fusarium species in maize. Systematic and Applied Microbiology 29, 681-689.
• Leslie, J.F., Summerell, B.A. 2006. The Fusarium Laboratory Manual. Blackwell Publishing. Ames, Iowa, USA 388 pp.
• Palmero D., Cara, M., Iglesias, C., Moreno, M.M., Gonzalez, N., Tello, J.C. 2010. First Report of Fusarium proliferatum Causing Rot of Garlic Bulbs in Spain. Plant Dis. 94: 277.
• Palmero, D., M. de Cara, W. Nosir, C. Iglesias, M. García, S. Woodward, J. Tello. 2010. Pathogenicity and fusaric acid production by Fusarium proliferatum isolated from garlic in Spain Phytopathology 100:S95.
• Basallote, M.J. Zurera, C. Melero, J.M. Prados, A.M. 2011. Nueva enfermedad en el cultivo del ajo ocasionada por Fusarium spp. Phytoma España. 229.
• Palmero, D. de Cara, M. Galvez, L.Tello, J.C. 2011. Effect of pre-sowing treatment on postharvest garlic rot caused by Fusarium proliferatum. 2011. Abstracts of the International congress of postharvest pathology. Lleida, Spain. 156.
• Palmero, D. de Cara, M. Cruz, A., González-Jaén, M., Tello, J.C. 2011. Identification and micotoxigenic potential of Fusarium proliferatum isolated from garlic in Albacete, Spain, and in vitro evaluation of temperature on radial mycelial growth. 2011. Abstracts of the International congress of postharvest pathology. Lleida, Spain. 95.

