Reutilización del agua ozonizada en lechuga romana procesada en fresco
Palabras clave: desinfección; ozono; foliáceas; duchado; Lactuca sativa L.\1CV\2longifolia.
Se observó que el agua ozonizada, a la dosis estudiada, no logró reducir la contaminación microbiológica con respecto al testigo (inmersión en agua), posiblemente por la baja concentración de O3 utilizada. Además, la implantación de una ducha de agua ozonizada tras el lavado por inmersión, tampoco mejoró los resultados. Así mismo, los tratamientos con 3 g/l de tierra) presentaron unos recuentos microbiológicos similares a los demás, indicando la posibilidad de reutilización del agua, siempre y cuando los límites microbiológicos no superen los establecidos por la legislación.
Introducción
La demanda de productos mínimamente procesados en fresco (MPF), denominados comercialmente de la 'IV Gama', es creciente tanto en los mercados internacionales como nacionales. El consumidor espera obtener un producto de fácil y de rápido consumo, con una alta calidad nutricional, sensorial y microbiológica. Estos productos MPF deben ser seguros y, para ello, es necesario emplear agentes desinfectantes en la etapa de lavado. Desde hace décadas, el cloro se ha usado como principal desinfectante. Sin embargo, algunos estudios indican que no siempre destruye la microflora. Además, organizaciones de la salud y del medio ambiente han expresado su preocupación por su empleo debido a la formación de residuos químicos en el agua de proceso que recaen en el medio ambiente, o por generar compuestos perjudiciales para la salud como trihalometanos (THM) y cloraminas, considerados tóxicos para el hígado y el riñón (Graham, 1997). Surge así el interés por otras técnicas sostenibles y emergentes de desinfección que puedan reemplazar al cloro, proporcionando otros beneficios, como sucede con el ozono (O3), radiaciones ionizantes o no, antimicrobianos naturales, bacteriocinas, agua electrolizada (Aguayo et al., 2008), tratamientos térmicos y gaseosos, salas blancas, etc (Artés et al., 2009; Silveira et al., 2008).

El presente trabajo se centra en el agua ozonizada. El O3 posee un potente efecto oxidante con un espectro más amplio frente a los microorganismos que el cloro (Kradre et al., 2001) y está considerado un agente seguro (GRAS) para aplicarlo en contacto con los alimentos (USDA, 1997). La aplicación de O3 reduce la flora microbiana en la superficie de los alimentos ya que su descomposición en la fase acuosa del alimento es rápida y su acción antimicrobiana tiene muy escasa penetración (Achen, 2000). La inactivación de microorganismos por el O3 es un proceso complejo dado que afecta a numerosos constituyentes celulares: proteínas, lípidos insaturados y enzimas respiratorias en las membranas celulares, péptidoglicanos en envolturas celulares, enzimas y ácidos nucléicos del citoplasma, proteínas y péptidoglicanos en cubiertas de esporas y cápsides de virus. Además, el O3 puede inactivar microorganismos al dañar su material genético.

No obstante, su eficiencia depende de la solubilidad del mismo, que está influenciada por la temperatura, pureza y pH del medio. El mezclado, burbujeo o turbulencia aumenta el contacto con las burbujas y la solubilización en agua y, además, rompe los grupos de microorganismos (Kim et al., 1999). Así, Aguayo et al. (2009) mostraron que los lavados de escarola MPF con agua ozonizada (0,4 ppm) aplicados en duchas incrementaban el efecto microbicida del O3, frente a la inmersión directa del producto. Una de las ventajas del O3, en especial en regiones con escasez de agua, es que este gas permite recircular y reutilizar el agua de lavado de frutas y hortalizas tras una decantación y filtración, al eliminar el color, olor y turbidez del agua tras reducir las cargas orgánicas (Aguayo et al., 2005; Rice et al., 1982). No obstante, previamente convendría conocer la concentración máxima de sólidos a partir de la cual, el agua ozonizada todavía conserva su efecto.

El objetivo de este trabajo consistió en determinar la eficacia y posibilidad de reutilización del agua ozonizada en lechuga MPF añadiendo tierra al agua para simular su contaminación, y la necesidad o no de implantar una ducha de agua ozonizada tras el lavado por inmersión de la lechuga cortada.
Materiales y métodos
La lechuga (Lactuca sativa L.\1CV\2longifolia) tipo 'romana' fue adquirida en un mercado de Cartagena (Murcia, España), procedente de la zona rural situada en las proximidades de la ciudad. Su recolección se realizó el mismo día de adquisición y fue trasladada en coche a la Planta Piloto del Grupo de Postrecolección y Refrigeración de la UPCT. Se procedió a una selección del material vegetal en función de su calidad visual, desechando las lechugas que presentaban daños en hojas, coloraciones inadecuadas o con insectos. En una cámara desinfectada y a 10 °C, la lechuga fue cortada en tiras de 1,5 a 2 cm y prelavada utilizando agua de la red (20 °C) durante 1 min, con el objetivo de eliminar restos de tierra, pesticidas, insectos, etc.
A partir de aquí, se realizaron baños por inmersión a 5 °C durante 2 min en agua de la red o en agua ozonizada (0,5 ppm), seguidos o no de una ducha de 10 s de duración, utilizando agua fría (5 °C) sin o con O3 (0,5 ppm). En algunos tratamientos se aportó 1 ó 3 g/L de tierra en el baño de inmersión para simular un proceso real de la industria de procesado en fresco y conocer así la influencia de las partículas de tierra en la desinfección ozonizada. Los tratamientos desarrollados se exponen en la Tabla 1. La ozonización del agua se realizó con un generador de ozono (Cosemar ozono, Madrid, España). Se utilizó el método espectrofotométrico de índigo para conocer la concentración obtenida de O3 en el agua (APHA, 1998).

En todos los tratamientos, tras el lavado, las tiras de lechuga se centrifugaron manualmente durante 20 s. A continuación, se pesaron (Mettler, Madrid, España) 40 g de lechuga cortada y se envasaron en atmósfera modificada pasiva, utilizando tarrinas de polipropileno de 1 L de capacidad, que se termosellaron (Befor, Chassieu, Francia) con un polipropileno orientado de 40 µm de espesor. Se realizaron tres repeticiones por tratamiento. Tras el envasado, las tarrinas se conservaron 11 días en una cámara a 5 °C y 90- 95% HR, evaluándose el producto al inicio y final de la conservación.
Análisis y determinaciones Análisis microbiológicos
En los días de análisis, se tomaron de 10 g de muestra por repetición, añadiéndose 90 ml de agua de peptona (Scharlau, Barcelona, España) a una bolsa estéril (Modelo 400 Bags 6141, Londres, Reino Unido). Estas fueron homogeneizadas en un Masticator (Colwort Stomacker 400, Steward Laboratory, Londres, Reino Unido) durante 1 minuto. Las diluciones posteriores se hicieron en agua peptonada en función de la dilución necesaria para su siembra en placa. Se sembraron los grupos microbiológicos correspondientes a mesófilos, psicrófilos, coliformes totales, Escherichia coli, levaduras y mohos. Se utilizaron las siguientes condiciones de incubación y medios de cultivo: mesófilos y psicrófilos, agar de recuento en placa (PCA, Scharlau, Barcelona, España), incubados a 30 °C durante 48 h y 8 °C durante 7 días, respectivamente; coliformes totales y E. coli se utilizó agar de Chromocult (Merck, Darmstadt, Alemania) incubándose a 37 °C durante 48 h; y en agar de patata dextrosa (PDA, Scharlau, Barcelona, España) con adición de oxitetraciclina (0,1 g L-1, Sigma-Aldrich) para levaduras y mohos, incubándose a 22 °C durante 48 h ó 5 días, respectivamente.
Los recuentos totales se expresaron en unidades logarítmicas de unidades formadoras de colonias por gramo de muestra (log ufc g-1). La calidad microbiológica fue evaluada según la legislación española entonces vigente para productos MPF (RD 3484/2000, 2001) que establecía como límites máximos 7 log ufc g-1 para bacterias aeróbias, 5 log ufc g-1 para levaduras y 3 log ufc g-1 para hongos. Actualmente está en vigor el Real Decreto 135/2010 que establece la vida útil del producto en función de la ausencia o presencia de patógenos.

Análisis estadísticos
Se calculó la media aritmética de cada tratamiento y su error estándar.
Resultados y discusión
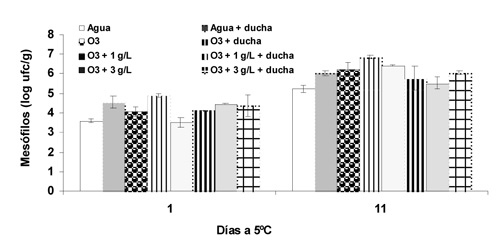
El crecimiento inicial de bacterias mesófilas fue de 3,6 a 4,6 log ufc g-1 (Fig. 1). Al final de la conservación su crecimiento osciló entre 5,2 y 6,9 log ufc g-1. En ambos casos la lechuga lavada con agua (testigo) presentó los recuentos más bajos.
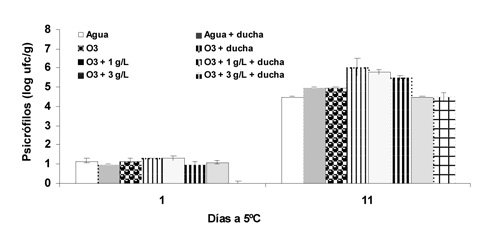
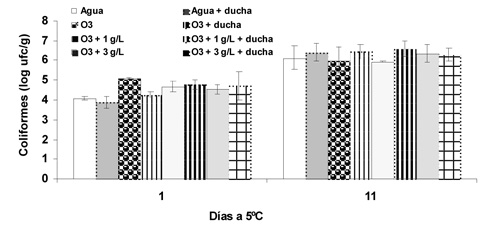
La población de bacterias psicrófilas fue muy baja (1 a 1,5 log ufc g-1) ascendiendo a 4,5 y 6 log ufc g-1 en el día 11 (Fig. 2). Una vez más, el testigo presentó los recuentos más bajos pero en esta ocasión los tratamientos de lavado con agua ozonizada con 3 g L-1 de sólidos con y sin ducha presentaron recuentos similares al testigo. Con respecto a los coliformes, inicialmente alcanzaron de 4 a 4,5 log ufc g-1 y, tras la conservación, la población se incrementó hasta 6 a 6,6 log ufc g-1, sin diferencias significativas entre tratamientos (Fig. 3).
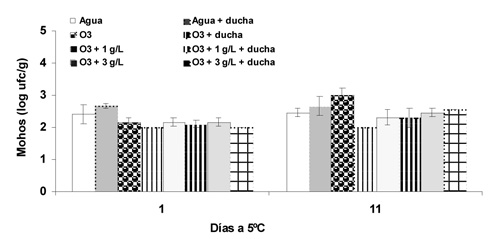
En todos los casos, el crecimiento de E. coli fue inferior a 2 log ufc g-1 para el día de procesado e inferior a 5 log ufc g-1 en el día 11 (datos no mostrados). No se produjo crecimiento de levaduras en ningún tratamiento, siendo durante toda la conservación inferior a 2 log ufc g-1. Con respecto al desarrollo de mohos, inicialmente alcanzó una media de 2 a 2,6 log ufc g-1, siendo de 2 a 3 log ufc g-1 en el día 11. Los recuentos más bajos correspondieron, en ambos días, al lavado de la lechuga con agua ozonizada seguida de ducha (Fig. 4).

De los resultados expuestos se deduce que el lavado con agua ozonizada a 0,5 ppm no logró una reducción microbiológica significativa con respecto al lavado en agua de la red, muy probablemente por la baja concentración de O3 utilizada. Otros autores, como Kim et al. (1999), obtuvieron reducciones de 1,2 log en los recuentos de los mesófilos y de 1,8 log en psicrófilos, lavando lechuga cortada en 62,4 ppm O3 a 25 °C durante 3 min, llegando a reducciones mayores cuando el tiempo de lavado fue de 5 min. Baur et al. (2004) lavaron lechuga entera con agua ozonizada (1 ppm, 2 min) sin lograr tampoco una reducción significativa en la población de microorganismos debido a que la concentración y tiempo de lavado no fue suficiente. Sin embargo, Silveira et al. (2010), en melón Amarillo MPF, después de 10 días de conservación a 5 °C, observaron una reducción de 1 log ufc g-1 en el crecimiento de bacterias aerófilas cuando se utilizó un lavado por inmersión en agua ozonizada (0,4 ppm, 3 min) seguida de una inmersión en ácido peroxiacético (80 ppm, 1 min). Previamente, en patata MPF, Beltrán et al. (2005) reportaron un buen efecto antimicrobiano del O3 cuando se combinaba con ácido peroxiacético pero similar e incluso peor que el lavado con agua cuando se aplicaba sólo el lavado con agua ozonizada. Con respecto a la reducción de E. coli, Singh et al. (2002) consiguieron reducciones de 1,63 ± 0,08 unidades log en una población inicial de 3,71 ± 0,05 log cuando la lechuga se lavó con agua ozonizada (10 ppm, 5 min). En nuestro caso, la ausencia de E. coli, en las diluciones realizadas, no ha permitido extraer ninguna conclusión.

En este trabajo tampoco se observó un efecto adicional de la ducha aplicada tras el lavado por inmersión, a pesar de que Aguayo et al. (2009) encontraran que el efecto microbicida del O3 se incrementó cuando se aplicó en duchas. Además, la incorporación de 1 ó 3 g/L de tierra al agua ozonizada, no produjo un efecto antimicrobiano desfavorable. Esto pudo deberse bien a la baja concentración de O3 en el agua, que no permite observar diferencias entre tratamientos, bien a que la presencia de 3 g/L de tierra no es lo suficientemente elevada para reducir el poder microbicida del O3.
A pesar de no encontrar diferencias entre los tratamientos de lavado, todos ellos permitieron alcanzar una vida útil de 11 días a 5°C en lechuga MPF, ya que los recuentos microbiológicos obtenidos fueron inferiores a los establecidos por la legislación entonces vigente
Conclusiones
El lavado de lechuga MPF en agua ozonizada a 0,5 ppm durante 2 min no mejoró la calidad microbiológica con respecto al testigo (lavado en agua de la red), posiblemente por la baja concentración de O3. Además, la aplicación de una ducha de agua ozonizada de 10 s tras el lavado por inmersión, tampoco logró diferencias significativas. La incorporación de sólidos en suspensión con 1 ó 3 g/l de tierra al agua, no condujo a un incremento de la contaminación microbiológica. Este efecto podría deberse a la baja concentración de O3 en el agua que impidió observar diferencias significativas entre tratamientos o bien indicaría la posibilidad de reutilización del agua. No obstante, deben estudiarse mayores dosis de O3 en agua para confirmar esta posible reutilización del agua de lavado, estableciendo un rango de sólidos en suspensión, en el que el O3 mantenga su poder desinfectante.

Agradecimientos
Se agradece la financiación concedida al Ministerio de Educación y Ciencia de España, a través del proyecto AGL2007-63861/ALI. Al Instituto de Biotecnología Vegetal se le agradece el uso de algunos equipos. Además se invita a las empresas a ponerse en contacto con la autora para realizar cualquier tipo de estudio dentro del área de los productos procesados en fresco y su desinfección.
Bibliografía
- Achen, M., 2000. Efficacy of ozone in inactivating Escherichia coli O157:H7 in pure cell suspensions and on apples. M.S. Thesis. The Ohio State University, Columbus.
- Aguayo, E., Escalona, V.H., Artés, F. 2005. Revisión: el ozono y su utilización en la industria agroalimentaria. Alimentaria, 19, 12, 48-60.
- Aguayo, E., Boluda, M., Le Lann, E., Artés, F. 2008. Influencia del agua electrolizada en el contenido fenólico y actividad antioxidante de hortalizas foliáceas. En.: Oria Almudí, R., Val Falcón, J., Ferrer Mairal, A. (eds.). Avances en maduración y post-recolección de frutas y hortalizas. Vol, I, 686-691. Editorial Acribia.
- Aguayo, E., Allende, A., Ameur, M., Otón, M., Gómez, P., Artés, F. 2009. Microbiological quality of shredded endive as affected by pre-washing and chlorinated or ozonated water. 6th International Postharvest Symposium. Antalya, Turquía.
- Artés F., Gómez P.A., E. Aguayo, Escalona V.H., Artés-Hernández F. 2009. Sustainable sanitation techniques for keeping quality and safety of fresh-cut plant commodities. Postharvest Biology and Technology. 51: 287–296.
- APHA, American Public Health Association. 1998. Standard Methods for the Examination of Water and Wastewater. The American Public Health Association: Washington, DC.
- Baur, S., Klaiber, R., Hammes, W.P., Carle, R. 2004. Sensory and microbiological quality of shredded packaged iceberg lettuce as affected by pre-washing produces with chlorinated and ozonated water. Innovative Food Science and Emerging Technologies, 5, 45-55.
- Beltrán, D., Selma, M.V., Tudela, J.A., Gil, M.I. 2005. Effect of different sanitizers on microbial and sensory quality of fresh-cut potato strips stored under modified atmosphere or vacuum packaging. Postharvest Biology and Technology, 37, 37-46.
- Graham, D. M.1997. Use of ozone for food processing. Food Technology, 51, 72-75.
- Khadre, M.A., Yousef, A.E., Kim, J.G. 2001. Microbiological aspects of ozone applications in food: a review. Journal of Food Science, 66, 9, 1242-1252.
- Kim, J.G., Yousef, A.E., Dave, S. 1999. Application of ozone for enhancing the microbiological safety and quality of foods: A review. Journal of Food Protection, 62, 1071–1087.
- Rice, R.G., Farguhar, J.W., Bollyky, L.J. 1982. Review of the applications of ozone for increasing storage times of perishable foods. Ozone Science and Engineering, 4, 147–163.
- Silveira, A.C, Conesa, A., Aguayo, E., Artés, F. 2008. Alternative sanitizers to chlorine for use on fresh-cut ‘Galia’ (Cucumis melo var. cantalupensis) melon. Journal of Food Science, 73, 405-411.
- Silveira, A.C., Aguayo, E., Artés, F. 2010. Emerging sanitizers and clean room packaging for improving the microbial quality of fresh-cut ‘Galia’ melon. Food Control, 21, 863-871.
- Singh, R., Chandra, R., Bose, M., Luthra, P.M. 2002. Antibacterial activity of Curcuma longa rhizome extract on pathogenic bacteria. Current Science, 83, 6, 737-740.

