Latencia invernal en yemas de árboles frutales, una panorámica molecular
Los árboles frutales en climas templados pasan por un periodo de latencia estacional en el que forman yemas que brotarán al llegar el buen tiempo. Tres programas genéticos diferentes pero entrelazados pugnan durante la latencia. El primero impide el crecimiento antes de que se den las condiciones óptimas (regulación de la latencia). El segundo contribuye a la tolerancia frente al frío y la falta de agua (protección). Finalmente, el tercero persigue la brotación de la yema y la floración para la reproducción de la especie (floración). El estudio de los genes implicados en estos procesos permitirá entender a nivel molecular los mecanismos que subyacen a éstos, tan importantes para la adaptación a las condiciones agroclimáticas de un área de cultivo y al cambio climático.

La latencia en el ciclo fenológico
Los árboles frutales de climas fríos y templados tienen un ciclo fenológico que responde a los cambios estacionales de temperatura y longitud del día. Durante los meses fríos de otoño-invierno esconden sus futuros brotes y flores en yemas que los protegen del frío y la falta de agua (Figura 1). Este periodo, llamado latencia, evita que una brotación demasiado temprana acabe en una helada de flores o frutos con la consiguiente pérdida de producción. Para la finalización de la latencia se requiere de la percepción de una cantidad acumulativa de frío (el llamado requerimiento de frío), que es diferente para distintas especies y variedades (Figura 2).


Sólo las variedades cuyos requerimientos de frío coincidan con el frío invernal de una localización se encontrarán bien adaptadas a las condiciones climáticas de ese lugar. Si los requerimientos de frío son menores que el frío real se podrán producir heladas esporádicas debido a que la brotación tiene lugar antes de la llegada del buen tiempo, y si son mayores la producción se verá reducida por una floración irregular e insuficiente.
Además, después de la salida de latencia se requiere de un periodo de temperaturas cálidas para el inicio de la brotación y la floración, que seguidas del desarrollo vegetativo y del fruto, acabará en el inicio de un nuevo ciclo en el otoño siguiente (Figura 3).

El dilema de crecer o proteger
Volviendo a la yema de flor latente, ésta tiene a lo largo de su existencia las opciones mutuamente incompatibles de seguir inactiva o reiniciar el crecimiento. Una decisión nada baladí considerando que la segunda opción conlleva la desactivación de algunos de los mecanismos de protección frente al frío y la desecación.
Es posible ahondar en los detalles moleculares de estas decisiones mediante abordajes científicos de transcriptómica que permiten identificar aquellos genes y rutas que se expresan en mayor grado en la yema latente o en la no latente. Estos estudios transcriptómicos realizados en yemas de melocotonero muestran un panorama nada simple en el que tres procesos principales pugnan por hacerse protagonistas en la yema latente, tal y como indica el estudio funcional de algunos de estos genes (Lloret et al., 2018). En primer lugar ciertos genes reguladores de la latencia son necesarios para mantener la yema latente y disminuyen su expresión antes de la salida de latencia como consecuencia de la satisfacción de los requerimientos de frío. En segundo lugar, genes cuya expresión mejora la tolerancia al frío y a la falta de agua se expresan en yema latente y se reprimen al final de la latencia. Finalmente, una pléyade de genes que intervienen en partes concretas del desarrollo floral, como la producción de los gametofitos masculino (polen) y femenino (óvulos) desatan su expresión tras la salida de latencia.
El balance molecular entre dos de estos procesos, la tolerancia al frío y el reinicio de la floración, determina el comportamiento de la yema, que tomará la decisión de permanecer latente y protegida o de crecer y florecer. Esta decisión irreversible está mediada por los genes que participan en el tercero de los procesos comentados (la regulación de la latencia), convirtiéndose en jueces de un dilema que afecta a la supervivencia de las células y a la producción del cultivo.
Genes que se expresan y se reprimen en la yema
Para profundizar en el fenómeno de la latencia estacional a nivel molecular no basta con identificar los genes cuya expresión cambia al salir de latencia. Además tendremos que averiguar su función o al menos tener pistas que permitan encuadrarlos en alguno de los tres procesos comentados anteriormente. Esta tarea es mucho más compleja y larga que su simple identificación, y suele requerir del uso de herramientas variadas.
Sabemos que existe un melocotonero obtenido en México llamado evergrowing que no deja de crecer totalmente en invierno, y que tiene una mutación genética causada por una eliminación parcial de los genes DAM (por Dormancy-Associated Mads-box). Ésta es una evidencia de genética funcional que nos dice que estos genes intervienen en la regulación del crecimiento y la latencia estacional (Bielenberg et al., 2008). Además sabemos que antes de la finalización de la latencia la expresión de algunos genes DAM disminuye drásticamente, y esta disminución ocurre antes en variedades con bajos requerimientos de frío. Pero esto no es todo, se han encontrado ortólogos de los genes DAM en múltiples árboles frutales e incluso alguna planta herbácea. Un grupo de investigación ha introducido un gen DAM de albaricoquero japonés en chopo y ha comprobado que su sobreexpresión causa una disminución del crecimiento y la producción de yemas y entrada en latencia en condiciones que habitualmente favorecen el crecimiento (Sasaki et al., 2011). Éstas y otras evidencias nos hacen pensar que los factores de transcripción DAM son reguladores maestros de la entrada y salida de latencia.

Por otro lado sabemos que existe una ruta de aclimatación al frío que mejora la tolerancia a las bajas temperaturas e incluso a la congelación, una ruta mediada por la acción de los factores CBF (por C-repeat Binding Factor) que está activa durante el periodo de latencia y como muy tarde hasta que se reinicia el crecimiento (como se ha dicho anteriormente esta ruta de tolerancia al frío es incompatible con el crecimiento). En nuestro laboratorio hemos investigado la enzima sorbitol-6-fosfato deshidrogenasa (S6PDH) que está implicada en la producción del sorbitol, un compuesto que los frutales de hueso suelen utilizar como fuente de carbono translocable de las hojas donde se produce tras la fotosíntesis al resto de la planta, pero que curiosamente se expresa en yemas latentes donde no se produce la fotosíntesis. Dado que el sorbitol se considera un compuesto que ofrece protección frente a la congelación (crioprotector) y a la falta de agua (soluto compatible) en otros modelos biológicos, se ha propuesto la síntesis de sorbitol en yema como un mecanismo de tolerancia adicional frente al frío y la desecación (Lloret et al., 2017).
También sabemos que durante la latencia las yemas florales de melocotonero ya han iniciado el proceso de diferenciación floral que ha dado lugar a los distintos verticilos de la flor. Podemos distinguir primordios de sépalos, pétalos, estambres y pistilos que han parado su crecimiento en un estado determinado. Sólo la salida de latencia despierta de su letargo a estos órganos, que continuarán su desarrollo donde lo dejaron. Por ejemplo, las células madres del polen comienzan el proceso de microsporogénesis que incluye la división meiótica y la síntesis de una infinidad de compuestos necesarios para la viabilidad del polen, producidos por las células del tapetum en las anteras. Los genes implicados en la síntesis de estos compuestos se inducen rápidamente al acabar la latencia hasta que la desaparición del tapetum anula su expresión de forma drástica (Ríos et al., 2013).
Estos genes sólo son una pequeña parte de todos aquellos que intervienen en los procesos de regulación, tolerancia al estrés ambiental y floración en las dimensiones diminutas de una yema. La superposición de eventos sucesivos siguiendo un programa genético determinado como el descrito implica además la existencia de genes y rutas que se encargan de coordinar la expresión génica según un guión establecido.
Rutas de regulación concertada
A menudo, después de encontrar un gen con una función en un proceso de interés decidimos estudiar cómo se regula, es decir qué otros genes están implicados en aumentar o reducir su expresión. De ese modo avanzamos un paso más en la descripción de una ruta de regulación, en la que una lista más o menos ordenada de elementos (proteínas y por consiguiente los genes que las producen) acaba en los efectores finales que realizan la acción deseada de protección, crecimiento o desarrollo.
Esto mismo se ha realizado con los genes DAM. Se ha comprobado por ejemplo que en una especie de pera los factores CBF activan la expresión de DAM, mientras que los factores DAM reprimen FT (por Flowering Locus T), un gen al que se ha relacionado con el inicio de la floración y la activación del crecimiento en distintas especies (Niu et al., 2016). De este modo tenemos un mecanismo que asocia tolerancia al frío con el mantenimiento de latencia, y por otro lado el inicio de la floración con la salida de la latencia, intermediado todo ello por los genes DAM.
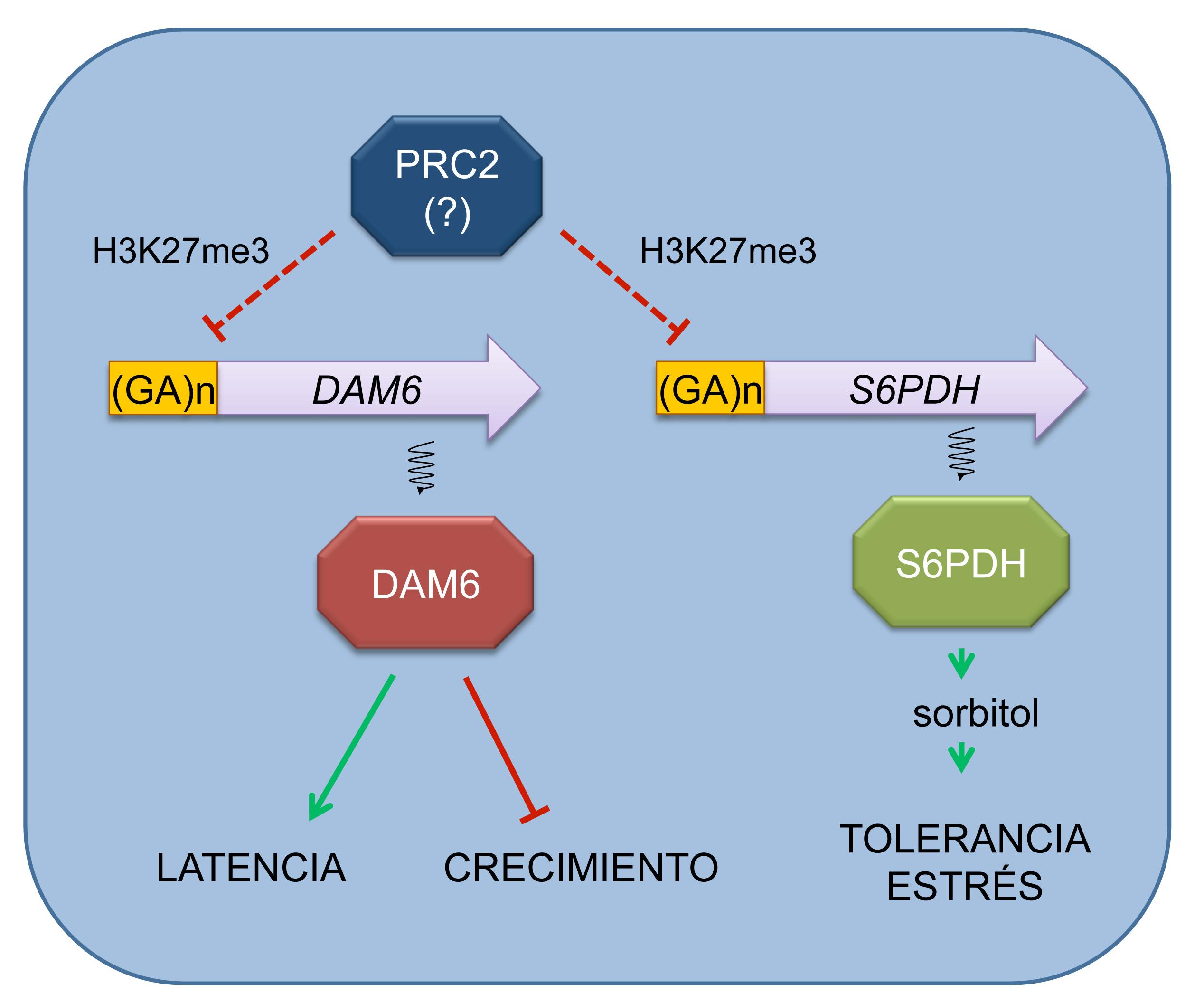
También hemos tenido ocasión de comprobar la participación de los llamados modificadores de la cromatina en la expresión de los genes DAM. Estos modificadores de la cromatina actúan cambiando químicamente las proteínas que habitualmente se unen a los genes, mediante metilaciones, acetilaciones, fosforilaciones, etc... Estas modificaciones también afectan a la expresión de los genes, y en concreto la metilación de un aminoácido lisina en algunas de estas proteínas ha sido relacionada con la represión de los genes DAM. Esta modificación concreta, llamada H3K27me3, se produce en una región de los genes DAM con repeticiones de guanina-adenina (GA) en su secuencia nucleotídica (de la Fuente et al., 2015), y también se produce en una repetición GA del gen S6PDH que codifica la enzima de síntesis de sorbitol de la que hemos hablado antes. En otros organismos modelo esta modificación es realizada por los llamados PRC2 (por Polycomb Repressive Complex 2) y es de esperar que también se encuentren en árboles frutales (Figura 4). De este modo tenemos que los genes DAM y el posible gen de protección frente al frío y la desecación S6PDH comparten un mecanismo que puede ser usado para suprimir la expresión de estos genes de forma simultánea al finalizar el periodo de latencia. Evidentemente no es casualidad, sino parte de un intrincado mecanismo de regulación de la latencia del que todavía estamos muy lejos de conocer los detalles.
Un mayor conocimiento de estos mecanismos nos ofrecerá sin duda herramientas de selección aplicable a programas de mejora de distintas especies cultivadas, pero también la posibilidad en el futuro de matizar la respuesta de nuestros árboles a los estímulos externos que influyen en la latencia y la floración, para aminorar los efectos de los vaivenes meteorológicos y el cambio climático en nuestra agricultura.
Agradecimientos
Este estudio ha sido elaborado en el marco de proyectos financiados por el Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA)-FEDER (RF2013-00043-C02-02), y el Ministerio de Ciencia e Innovación (AGL2010-20595).
Referencias bibliográficas
- Bielenberg, D. G., Wang, Y., Li, Z., Zhebentyayeva, T., Fan, S., Reighard, G. L., Scorza, R., Abbott, A. G. 2008. Sequencing and annotation of the evergrowing locus in peach (Prunus persica [L.] Batsch) reveals a cluster of six MADS-box transcription factors as candidate genes for regulation of terminal bud formation. Tree Genetics & Genomes 4: 495-507
- de la Fuente, L., Conesa, A., Lloret, A., Badenes, M. L., Ríos, G. 2015. Genome-wide changes in histone H3 lysine 27 trimethylation associated with bud dormancy release in peach. Tree Genetics & Genomes 11: 45
- Lloret, A., Badenes, M. L., Ríos, G. 2018. Modulation of dormancy and growth responses in reproductive buds of temperate trees. Frontiers in Plant Science 9: 1368
- Lloret, A., Martínez-Fuentes, A., Agustí, M., Badenes, M. L., Ríos, G. 2017. Chromatin-associated regulation of sorbitol synthesis in flower buds of peach. Plant Molecular Biology 95: 507-517
- Niu, Q., Li, J., Cai, D., Qian, M., Jia, H., Bai, S., Hussain, S., Liu, G., Teng, Y., Zheng, X. 2016. Dormancy-associated MADS-box genes and microRNAs jointly control dormancy transition in pear (Pyrus pyrifolia white pear group) flower bud. Journal of Experimental Botany 67: 239-257
- Ríos, G., Tadeo, F. R., Leida, C., Badenes, M. L. 2013. Prediction of components of the sporopollenin synthesis pathway in peach by genomic and expression analyses. BMC Genomics 14: 40
- Sasaki, R., Yamane, H., Ooka, T., Jotatsu, H., Kitamura, Y., Akagi, T., Tao, R. 2011. Functional and expressional analyses of PmDAM genes associated with endodormancy in Japanese apricot. Plant Physiology 157: 485-497

