El manejo del moho blanco supone una gestión complicada a nivel mundial, es inconsistente y cara debido a la presencia de un amplio rango de huéspedes y a la supervivencia de los propágulos del hongo
La enfermedad del moho blanco de las brásicas
El hongo Sclerotinia sclerotiorum infecta cientos de especies de plantas y es una enfermedad mayor en cultivos hortícolas y oleaginosos de Brassica, causando la podredumbre del tallo de Sclerotinia o también llamada moho blanco. La viabilidad a largo plazo de los esclerocios en el suelo, los cuales son estructuras que ayudan a la supervivencia del hongo en ausencia de plantas huésped, hace que el manejo de esta enfermedad sea complicado. Las estrategias de control actuales se basan en la utilización de agroquímicos y prácticas culturales adecuadas. Actualmente, todavía existen serias dificultades en el control de la enfermedad que requiere métodos alternativos, más ecológicos y sostenibles, como el uso de cultivares resistentes y biopesticidas. La investigación que se realiza actualmente sobre la interacción Sclerotinia-Brassica ha generado resultados interesantes y augura unas perspectivas de futuro prometedoras para el control de la podredumbre del tallo.

Introducción
Sclerotinia sclerotiorum (Lib.) de Bary es un hongo necrótrofo, patógeno de plantas que infecta más de 400 especies, pertenecientes a 278 géneros y 75 familias de dicotiledóneas. Entre los cultivos más importantes a los que infecta se encuentran judía, soja, girasol, alfalfa, algodón y tomate, además de malas hierbas y monocotiledóneas. Su amplio rango de huéspedes ha hecho de este hongo uno de los menos específicos y más invasivos entre los patógenos de plantas. Entre un 10 y un 80% de las pérdidas de rendimiento anuales entre cultivos oleaginosos, forrajeros y hortícolas de brásicas son causados por S. sclerotiorum. El patógeno puede causar podredumbre de tallo en plantas de colza y mostaza (Brassica napus y B. juncea, respectivamente). La podredumbre del tallo se ha descrito en todos los lugares en donde se cultivan colza y mostaza, incluyendo Australia, India, China, Canadá, América del Norte, Brasil, Europa, y algunos países de Europa del Este. Entre las brásicas hortícolas, la enfermedad y las pérdidas de rendimiento pueden ocurrir en campo, almacenamiento y venta de los productos.
Dependiendo del estadio de crecimiento o de los órganos que han sido afectados, la enfermedad puede manifestarse como podredumbre del tallo, podredumbre acuosa o podredumbre de la cabeza, esta última en repollo (B. oleracea). La infección ocurre en la parte aérea y basal del tallo del huésped y los síntomas iniciales aparecen como manchas acuosas en hojas o tallos. Más tarde las lesiones de las hojas se extienden al peciolo e infectan el tallo. Las lesiones en tallos aparecen sobre la parte encima de la superficie del suelo y son desde gris claro a blanco. Según la enfermedad avanza se dispersa a las ramas superiores incluyendo las vainas. Finalmente, el tallo se rompe en el punto de infección, dando lugar a la marchitez y muerte de la planta. Se producen esclerocios sobre o dentro de los tallos agujereados. En repollo, el patógeno provoca la podredumbre de las cabezas. Los síntomas aparecen primero como manchas empapadas de agua sobre las hojas superiores o inferiores del repollo. Estas manchas se alargan, los tejidos infectados se vuelven blandos y las hojas externas comienzan a marchitarse. A medida que la enfermedad progresa se hace evidente un crecimiento de moho blanco algodonoso sobre las hojas. Finalmente la cabeza del repollo se recubre con el moho algodonoso seguido de un desarrollo de esclerocios en la cabeza.
El patógeno sobrevive en el suelo y en los desechos de la planta como esclerocios de pared gruesa, que pueden permanecer viables durante varios años. Pueden infectar la planta de dos maneras diferentes: miceliogénicamente y carpogénicamente. De la primera manera, los esclerocios germinan y las hifas infectan directamente el tallo basal, siendo este método de infección de importancia primaria en algunas regiones. De la manera carpogénica, los esclerocios producen apotecios. Los apotecios desarrollados, se localizan sobre el suelo o enterrados, liberando sobre 10 millones de ascosporas las cuales infectan las partes superiores de la planta (Figura 1). Las ascosporas liberadas al aires son responsables de la mayor parte de las epidemias que S. sclerotiorum causa a nivel mundial. Como ejemplo, en la podredumbre del tallo de la colza, las ascosporas alcanzan las hojas, nudos y otras partes de la planta. En repollo, la mayor parte de las infecciones en campo ocurren después de la formación de la cabeza. En algunos huéspedes el número de esclerocios en el campo afecta la incidencia de la enfermedad. Un esclerocio por 5 kg de suelo puede causar sobre un 40% de severidad en la enfermedad. El número de esclerocios producidos por S. sclerotiorum en distintos tejidos de la planta también es variable y es un factor importante para determinar los niveles de inóculo. Por ejemplo, una raíz infectada de zanahoria produce hasta 30 esclerocios, mientras que una cabeza infectada de repollo produce entre 250 hasta 500 esclerocios.
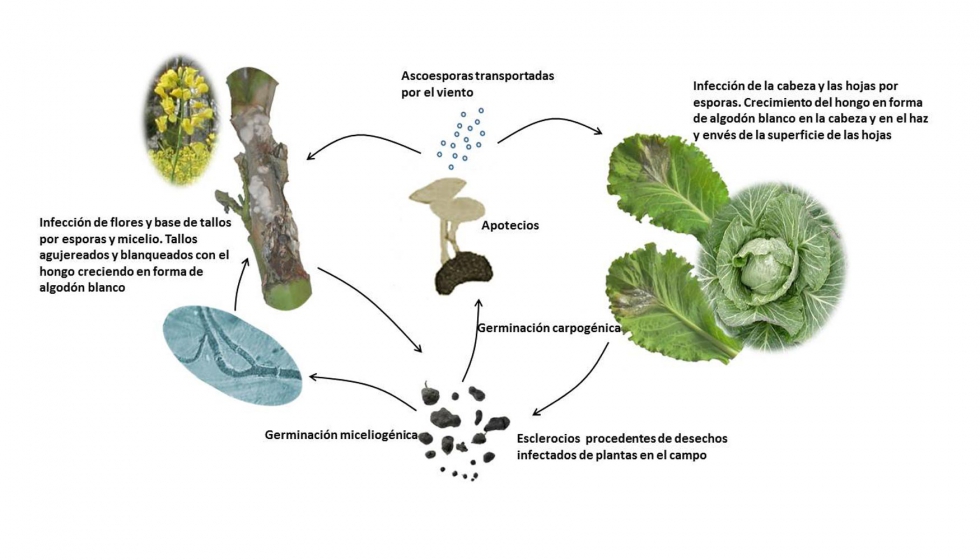
Manejo de la enfermedad
El manejo del moho blanco supone una gestión complicada a nivel mundial, es inconsistente y cara debido a la presencia de un amplio rango de huéspedes y a la supervivencia de los propágulos del hongo. Actualmente, el control de la podredumbre de Sclerotinia, especialmente en canola, se lleva a cabo fundamentalmente a través de prácticas culturales y la aplicación de fungicidas foliares que proveen, como mucho, solo protección parcial y esporádica. Además su aplicación puede llegar a ser muy cara. Como métodos culturales se usan la rotación de cultivos y una labranza mínima de la tierra. Sin embargo, en la práctica, los dos o tres años de descanso entre los cultivos huésped empleados en las rotaciones a menudo no son efectivos para reducir la viabilidad de los esclerocios, los cuales pueden sobrevivir por lo menos durante tres años en el suelo. Aunque, se hallan disponibles varios fungicidas para su uso en campos de canola, su eficacia depende fuertemente del tiempo de aplicación, el desarrollo de la planta, y las condiciones ambientales. Además, se han detectado resistencias al fungicida. En el último informe de la Organización Europea de Protección de Plantas Mediterráneas (EPPO) sobre buenas prácticas de protección de brásicas hortícolas (brásicas aprovechadas por su hoja, cabeza o flor y raíz) no se encuentra una metodología y/o fungicida que pueda controlar específicamente la podredumbre de Sclerotinia. Por lo tanto, para encontrar un método de control sostenible al moho blanco y de larga duración existe una presión creciente en usar métodos alternativos como el empleo de cultivares resistentes, estrategias de biocontrol y biofungicidas.
Existen dos obstáculos mayores en el acceso a genotipos resistentes. En primer lugar, la variabilidad en la respuesta del germoplasma a la inoculación con S. sclerotiorum hace que los cribados en campo a veces no sean repetibles. Las razones de esta variabilidad son desconocidas todavía. El segundo problema es la falta de niveles elevados de resistencia en varios genomas de Brassica. Existen una demanda creciente de variedades oleíferas de Brassica (B. napus, B. rapa y B. juncea) con resistencia estable en diversas condiciones ambientales frente a los patotipos predominantes de S. sclerotiorum, pero en los cultivos citados no se han encontrado resistencias completas hasta la fecha. En China se han descrito dos cultivares de canola denominados Zhongyou 821 y Zhongshuang 9, parcialmente resistentes. La introgresión desde otras especies podría incrementar el número de fuentes de resistencia disponibles para la mejora de brásicas oleaginosas. Se han obtenido líneas de introgresión empleando las especies silvestres Erucastrum cardaminoides, Diplotaxis tenuisiliqua, Erucastrum abyssinicum y Sinapis alba como donantes de resistencia y B. juncea y B. napus como parentales recurrentes. El éxito de estos cruzamientos interespecíficos muestra que hay un potencial enorme para incorporar niveles elevados de resistencia desde crucíferas silvestres al germoplasma brásicas cultivadas. B. oleracea se cultiva generalmente como una hortícola de hoja. Se han descrito fuentes de resistencia en distintos cultivos de esta especie. Como resultado de estudios recientes para encontrar fuentes de resistencia en variedades de seis especies de Brassica, incluyendo 47 de B. oleracea, se ha encontrado que los genotipos más resistentes eran de esta especie y especialmente sus parentales silvestres Brassica rupestris, Brassica incana, Brassica insularis y Brassica villosa. Como resultado de un estudio de campo a gran escala llevado a cabo por un grupo de expertos de Australia durante años recientes, se han encontrado 34 genotipos de B. oleracea resistentes y cuyo comportamiento era mejor que el de anteriores testigos resistentes. Los genotipos resistentes de B. oleracea suponen un gran potencial para progresar en el desarrollo de variedades resistentes a Sclerotinia para ambos tipos de cultivos, hortícolas y oleaginosos.
Respecto al uso de estrategias de control biológicas existen diversas especies antagonistas que se podrían emplear, incluyendo hongos como Coniothyrium minitans y Trichoderma spp, bacterias como Bacillus spp. y Pseudomonas spp., y también micovirus. Aunque, en algunos informes sobre productos comerciales en condiciones de campo, los resultados son inconsistentes, los agentes de control biológico pueden resultar un método de control efectivo en cultivos oleaginosos. Siguiendo otra línea de investigación, existe un interés creciente para usar productos bioactivos derivados de plantas como biofumigantes. Los cultivos de Brassica tienen niveles elevados de compuestos efectivos como los iostiocianatos (ITCs), que han sido empleados como biofumigantes para erradicar un amplio rango de patógenos y plagas presentes en el suelo. Los investigadores han mostrado que los tratamientos biofumigantes son una alternativa efectiva y una estrategia a largo plazo en el control de la enfermedad del moho blanco. En este proceso las plantas de Brassica son maceradas e incorporadas al suelo para destruir los esclerocios.
Interacción Sclerotinia sclerotiorum-Brassica: Investigación actual y tendencias futuras
En las últimas décadas, se han seguido fundamentalmente dos líneas de investigación para solventar el problema moho blanco-brásicas. Desde el punto de vista del control de la planta, los estudios se han enfocado a buscar cultivares resistentes y mecanismos moleculares que controlen la interacción entre el huésped y el patógeno. Los investigadores han usado distintas aproximaciones para encontrar fuentes de resistencia importantes, incluyendo el cribado de distintos genotipos, programas de mejora tradicionales, análisis de microarrays y mapeo de QTLs para diseccionar los genes cuantitativos de resistencia. Dentro de los mecanismos moleculares de la planta, las proteínas de defensa receptoras, el papel de las hormonas, fitoalexinas, el enzima oxalato oxidasa y los metabolitos secundarios han sido ampliamente estudiados. Muchas especies de crucíferas producen niveles significativos de metabolitos secundarios que contienen azufre denominados glucosinolatos (GSLs). Los GSLs en niveles elevados pueden incrementar la tolerancia de la planta frente a plagas y patógenos. Tienen un amplio rango de características biocidas y son tóxicos frente a distintos hongos patógenos. En la Misión Biológica de Galicia (CSIC) estamos estudiando el efecto de los GSLs sobre S. sclerotiorum siguiendo dos aproximaciones diferentes. Estamos probando el efecto de varios genotipos de B. oleracea (berza) con distinto contenido en GSL, obtenidos a través de un programa de selección divergente, en el desarrollo de la enfermedad (Figura 2). Paralelamente, estamos estudiando el mecanismo por el cual las formas bioactivas de los GSLs actúan contra los hongos mediante ensayos in vitro y siguiendo una aproximación transcriptómica.

Figura 2. a) Colonia de Sclerotinia sclerotiorum en medio PDA. b) Síntomas sobre hojas de berza infectadas con trozos de medio con micelio del hongo en condiciones controladas.
Desde el punto de vista del patógeno, los investigadores están más enfocados en descubrir factores de virulencia, especialmente en el papel del ácido oxálico, las proteínas de secreción pequeñas y en el análisis genómico del hongo para entender la complejidad del carácter y la patogenicidad de amplio espectro. Basado en el conocimiento disponible sobre el moho blanco en Brassica, la mayoría de los trabajos futuros se centrarán en promocionar variedades con resistencia natural y en el control biológico de la enfermedad. Afortunadamente, la capacidad de hacer cruzamientos entre crucíferas muy diversas y la existencia de fuentes de resistencia prometedoras en crucíferas silvestres abre un campo nuevo para introducir estas resistencias a S. sclerotiorum dentro de crucíferas comerciales. Respecto a los biopesticidas, los investigadores tenderán a estabilizar los bio-productos que se hallan hoy en día disponibles y a desarrollar nuevos productos como agentes de biocontrol basados en virus, fundamentalmente para su aplicación en colza.
Referencias bibliográficas
- Derbyshire, M. C.; Denton-Giles, M. (2016). The control of Sclerotinia stem rot on oilseed rape (Brassica napus): current practices and future opportunities. Plant Pathology. 65:859–877.
- Mbengue, M.; Navaud, O.; Peyraud, R.; Barascud, M.; Badet T.; Vincent, R.; Barbacci, A.; Raffaele, S. (2016). Emerging trends in molecular interactions between plants and the broad host range fungal pathogens Botrytis cinerea and Sclerotinia sclerotiorum. Frontiers in Plant Science. 7:422.
- Mostofa Kamal, M; Savocchia, S; Lindbeck, K. D.; Ash, G. J. (2016). Biology and biocontrol of Sclerotinia sclerotiorum (Lib.) de Bary in oilseed Brassicas. Australasian Plant Pathology. 45:1–14.
- Sharma, P.; Verma, P.R.; Meena, P. D.; Kumar, V.; Singh, D. (2015). Research progress analysis of Sclerotinia rot (Sclerotinia sclerotiorum) of oilseed Brassicas through bibliography. Journal of oilseed Brassica. 6 (Special):45-125.
- You, M.P.; Uloth, M. B.; Li, X.X.; Bang S.S.; Banga, S.K.; Barbetti, M.J. (2016).Valuable new resistances ensure improved management of Sclerotinia Stem Rot (Sclerotinia sclerotiorum) in horticultural and oilseed Brassica species. Journal of Phytopathology. 164: 291–299.

