Diseño de una prótesis liviana de cadera con la posibilidad de incorporar medicación
En el desarrollo de este trabajo, se va a proponer un diseño en el que se tiene como objetivo la mejora de la adaptación del paciente al implante. Esto se va a lograr de dos formas:
- Reduciendo el peso del implante, lo que hará que éste sea más liviano y parecido a la articulación real.
- Introduciendo la posibilidad de que la prótesis porte medicamento. El aligeramiento de la prótesis se llevará a cabo realizando un diseño en el que se utiliza menor cantidad de material metálico en la cabeza femoral, sin perder la elevada capacidad de resistencia a los esfuerzos.
Además, también se va a plantear la posibilidad de aprovechar el espacio que se obtiene en la cabeza femoral para introducir en la articulación medicamentos. Así, los fármacos que se suministran al paciente durante el postoperatorio para ayudar a mitigar el dolor en la cadera y prevenir la infección podrían ser aplicados de forma directa en la articulación. Esto conlleva diversos beneficios que se estudiarán más adelante.
Por otra parte, otro aspecto al que se va a prestar atención es a la viabilidad del implante a largo plazo, ya que con el constante aumento de la esperanza de vida cada vez se requieren soluciones más duraderas. Para esto se debe buscar minimizar el desgaste en las superficies articulares y tener una buena fijación. Se va a diseñar una prótesis destinada a ser fijada sin cemento, se fijará por crecimiento del hueso sobre la superficie de la prótesis. Se elige este método porque, aunque su implantación sea más compleja, la fiabilidad a largo plazo es mayor, los casos de aflojamiento son menos comunes que en las prótesis cementadas. En cuanto a la mejora del desgaste, se va a prestar especial atención a los materiales escogidos para formar las superficies articulares.

Resolución mediante el método Triz
La Teoría de Resolución de Problemas de Inventiva, más conocida como Triz, trata de sistematizar la resolución de problemas técnicos. El creador de este método fue el ingeniero y científico ruso Genrikh Altshuller, en 1946. Genrikh se basó en el estudio del principio inventivo de una serie de patentes muy diferentes, para lograr identificar los pasos presentes en la mayor parte de las invenciones. Así, desarrolló la teoría de que una solución técnica no surge de manera aleatoria, sino que sigue un cierto proceso objetivo, que se puede utilizar de forma consciente para llegar a desarrollar cualquier sistema. Por tanto, la idea de Triz es la obtención de un proceso sistemático que ayude a encontrar una solución técnica fomentando el pensamiento crítico y las capacidades de invención y creatividad.
Con el método Triz, Altshuller buscaba una solución a la aparición de contradicciones a lo largo del proceso de diseño, cuando al mejorar una propiedad se empeora otra. Se propuso poder eliminarlas y encontrar la solución ideal, no solo quedarse con la solución de compromiso.
El método Triz se basa en la hipótesis de que hay unos principios de creatividad universales en los que se basan las innovaciones tecnológicas. Según esto, se postularon las tres premisas de la metodología Triz:
- Los problemas tecnológicos y sus soluciones se repiten en todas las industrias y ciencias, por eso la clasificación de las contradicciones de estos problemas sirve para predecir las soluciones.
- Los patrones de las evoluciones técnicas se repiten en las diferentes industrias y ciencias.
- Las innovaciones creativas utilizan efectos científicos que no fueron desarrollados para el campo del problema a resolver.
Del estudio de las diferentes patentes, Altshuller obtuvo 3 parámetros ingenieriles y 40 principios inventivos. Así, el método Triz cuenta con tres fases:
- Formulación de la mejora o solución en relación con los parámetros inventivos.
- Identificación de la contradicción: detectar el efecto indeseable que la mejora de estos parámetros produce.
- Utilización de la tabla de contradicciones de Altshuller para obtener los principios inventivos que permitan mejorar ciertos aspectos sin empeorar otros.
Se tienen los siguientes parámetros inventivos:
|
Parámetros inventivos del método TRIZ |
|
|
|
|
Principio inventivos |
Descripción |
|
1. Segmentación |
División del objeto en partes independientes. |
|
2. Separación |
Se trata de retirar una parte del objeto. |
|
3. Calidad local |
Se refiere a hacer funcionar cada parte del objeto en las mejores condiciones para su cometido, logrando que cada parte del cumpla una función diferente. |
|
4. Asimetría: |
Cambio de la forma simétrica de un objeto por una asimétrica o incremento del grado de asimetría en el caso de que ya sea asimétrico. |
|
5. Combinación |
Fusión objetos o partes iguales para realizar operaciones paralelas o juntar operaciones en el tiempo. |
|
6. Universalidad o multifuncionalidad |
Se trata de hacer que una parte del objeto o sistema realiza funciones múltiples, eliminando así otras partes. |
|
7. Anidación |
Colocación de un objeto dentro de otro o paso de una parte por la cavidad de otra. |
|
8. Contrapeso |
Compensación del peso de un objeto combinándolo con otros que le den elevación o haciéndolo interactuar con un ambiente que le provea de fuerza aerodinámica, hidrodinámica o similar. |
|
9. Acción previa contraria |
Antes de que esté expuesto al factor nocivo, se somete el objeto a una acción contraria a dicho factor para compensarlo. |
|
10. Acción previa |
Realización de un cambio antes de que sea necesario porque se prevé que se requerirá, previniendo así factores nocivos para el objeto. |
|
11. Protección previa o compensación anticipada |
Preparación de medios para compensar la baja fiabilidad del objeto. |
|
12. Equipotencialidad |
Limitación de los cambios de posición en un campo potencial, por ejemplo, eliminando la necesidad de levantar y bajar objetos en un campo de gravedad. |
|
13. Inversión |
Inversión de las acciones utilizadas para solucionar el problema, hacer partes fijas del objeto móvil y al contrario. |
|
13. Esfericidad |
Se refiere a la utilización de partes curvas en lugar de lineales, movimiento rotatorio, fuerzas centrífugas. |
|
15. Dinamicidad |
Conversión de un objeto fijo en movible o su división en partes con movimiento relativo entre ellas, permitiendo que las características del objeto, sistema, ambiente o proceso puedan cambiar para adaptarse a las condiciones de operación.
|
|
16. Acción parcial o excesiva |
Si no se puede llevar a cabo una acción, reformular el problema para abarcar ligeramente más o ligeramente menos. |
|
17. Cambio dimensional |
Consideración del movimiento en el espacio, reorganización de los objetos para conseguir un arreglo múltiple de objetos, inclinación del objeto o uso de otro lado de un área dada. |
|
18. Vibración mecánica |
Se refiere a hacer vibrar u oscilar el objeto, aumentando su frecuencia de vibración, utilizando su frecuencia de resonancia, utilizando vibradores piezoeléctricos en lugar de mecánicos o combinando oscilaciones del campo ultrasónico y del electromagnético. |
|
19. Acción periódica |
Utilización de acciones periódicas o pulsatorias en lugar de una continua, o, si ya es periódica, cambiar su magnitud o frecuencia o utilizar las pausas para realizar una acción diferente. |
|
20. Continuidad de la acción útil |
Se refiere a hacer que todas las partes del objeto trabajen continuamente, eliminando las que no realizan un trabajo. |
|
21. Rapidez o salto |
Realización de un proceso o alguna etapa perjudicial a alta velocidad. |
|
22. Volver lo nocivo en un bien |
Utilización de factores perjudiciales para obtener efectos positivos, neutralización de una acción dañina con otra dañina o amplificación de un factor nocivo hasta el punto de que deje de serlo. |
|
23. Retroalimentación |
Introducción de la realimentación o si ya se usa, cambiar su magnitud o influencia. |
|
24. Intermediario |
Uso de un objeto o proceso intermedio, fusionar temporalmente dos objetos pero que sean fácilmente separables. |
|
25. Autoservicio |
Hacer que un objeto sea útil para sí mismo realizando funciones auxiliares, utilizar todos los recursos para mejorar el sistema. |
|
26. Uso de copias |
Utilización de copias simples y baratas de un objeto que no esté disponible o sea demasiado costoso o frágil, o sustituir un objeto, sistema o proceso por copias ópticas, infrarrojas o ultravioletas. |
|
27. Corta vida barata en vez de larga vida costosa |
Reemplazo de un objeto caro con muchos baratos que puedan cumplir la misma función. |
|
28. Reemplazo de principio mecánico |
Sustituir medios mecánicos por otros como ópticos, acústicos, térmicos… |
|
29. Neumática e hidráulica |
Uso de gases o líquidos como partes del objeto o sistema en lugar de partes sólidas. |
|
30. Cubiertas flexibles y películas delgadas |
Utilización éstas en lugar de estructuras tridimensionales, o utilizarlas para aislar el objeto o alguna de sus partes del ambiente. |
|
31. Material poroso |
Hacer objetos porosos o agregarles elementos porosos, o si ya lo son, utilizar estos poros para introducir una sustancia o función útil. |
|
32. Cambio de color |
Cambio del color o la transparencia de un objeto o su entorno. |
|
33. Homogeneidad |
Hacer los objetos que interactúan del mismo material o de materiales con propiedades idénticas.
|
|
34. Desechar y recuperar |
Descartar disolviendo o evaporando las partes del objeto que ya hayan cumplido su función, restaurar las partes consumibles de un objeto. |
|
35. Cambio de parámetros |
Cambio del estado de agregación, la concentración, la consistencia, el grado de flexibilidad o la temperatura del objeto. |
|
36. Transiciones de fase |
Utilización de fenómenos físicos que están asociados a cambios de fase. |
|
37. Expansión térmica |
Utilización de la expansión térmica de los materiales o si ya se utiliza, utilizar materiales con coeficientes de expansión térmica diferentes. |
|
38. Fuertes oxidantes |
Sustitución aire corriente con aire rico en oxígeno o incluso con oxígeno puro, exponer el aire o el oxígeno a radiación de ionización, utilizar oxígeno ionizado o sustituirlo por ozono. |
|
39. Atmósfera inerte |
Utilización gases inertes en lugar de aire o añadir partes neutras o aditivos al objeto. |
|
40. Materiales compuestos |
Utilización materiales compuestos. |
Por otra parte, se tienen los cuarenta principios inventivos que se van a aplicar para resolver las contradicciones:
La herramienta que se utiliza para relacionar los parámetros con los principios inventivos es la matriz Triz. Se trata de una matriz de dimensiones 39x39, correspondientes con los parámetros inventivos. En las filas se consideran los parámetros que mejoran y en las columnas los que empeoran. Se completa la matriz rellenando la casilla que relaciona ambos parámetros con los números correspondientes a los principios inventivos que podrían servir para eliminar esa contradicción.
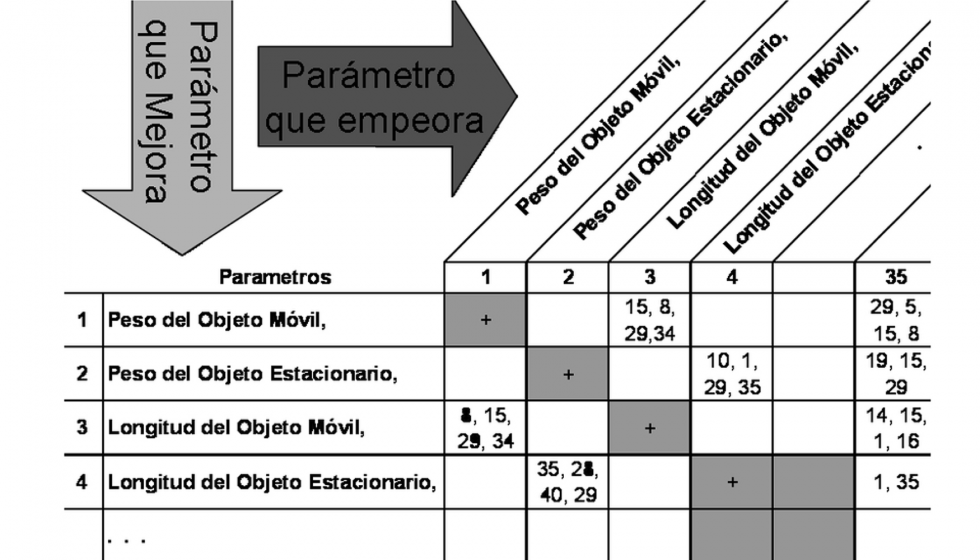
Para crear la matriz en el caso de la prótesis de cadera, se comienza identificando los parámetros ingenieriles que son aplicables a este proceso de diseño. Como se trata de parámetros generales, algunos como la intensidad de la iluminación o la pérdida de información, no tienen sentido aplicados a un implante. Eliminando estos parámetros se tiene una matriz de 26x26.
Como el tamaño de esta matriz no resulta fácil de manejar, se va a rellenar primero marcando con una X las casillas de los parámetros en los que se produce una contradicción.
Nos vamos a centrar solo en los parámetros que más interesan para la mejora del diseño. En un implante lo que se busca es que el objeto sea lo más similar posible a la parte del cuerpo que sustituye, para que así pueda adaptarse y realizar su función de forma eficaz. Así, se buscará que el implante diseñado sea compatible con el cuerpo, resistente, que pueda transmitir la fuerza al hueso y que al mismo tiempo sea ligero. También es imprescindible que sea duradero, pues uno de los principales objetivos es que la persona que reciba la prótesis no tenga que someterse a más de una intervención quirúrgica.
Aislando las columnas de la matriz que se refieren al peso, se puede observar que existen varias contradicciones con otros de los parámetros que nos interesa mejorar en la prótesis.
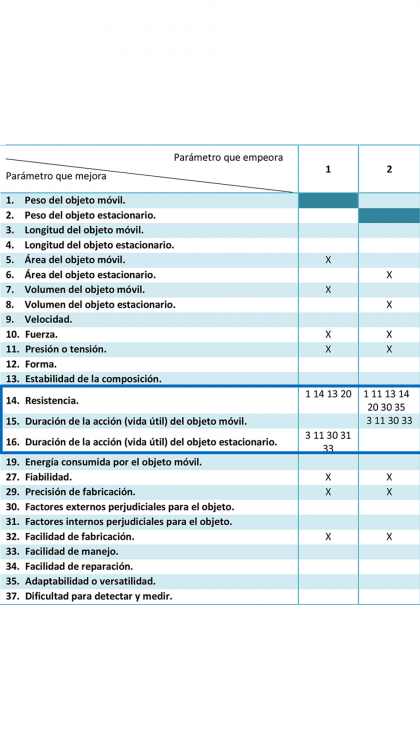
Se tiene una contradicción del peso con respecto a la resistencia, porque para reducirlo la forma inmediata sería disminuir el tamaño del objeto, lo que haría que las fuerzas y presiones estuvieran concentradas en un área más pequeña. Esto reducir la resistencia y hacer que la prótesis dure menos tiempo en buenas condiciones. Otra opción para reducir el peso sería usar un material muy ligero, pero esto en principio también resultaría en una peor respuesta ante las cargas.
Teniendo en cuenta esto, los principios inventivos que se podrían aplicar son:
- Segmentación: la prótesis estará dividida en dos partes diferenciadas, lo que facilitará su diseño e implantación. Será más fácil escoger el material adecuado y darle el mejor diseño para reducir el peso.
- Calidad local: cada una de las piezas tiene una función diferente y está sometida a esfuerzos distintos, por lo que su diseño debe ser adecuado a esto. Que cada región esté pensada para la función específica que desarrolle mejorara su funcionamiento y hará que sea más duradera.
- Protección previa o compensación anticipada: en el caso de la prótesis se le puede aplicar a los materiales protecciones anticorrosión. Además, también pueden aplicarse recubrimientos a las partes sujetas a desgaste para protegerlas. Esto aumenta la durabilidad de la prótesis.
- Inversión: el principio de la inversión de las partes no tiene sentido al aplicarla al diseño de la prótesis.
- Esfericidad: las formas curvas ayudan tanto a ahorrar material, reduciendo así el peso, como a que no se acumulen tensiones, con lo que hacen a la pieza más resistente.
- Continuidad de la acción útil: en el caso de la pieza que se está diseñando no hay ninguna parte que pueda ser omitida, todas trabajan.
- Cubiertas flexibles y películas delgadas: se pueden utilizar para dar recubrimientos que aumenten la dureza o que ayuden a la fijación de la prótesis, aumentando su duración.
- Material poroso: la agregación de una capa porosa a la parte de la prótesis en contacto con el vástago puede ser un concepto clave para la fijación. Además, los poros dan a posibilidad de introducir alguna sustancia química que también contribuya a la estabilidad del implante.
- Homogeneidad: como se tienen varias piezas en un ambiente muy corrosivo, es importante la homogeneidad de estas para evitar reacciones de corrosión que disminuyan sus propiedades mecánicas o desprendan elementos tóxicos.
- Cambio de parámetros: algunos parámetros como el estado de agregación o la temperatura del objeto no se pueden cambiar. Sin embargo, si se puede modificar el interior del objeto, haciéndolo hueco en lugar de macizo. Utilizando un material lo suficientemente resistente y un espesor de pared adecuado, se puede dejar la parte interior de la cabeza de la prótesis vacía, con el consiguiente ahorro de material y de peso.
Diseño de CAD
La prótesis de cadera diseñada estará constituida por el implante acetabular o cotilo y por el implante femoral. Este último va a ser modular, es decir, que será un conjunto formado por dos piezas:
- El vástago
- La cabeza y cuello de la prótesis
Se ha decidido separar el implante femoral de esta forma por varias razones:
• Geometría de la articulación
Las dimensiones de la articulación pueden variar de manera significativa de una persona a otra. Algunos aspectos como la longitud del cuello femoral o los diferentes ángulos que éste forma con el fémur son decisivos a la hora de diseñar el implante. Teniendo dos piezas se puede escoger cada parte de manera independiente, lo que hace más fácil la elección de elementos de medidas adecuadas para cada paciente y aporta más flexibilidad.
• Implantación
A la hora de colocar la prótesis en el interior del cuerpo y especialmente en la inserción del vástago en la cavidad femoral, el hecho de tener dos piezas independientes a porta una mayor maniobrabilidad al cirujano que realice la intervención quirúrgica.
• Revisión
En el caso de que en la prótesis se produzca algún fallo en la cabeza femoral, bien por desgaste excesivo de las superficies articulares o por un impacto, se puede sustituir sólo la parte superior. Esto hace que la cirugía sea más sencilla, ya que evita tener que remover el vástago si éste se encuentra adecuadamente fijado. Este aspecto es importante porque conseguir la buena fijación del vástago es muy complicado y quitarlo resulta muy costoso para el cirujano y doloroso para el paciente.
Selección de los materiales
En la selección de los materiales adecuados para la fabricación de la prótesis de cadera, las restricciones más importantes y comunes a todos los elementos de la prótesis son las siguientes:
- Biocompatibilidad
- Resistencia a la corrosión
- Ligereza
- Esterilización
- Alta resistencia mecánica y tenacidad
- Resistencia a la fatiga
- Buena tenacidad a la fractura
- Facilidad de mecanizado
Para el caso de la pieza que constituye el vástago femoral también se tienen:
- Buena transmisión de esfuerzos al hueso
- Rugosidad superficial que facilite la adherencia con el hueso
Para la pieza de la cabeza de la prótesis hay que añadir una característica muy importante que es un bajo coeficiente de fricción y buena resistencia al desgaste. También se debe tener en cuenta si el material escogido para esta parte ofrece la posibilidad de aplicar algún tipo de recubrimiento o tratamiento superficial que mejore las propiedades tribológicas.
Considerando estos requerimientos, se puede concluir que el material biocompatible buscado debe ser un metal, pues tienen propiedades mecánicas superiores a los polímeros y cerámicas. Los polímeros no llegan a las características de resistencia mecánica que se requieren. En cuanto a las cerámicas, aunque algunas tienen un buen comportamiento a compresión, a tracción no sucede lo mismo. Además, todas presentan una gran fragilidad, que ha sido la causa de su fallo cuando se han utilizado para este tipo de aplicaciones estructurales.
Teniendo en cuenta que se va a utilizar un metal y que las dos piezas van a estar en contacto directo, lo más seguro será escoger para ambas el mismo. Si se escogieran metales distintos y con el ambiente tan corrosivo que constituye el interior del cuerpo humano, serían muy susceptibles a la corrosión galvánica.
Análisis por elementos finitos
Para comprobar si el diseño de la cabeza femoral hueca aguantaría los diferentes esfuerzos a los que está sometido un implante de cadera, se va a realizar un análisis por elementos finitos utilizando el software Solid Edge ST9. Con esta herramienta se podrán localizar las zonas de mayores tensiones y evaluar si necesitan ser reforzadas. También se verán las zonas en las que las tensiones son pequeñas y se podría recortar material, disminuyendo así el peso de la prótesis y su coste.
Lo más importante de este análisis será la observación del nivel tensional que se produce en la cabeza femoral hueca. Así, comprobaremos si el grosor de la pared es suficiente o si es conveniente aumentarlo para tener mayor seguridad. Para la definición de las condiciones de contorno se necesita escoger ciertas zonas o puntos como fijos. Se va a establecer el saliente al final del cuello femoral como parte fija, ya que en la realidad éste iría unido al vástago de la prótesis. Sin embargo, en la interpretación de los resultados habrá que tener en cuenta que no sería realmente fijo, ya que se moverían, junto con el vástago de la prótesis, al producirse movimiento del fémur y de la articulación de la cadera. Se vería afectado por factores como la actividad o la postura de la persona. El material para el cual se va a realizar este análisis es la aleación de titanio biocompatible Ti-6Al-7Nb, que tiene las siguientes propiedades mecánicas:
|
Densidad |
Módulo de Young |
Límite elástico |
Tensión de rotura |
Coeficiente de Poisson |
Elongación |
|
> 4.53 g/cm3 |
100 GPa |
895 MPa |
984.5 MPa |
0.35 |
10% |
Una vez definidas las condiciones de contorno y el material, queda por decidir la carga que se va a aplicar. Para esto, tenemos en cuenta que la máxima resultante sobre la superficie articular de la cabeza femoral es casi 9 veces el peso y se da para carrera o salto. Esta fuerza va a estar soportada por la superficie de la cabeza que está en contacto con el cotilo. Suponiendo que dicha superficie es aproximadamente la mitad superior de la cabeza femoral y suponiendo un peso de 80 kg, se tiene que la presión media sobre la cabeza femoral es de 1,43 MPa. En las diferentes posiciones de la cadera, se darán diversas situaciones en las que la presión esté concentrada sobre un área más pequeña, además de que el peso podría ser mayor. Teniendo en cuenta estas circunstancias y que en una pieza que se va a introducir en el cuerpo se busca un margen de seguridad elevado, se va a realizar el análisis del comportamiento de la cabeza hueca sometiéndola a una presión uniforme de 5 MPa. Este valor es ampliamente superior a la tensión a la que trabaja una cabeza femoral en condiciones normales.
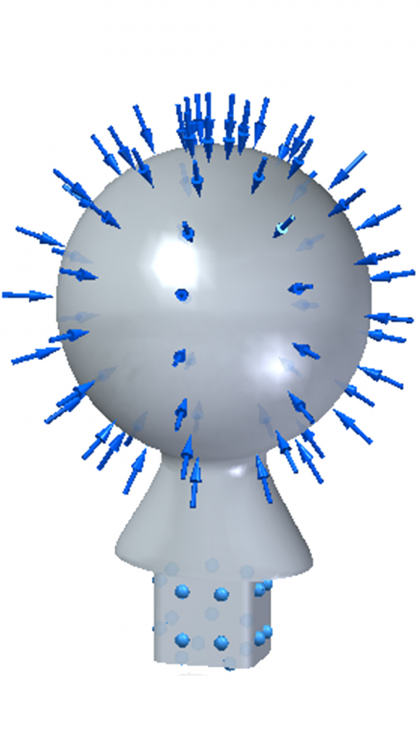
Con estas condiciones de contorno y de carga, y con un mallado tetraédrico de 0,78 mm se obtienen los siguientes resultados:
- Nivel tensional
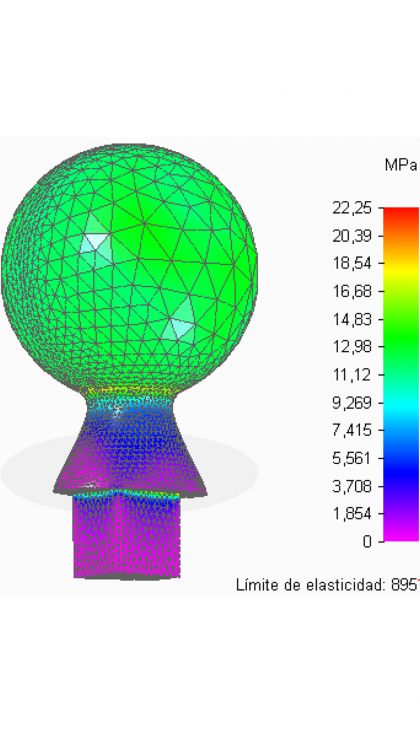
En esta figura se puede observar el nivel de tensiones de Von Mises que se produce en la pieza. Encontrándonos en la superficie esférica de la cabeza con valores máximos cercanos a 12 MPa. Los más elevados se tienen en la intersección del elemento de unión y el cuello.
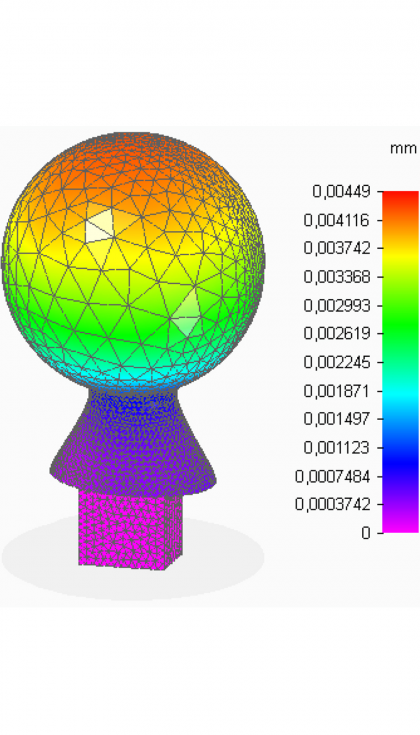
- Desplazamientos
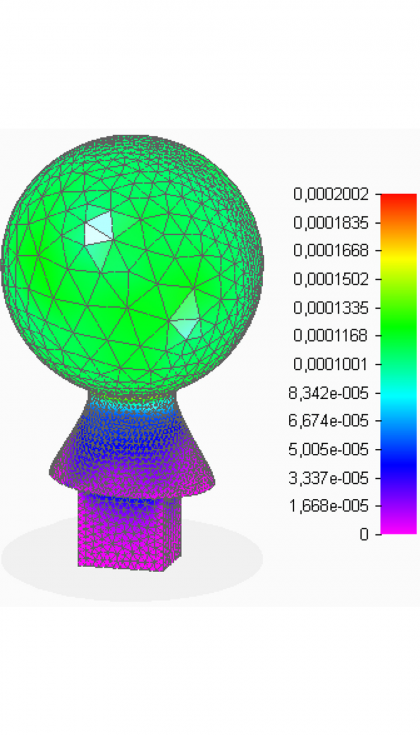
- Deformaciones
En el análisis se observa que la zona de unión con el vástago es la de mayor nivel tensional y de deformación. Esto se debe principalmente a las condiciones de contorno establecidas que, como ya se ha comentado, no son precisas. En la prótesis implantada gran parte de los esfuerzos se transmitirían a la otra pieza. Aun así, los valores que se dan en este caso están muy por debajo de los límites del material.
En la cabeza femoral, que es la parte de mayor interés, se observa que las tensiones no alcanzan valores elevados con respecto a los que el material es capaz de soportar. Además, los desplazamientos, aunque resultan máximos en la zona de contacto directo con el cotilo, también son muy pequeños. Por otra parte, las deformaciones tienen valores muy reducidos, en todos los puntos de la pieza son menores que una micra. Con estos resultados, se concluye que el espesor de 3 mm aportado a la superficie esférica es suficiente para que ésta realice sus funciones de forma fiable. Como se tiene la cabeza femoral hueca, ahora que se va a valorar la posibilidad de introducir en su interior medicación.
Prototipado
En el proceso de diseño de cualquier dispositivo, es necesaria la fabricación de prototipos, pues es la forma más eficaz de comprobar si el diseño realmente funciona de la forma que se espera y cumple con los objetivos fijados inicialmente. Así, se puede analizar mejor el objeto diseñado y plantear las mejoras que se consideren necesarias. Como fabricar una prótesis con biomateriales no está al alcance de nuestros recursos, se ha optado por imprimir el vástago, la cabeza femoral y el cotilo con una impresora 3D. El material con el que trabajan las impresoras 3D disponibles es un polímero denominado PLA. Se trata de un termoplástico que se fabrica mediante un proceso de polimerización del ácido láctico. Se utiliza principalmente cuando se quieren obtener impresiones de larga duración. Algunos detalles del modelo detallado anteriormente, se consiguieron gracias a la fabricación de un prototipo inicial que permitió identificar ciertos errores:
- Mal ajuste en la unión entre en vástago y a cabeza
- Ángulo de giro demasiado pequeño
- Aristas vivas

La fabricación con impresor a 3D tiene ciertas limitaciones, cuando deposita los filamentos éstos se extienden en la superficie. Por esta razón, las medidas diseñadas en el CAD no son exactamente las que se obtienen con la impresora. Este es el motivo de que las dimensiones de la unión entre la cabeza y el vástago no fuesen correctas. Para la fabricación se deben tener en cuenta las tolerancias, realizando un test para escoger el ajuste adecuado y modificando de forma pertinente el modelo de CAD. El cuello femoral diseñado inicialmente contaba con unas dimensiones excesivas, lo que limitaba el ángulo de giro de la cabeza con respecto al cotilo. La corrección de este problema consistió en estrechar ligeramente dicho cuerpo.
Por último, al imprimir el diseño se observó que éste contaba con algunas aristas sin redondear. Éstas, además de funcionar como concentradores de tensiones, son un lugar susceptible a ser atacado por microorganismos una vez la prótesis esté implantada. Por tanto, se les ha dado un acabado en redondo para que la pieza sea adecuada para ser introducida en el cuerpo humano.
Administración de fármacos a través de la prótesis
Cuando se introduce en el cuerpo un objeto externo como un implante, se provoca una respuesta inflamatoria por parte del tejido que está en contacto con él. Esto provoca que el paciente sufra dolores en el periodo postoperatorio. En el caso de la prótesis de cadera, tanto los huesos como el resto de tejido articular sufrirán cierto grado de inflamación tras la intervención quirúrgica. Por tanto, en el periodo de recuperación es necesario el suministro de fármacos antiinflamatorios y analgésicos. La forma más común de suministro medicación es por vía oral o intravenosa. En estos casos, se introducirá en el cuerpo una cantidad determinada teniendo en cuenta el peso del paciente, pues la sustancia se repartirá por todo el cuerpo hasta llegar a la zona en la que realmente actúa. Llega a esta parte del cuerpo en una concentración mucho más reducida de la que fue administrada.
Sin embargo, cuando los fármacos son administrados localmente, esto no ocurre: el medicamento se aplica directamente a la zona en la que va a actuar, por lo que la cantidad que se necesita administrar es menor. La menor dosis también implica menor riesgo de padecer alguno de sus efectos secundarios y menor intensidad si se produjesen. Esto resulta importante en este caso ya que los analgésicos que se suministran para el dolor son fármacos con fuertes contraindicaciones. Además, la aplicación de cualquier medicamento directamente en la zona en la que se encuentra el problema a tratar, consigue un resultado más rápido y eficaz. Por estas razones, resulta interesante la posibilidad de aplicar la sustancia que actúa contra el dolor o la inflamación de forma directa en su foco.
Esta idea es la que lleva a que en algunas ocasiones se implante durante la artroplastia de cadera una sonda a través de la cual se introducirán posteriormente diversos fármacos. Pero este sistema es incómodo para el paciente y supone que, acabado el postoperatorio, habrá que retirarlo. La solución que se propone en este trabajo es aprovechar el espacio hueco en el interior de la cabeza femoral de la prótesis de cadera diseñada para acumular el medicamento, introducirlo en el cuerpo y liberarlo de forma progresiva. De esta manera, si mediante la prótesis se introducen sustancias que ayudan a reducir la inflamación y el dolor, se aumentaría la comodidad del paciente durante la recuperación y ayudaría a que ésta fuese más rápida.
La utilización de implantes para la liberación local de fármacos no suele utilizarse de forma habitual porque implica tener que realizar una intervención quirúrgica para introducirlo y, en algunas ocasiones, otra para retirarlo. Esto supone someter al paciente a riesgos de infección, entre otros. Sin embargo, en el caso de este implante de cadera no se tienen estos problemas porque la realización de la operación ya es necesaria y, una vez que los fármacos hayan salido de la cabeza femoral hacia el interior del cuerpo, la prótesis realizará su función con normalidad. Además, los analgésicos y antiinflamatorios no son los únicos fármacos cuya aplicación directa en la cadera sería útil, también se podría utilizar la cabeza femoral para introducir antibióticos. Tras la artroplastia de cadera existe riesgo de infección, que puede ser superficial o profunda. La infección superficial se puede prevenir mediante el cuidado y limpieza de la herida y, en el caso de que se produzca, es relativamente fácil de detectar por observación y de tratar con antibióticos. El caso de la infección profunda es más complicado, ya que se produce en el interior del cuerpo, en concreto en la zona alrededor de la prótesis. Este tipo de infección es más difícil de detectar cuando está comenzando y en muchos casos acaba suponiendo la necesidad de una segunda intervención porque el dispositivo protésico se ve afectado. Por esta razón, también se suministran antibióticos a los pacientes durante un cierto periodo de tiempo después de haberse sometido a una artroplastia de cadera.
Al igual que en el caso de los analgésicos, se suministra una dosis que se repartirá por todo el cuerpo y de la cual solo una pequeña parte llegará a la zona de interés.
Por tanto, la llegada de los antibióticos directamente a la parte del cuerpo susceptible de sufrir una infección puede marcar una gran diferencia.
Fabricación de la prótesis
El proceso más común de conformación de materiales de titanio es el moldeo en una atmósfera inerte. Esto se debe a que este elemento tiene una gran reactividad con el oxígeno, el nitrógeno y el hidrógeno. La incorporación de estos elementos produciría un aumento muy brusco de la resistencia mecánica y un descenso muy importante en la ductilidad, adquiriéndose un comportamiento frágil. Por tanto, los tratamientos térmicos a los que puede ser sometido el material, como la sinterización de esferas sobre el substrato para las prótesis de recubrimiento poroso, deben realizarse en vacío o con atmósfera controlada de gas noble. Para aplicaciones como la que se está tratando en las que se necesitan muy buenas propiedades mecánicas, se realiza el forjado del material tras el moldeo. El titanio es muy difícil de trabajar en frío, por lo que se suele forjar en caliente a unos 950 °C.
Por otra parte, un aspecto muy importante de la fabricación es la mecanización de la prótesis, que debe tener un acabado preciso para evitar picaduras, grietas y restos de material no deseado. Estas formas de fabricación son válidas para el vástago y la pieza acetabular del diseño tratado. Sin embargo, surgen problemas con la fabricación de la cabeza de la prótesis, por ser esta hueca. De entre los diseños propuestos de cabeza con posibilidad de portar medicación, la primera alternativa sí que podría ser fabricada mediante moldeo. Se podría introducir algún tipo de resina que funcionase como un molde para la forma hueca interior y luego sacarla a través del orificio que tiene la cabeza para la salida del medicamento. Para la segunda alternativa, en la cual se tiene la cabeza metálica con el hueco interior dividido en tres partes, esta forma de elaboración sería imposible. En este caso se requiere un método de fabricación por impresión 3D.
Tratamientos y recubrimientos
Independientemente de la forma de fabricación de la cabeza de la prótesis, las propiedades de fricción de la aleación de titanio no son suficientemente buenas para una superficie articular. Por eso se les tendrá que aplicar algún tratamiento de endurecimiento para aumentar su resistencia al desgaste, se comentarán las alternativas a continuación. De la misma manera, al vástago femoral hay que darle el acabado poroso y la capa de hidroxiapatita, para que se pueda fijar al hueso.
Tratamientos de endurecimiento
Los principales tratamientos para la mejora de las propiedades superficiales del material son:
- Implantación iónica
- Deposición en fase vapor
- Recubrimientos por proyección
- Tratamientos por láser o por difusión
El método de deposición en fase vapor no está extendido para substrato de titanio, ya que sobre ellas presentan habituales problemas de adhesión. En cuanto a los tratamientos por láser, presentan los inconvenientes de que en su implementación se puede formar porosidad en la capa fundida, grietas y se obtiene una elevada rugosidad superficial. Por otra parte, la difusión conlleva la elevación del material a temperaturas superiores a 800 °C y su mantenimiento un cierto tiempo. Esto puede llevar a la modificación de otras propiedades del material. Por estas razones, la implantación iónica es la técnica comercialmente más empleada para mejorar la resistencia al desgaste del titanio y sus aleaciones. Consiste en la implantación de iones de nitrógeno y carbono para aumentar la dureza superficial y así el comportamiento al desgaste. El endurecimiento superficial es consecuencia de las tensiones residuales de compresión debido a la formación de una fina dispersión de precipitados de TiN en una matriz rica en nitrógeno. Esta es la técnica más adecuada para conseguir que la superficie de titanio de la cabeza femoral tenga un mejor comportamiento frente a fricción y desgaste.
Aplicación del recubrimiento poroso y bioactivo
Para aplicar estos recubrimientos protésicos se tienen varios métodos, que dan lugar a superficies de distintas características:
- Sinterización: Este proceso consiste en la utilización de calor para unir las bolas que conforman el material poroso entre sí y a una base sólida, que en este caso es el vástago femoral. La porosidad obtenida se controla con el tiempo y la temperatura del proceso. Estos parámetros determinan las características de la unión, cuanto mayor sean, más fuerte y de mayor densidad será la unión resultante. La superficie porosa por este proceso tiene un tamaño de poro entre 150 y 300 micras y alrededor de 30% de porosidad.
- Difusión: En la difusión se utiliza una almohadilla de malla fibrosa de Titanio para crear la porosidad. Las almohadillas están hechas de Titanio puro y se aplican sobre una aleación de Titanio. Se construyen las mallas cortando alambre de Titanio puro en filamentos, enroscándolos y después poniéndolos en un molde, donde son presionados para darle forma. Las almohadillas son colocadas en las áreas y sinterizadas al sustrato. De este proceso se obtiene un área de revestimiento poroso con un tamaño medio de poro de 350 micras. Se producirá el crecimiento óseo por los espacios vacíos de la malla metálica, de manera que los filamentos ocupan los espacios intertrabeculares.
- Espuma plasmática: Consiste en la fundición de material en polvo y su posterior rociado sobre una superficie lisa, dando lugar a porosidad. Se trata de pulverizar el material de revestimiento, que normalmente es titanio en polvo, sobre el sustrato de la superficie, que también es de titanio. En el spray hay polvo de titanio en estado de plasma y gas presurizado. La atmósfera, temperatura y presión a la cual se aplican las partículas afectan a la textura del producto acabado. Las prótesis que utilizan este proceso tienen superficies irregulares con porosidad entre el 30-40% y con tamaño de poro entre las 50 y 200 micras.
En lo referente a la biología del crecimiento óseo por invasión, no hay grandes diferencias en la invasión entre los recubrimientos obtenidos de una forma u otra, por lo que esto no será un criterio de selección. Un factor que hay que tener en cuenta a la hora de elegir el recubrimiento es que el proceso de sinterización requiere una gran elevación de temperatura (entre el 90 y el 95% de la de fusión) y las propiedades del metal base del vástago podrían sufrir modificaciones por cambios estructurales. Esto supone una gran disminución de la resistencia a la fatiga en las aleaciones de Ti, puede llegar a perder dos tercios de ésta. Por esta razón se descarta la sinterización para este diseño. Entre las otras dos opciones, la más adecuada será la difusión debido a que permite un mejor control de las características del recubrimiento. Con la aplicación del método de espuma plasmática se obtiene un resultado irregular. Teniendo en cuenta que de este recubrimiento depende en buena medida el éxito de la prótesis a largo plazo, no es una opción adecuada.
Aunque en la difusión se requiere un aumento de temperatura, ésta se mantiene por debajo de valores en los que se producen transformaciones térmicas en el material. Con este método el tamaño de poro obtenido se encuentra dentro del margen adecuado para que puedan desarrollarse las células óseas en su interior y el porcentaje de porosidad se puede controlar mediante la cantidad de filamentos de titanio de la malla de partida. Cuando se tiene este recubrimiento poroso, se procede a aplicar el bioactivo, que en este caso es la hidroxiapatita. Se aplica después porque se busca que esté en contacto directo con el hueso y porque la rugosidad superficial ayuda a que quede fijada mecánicamente. Para su aplicación se requiere la utilización de tecnología de superficies. El método más utilizado en la industria para recubrir prótesis es la proyección térmica por plasma atmosférico (APS) o al vacío (VPS).
Este método consiste en la producción de plasma de fosfato de calcio mediante potentes fuentes energéticas y su posterior proyección sobre el substrato metálico. Se proyecta a temperaturas superiores de 9.000 °C en aire o en vacío. La técnica al vacío ofrece la posibilidad de variar la rugosidad y porosidad del implante. La microestructura de los recubrimientos de HA varía dependiendo de la técnica utilizada en su fabricación. En este proceso, al proyectar las partículas de HA a gran velocidad y temperatura, adoptan una forma esferoidal más o menos aplanada tras su impacto con el implante. Estas formas determinarán la porosidad de la capa de recubrimiento, que representa la presencia de pequeños huecos por donde pueden proliferar los osteoblastos para integrar el implante.
También se tienen otras técnicas de aplicación como ablación láser o compactación isostática en caliente, pero son técnicamente más complicadas y caras.
Por tanto, la mejor opción para que el recubrimiento no eleve demasiado el coste de la pieza es su aplicación por método de plasma spray.
Resultados y discusión
Como valoración del resultado final, se puede decir que se ha realizado un diseño de masa reducida y, por tanto, menor carga estática. Esto se ha conseguido haciendo hueco uno de los elementos de la prótesis de cadera, lo que se ha aprovechado para plantear la posibilidad de introducir en dicho hueco un sistema de suministro directo de medicación a la articulación. Con esto, se consigue el objetivo de hacer que la adaptación del paciente al implante sea más cómoda y rápida y se reduce el riesgo de infección.
El resto de elementos de los que está compuesta la prótesis de cadera también han sido estudiados y diseñados de forma que cumplan sus funciones y encajen en el cuerpo. También se ha tenido en cuenta que sus características encajen con las novedades introducidas. En la cuestión del diseño de la pieza que porta la medicación, se han planteado tres alternativas, que podrían ser utilizadas indistintamente sin cambiar el resto de elementos de la prótesis. Con estos diseños se ha logrado aportar flexibilidad a la opción de la introducción de medicación, pudiendo introducir uno o varios fármacos. Además, con las diferentes alternativas de diseño se busca tener varias opciones que permitan la elección de una u otra dependiendo de los medios de fabricación que se tengan al alcance y del presupuesto del que se disponga.
Conclusiones
A lo largo de este trabajo se ha realizado el proceso de diseño de una prótesis de cadera, introduciendo la novedad de que su parte superior será hueca. Así, no solo se reduce la carga estática del dispositivo, sino que se dispone de un espacio que se va a aprovechar para portar medicación. Aunque este trabajo presta especial atención a la novedad introducida, se ha procurado cubrir todos los aspectos del diseño de la prótesis. Se ha realizado un estudio del funcionamiento de la articulación y de los diferentes aspectos destacables de las prótesis de cadera, así como de los materiales aptos para ser introducidos en el interior del cuerpo. Considerando esto se ha realizado un diseño de cada una de las partes y se ha escogido el material que se ha considerado más adecuado. Un aspecto que ha servido para mejorar ciertos detalles de la prótesis ha sido la fabricación de un prototipo mediante una impresora 3D. Se imprimieron el vástago femoral, la cabeza y el cotilo. Tener los objetos reales permite detectar detalles que pasan desapercibidos en el CAD. En cuanto al diseño hueco, se ha realizado un análisis por elementos finitos para comprobar que se tomaron las medidas adecuadas para que éste aguante las cargas en la articulación. Una vez que se ha comprobado que el modelo es viable, se ha pasado a considerar la posibilidad de introducir fármacos en el espacio que se ha dejado libre al reducir la masa. Tras estudiar los diversos beneficios de la administración local de fármacos, se han propuesto varias soluciones para la salida del medicamento desde el interior del dispositivo hacia el cuerpo. Las alternativas se han diseñado para que se tenga la opción de aplicar uno o varios fármacos y para que se pueda elegir un modelo u otro dependiendo de los medios de fabricación que estén disponibles.
Con estos diseños se pretende conseguir que la prótesis sea más liviana y facilitar la adaptación del cuerpo a ella, así como aumentar la comodidad del paciente y reducir el riesgo de infección. Con la posibilidad de administración directa de fármacos se aminorará el dolor durante el periodo de recuperación utilizando menor cantidad de medicamentos y se disminuirá la probabilidad de que se produzca una infección.
A pesar de que se ha hecho un análisis de elementos finitos para comprobar que los modelos de pieza hueca diseñados soportan los esfuerzos, es cierto que también quedan aspectos por considerar. Para saber realmente si el modelo es viable habría que realizar ensayos para comprobar diversos aspectos de su funcionamiento como la resistencia y la lubricación que se da con las dimensiones y materiales escogidos.
Por otra parte, en este trabajo también se han estudiado las alternativas de fabricación disponibles, que varían para cada uno de los diseños propuestos. Se han comentado tanto el método principal como los tratamientos posteriores más desatacados. Se ha valorado cual sería la mejor opción, considerando las propiedades que proporciona cada método de fabricación y su precio. Por último, se han estudiado los métodos de esterilización, para comprobar que los materiales escogidos pueden someterse a ellos sin sufrir pérdidas de propiedades. También se ha expuesto el proceso de implantación en la prótesis, que no varía con respecto al de una prótesis de cadera convencional.
Referencias
[1] Alfaro, C. (10 de marzo de 2016). Actualidad de implantes de cadera. Recuperado el 9 de noviembre de 2016, de http://bioingenieriaudep.blogspot.com.es/: http://bioingenieriaudep.blogspot.com.es/2016/03/actualidad-de-implantes-de-cadera.html
[2] Álvarez, S. M. (2011). Anatomía de la Cabeza Femoral Humana: Consideraciones en ortopedia. Ciudad de Méjico: Facultad de Medicina, Universidad Nacional Autónoma de Méjico.
[3] Asociación Española de Normalización y Certificación. (s.f.). Buscador de normas. Obtenido de aenor.es: http://www.aenor.es/aenor/normas/buscadornormas/buscadornormas.asp?modob=S#.WnJqzKjibIU
[4] Consejo superior de Investigaciones Científicas. (s.f.). Aplicaciones de la Ciencia de Materiales a la Medicina. Instituto de ciencia de materiales de Aragón.
[5] Díaz, C. J. (2009). Tesis doctoral Estudio de la influencia de estabilidad primaria en el diseño de vástagos de prótesis femorales personalizadas: aplicación a paciente específico. Madrid: Escuela Técnica Superior de Ingenieros Industriales, UPM.
[6] Diego, J. M. (14 de diciembre de 2014). Soluciones para el mecanizado de implantes de cadera de cromo cobalto. Obtenido de https://www.interempresas.net/MetalMecanica/Articulos/129401-Soluciones-para-el-mecanizado-de-implantes-de-cadera-de-cromo-de-cobalto.html.
[7] Dr. Sumillera, M. (2016). Policarbonato uretano: un nuevo par de fricción en la prótesis de cadera. Obtenido de MBA INSTITUTE: http://www.mbainstitute.eu/recursos/doc/institute/20131213/cadera/experciencia-con-el-uso-de-tribofit.pdf
[8] Duque Morán, J., Navarro, R., Navarro García, R., & Ruiz Caballero, J. (2011). Pares de fricción en la artroplastia total de cadera (ATC): Parámetros tribológicos. Canarias médica y quirúrgica, 11.
[9] Ethier, C. R., & Simmons, C. A. (2007). Introductory Biomechanics, from cells to organisms. Cambridge.
[10] F.J. Gil, J. P. (s.f.). Aplicaciones biomédicas del titanio. Dept. Ciencia de los Materiales e Ingeniería Metalúrgica, ETS Ingenieros Industriales de Barcelona.
[11] F.J. Gil, M. G. (1999). Metales y acciones para la sustitución de tejidos duros. Barcelona: Universitat Politècnica de Catalunya.
[12] F.J. GIL, M. G. (1999). Metales y aleaciones para la substitución de tejidos. Dept. Ciencia de los Materiales e Ingeniería Metalúrgica, ETS Ingenieros Industriales de Barcelona.
[13] Gil-Murb, F., & Faig-Martía, J. (2008). Los recubrimientos de hidroxiapatita en las prótesis articulares. Revista Española de Cirugía Ortopédica y Traumatología, 8.
[14] Gómez-García, F. (2014). Tribología moderna en artroplastía total de cadera: pros y contras. Acta Ortopédica Mexicana, 17.
[15] Gutiérrez Limón, R. (2013). Materiales biocompatibles. Sus propiedades y características. http://www.monografias.com/usuario/perfiles/rosa_gutia_rrez_lima_n/monografias.
[16] Haduch, D. Z. (19 de diciembre de 2007). Biomateriales: características y aplicaciones. Obtenido de franciscoalavez.wordpress.com: https://franciscoalavez.wordpress.com/2007/12/19/biomateriales-caracteristicas-y-aplicaciones/
[17] Heisel, C., Silva, M., & Schmalzried, T. P. (2003). Pares de fricción alternativos para la artroplastia total de cadera en pacientes jóvenes. Obtenido de Asociación Zamorana de Traumatología y Cirugía Ortopédica: http://www.traumazamora.org/articulos/friccion/friccion.html#tribologia
[18] HXX. (12 de enero de 2016). Materiales de impresión 3D (IV): Metales en polvo. Obtenido de Blog de HXX: http://hxx.es/2016/01/12/materiales-de-impresion-3d-iv-metales-en-polvo/
[19] Knudson, D. (2007). Fundamentals of Biomechanics. Springer.
[20] Lario-Femenía, J., Amigó-Mata, A., Vicente-Escuder, Á., Segovia-López, F., & Amigó-Borrás, V. (2016). Desarrollo de las aleaciones de titanio y tratamientos superficiales para incrementar la vida útil de los implantes. Revista de Metalurgia, 13.
[21] López Conde, J. E. (2016). Impresoras 3D. Centro de Análisis y Prospectiva, Gabinete Técnico de la Guardia Civil.
[22] M., P. F. (2013). Esterilización. Sevilla: Facultad de Farmacia, Universidad de Sevilla.
[23] Maldonado, D. E. (3 de octubre de 2014). Recuperado el 9 de noviembre de 2016, de http://es.slideshare.net/: http://es.slideshare.net/leonardation/biomecanica-de-la-cadera-artrosica
[24] Margareta Nordin, V. F. (2003). Biomecánica básica del sistema musculoesquelético. Mcgraw Hill.
[25] Mendoza-Otero, F., Molina, O. G., & Palencia, M. A. (2013). Estudio de infusores elastoméricos utilizados en quimioterapia. Logroño: Universidad de la Rioja.
[26] Miguel, P. R. (s.f.). Tipos de prótesis de cadera. Obtenido de mba.eu: http://www.mba.eu/blog/tipos-de-protesis-de-cadera/
[27] Navarrete López, L. M. (2014). Materiales para prótesis internas. Universidad Técnica de Ambato, Ecuador.
[28] Pr. Muriel, D. S.-M. (2004). Sistemas de liberación de fármacos utilizados en el tratamiento del dolor. Madrid: Fundación Grünenthal España.
[29] Quintana, J., & Aguilar, G. (2010). Biomateriales aplicados en la medicina. Silicona. Méjico: Instituto Tecnológico de Chihuahua.
[30] Ráfales, D. J. (25 de febrero de 2015). Biomateriales para el par articular de las prótesis de cadera. Obtenido de www.interempresas.net: https://www.interempresas.net/MetalMecanica/Articulos/133682-Biomateriales-para-el-par-articular-de-las-protesis-de-cadera.html
[31] Rascón, D. A. (s.f.). Obtenido de slideshare: https://es.slideshare.net/FranciscoMarquez1992/ionmeros-de-vidrio
[32] Rubin P.J., L. P. (1992). The morphology of the proximal femur. The Journal of Bone and Joint Surgery, 5.
[33] Sánchez, S. (11 de Julio de 2016). Sinterizado directo de metal por láser. Obtenido de 3D natives: https://www.3dnatives.com/es/sinterizado-directo-de-metal-por-laser-les-explicamos-todo/
[34] SANTANA, D. C., PERAZA, D. B., NAVARRO, D. R., & CABALLERO, D. J. (2005). Anatomía y biomecánica de rodilla y cadera. Las Palmas de Gran Canaria: Hospital Universitario Insular de Gran Canaria.
[35] Servicio de traumatología y cirugía ortopédica. (s.f.). Reemplazo total de cadera. Obtenido de http://www.ripollydeprado.com/: http://www.ripollydeprado.com/ver/reemplazo-total-de-cadera
[36] The Titanium Information Group (TIG). (s.f.). Titanium Alloys -Ti6Al7Nb Properties and Applications. Obtenido de azom.com: https://www.azom.com/properties.aspx?ArticleID=2064.
[37] Universidad de Barcelona. (s.f.). http://www.ub.edu/cmematerials/es.
[38] Veau, B. L. (1991). Biomecánica del movimiento humano. En B. L. Veau, Biomecánica del movimiento humano. Trillas.
[39] Virginia Sáez, E. H. (2003). Sistemas de liberación controlada de medicamentos. Revista Iberoamericana de Polímeros, 20.