Una batería de litio-aire con la densidad energética de la gasolina
La nueva batería de litio-aire supone una buena noticia para el medio ambiente, porque tiene una densidad energética del 93,2% de la gasolina. Es fruto del trabajo realizado por muchos científicos de varios países, dirigidos por T.Liu et al. Funciona gracias a la creación de Li0H y su descomposición (Ver Science 29 de octubre 2015).
Uno de los retos de nuestra sociedad es el elevado consumo energético, con excesiva dependencia de la energía y los altos niveles de contaminación. En este sentido, el coche eléctrico es la apuesta más clara para un transporte libre de CO2.
La batería se puede recargar más de 2.000 veces. El Centro de Grafeno de la Universidad de Cambridge ha creado lo que consideramos la batería del futuro: con una densidad energética 10 veces mayor que la batería convencional de iones de Litio, de 150 a 200W.h/kg. La de litio-azufre llega a 350W.h. La nueva batería se podrá usar no solo en los automóviles, sino a gran escala para almacenamiento de la energía solar, una aplicación muy importante.
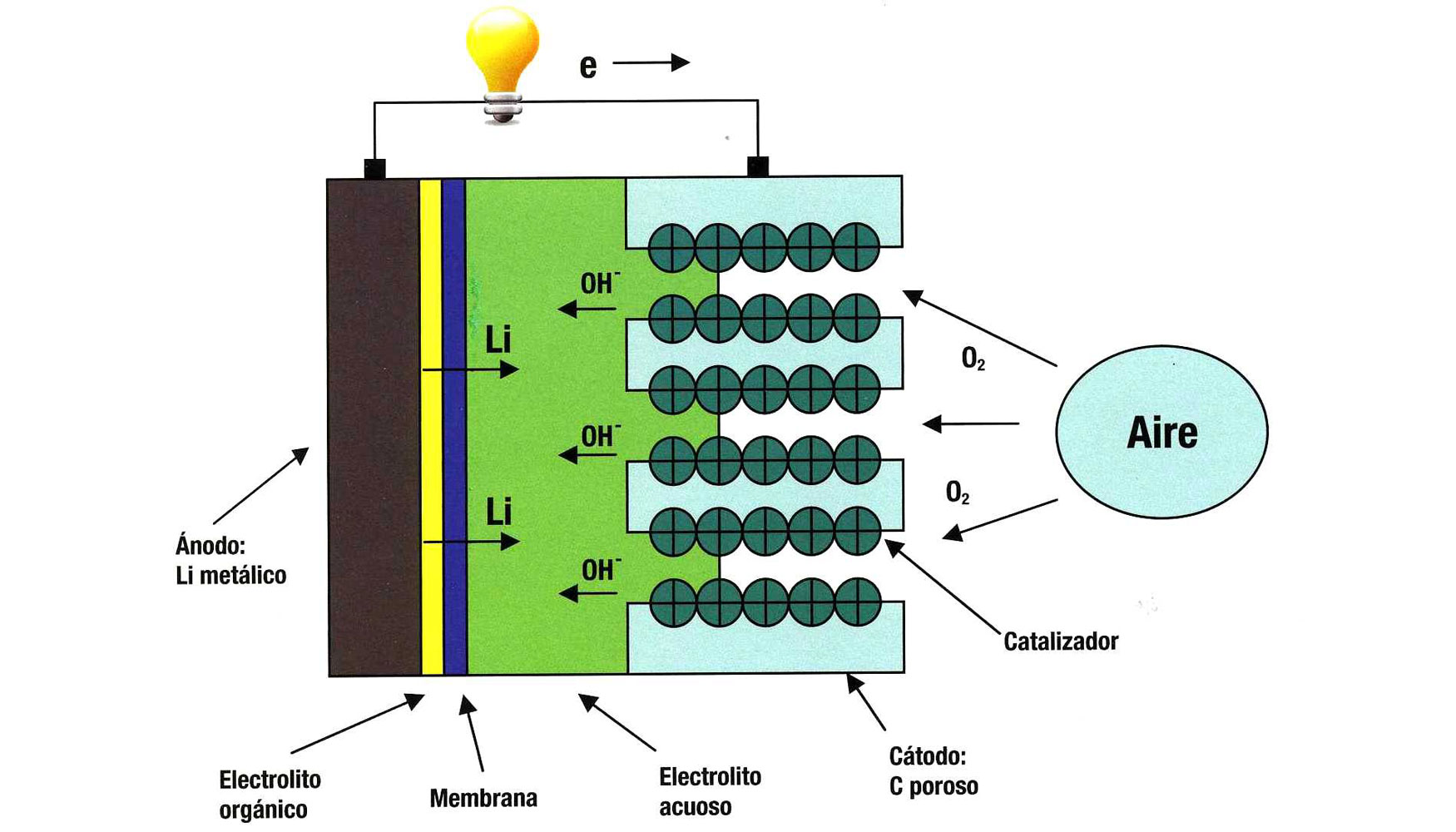
La nueva batería de litio-oxígeno (aire) tiene los 3 elementos clásicos: electrodo positivo (el metal litio), electrodo negativo de carbono-grafeno y electrolito no acuoso, que no reacciona con el oxígeno atmosférico. Utiliza la reacción del litio en el ánodo, y la reducción de oxígeno en el cátodo, para crear la corriente eléctrica (años atrás la batería de Li0H solo funcionaba con oxígeno puro).

Dispone de un cátodo altamente poroso de carbono-grafeno, que incluye láminas bidimensionales de un átomo de espesor, con algunos aditivos. El cátodo recibe los electrones de un circuito externo. El voltaje eléctrico oscila entre 1.5V y 3V.
La Universidad de Cambridge ha preferido el hidróxido de litio (Li0H), en lugar de peróxido de litio (Li202). Con agua y el ioduro de litio como mediador, la nueva batería es más estable en los ciclos de carga y descarga.
El ioduro de litio disminuye la resistencia interna de la nueva batería. Los investigadores han logrado en la carga-descarga reducir la diferencia de potencial a solo 0,2V, lo cual equivale a una eficiencia energética de 93.2V. El coste de la nueva batería es 1/5 del coste de la batería de Litio convencional, y el peso también representa solo 1/5 de la batería convencional. El elemento más importante es el electrodo muy poroso de grafeno del espesor de solo un átomo, bidimensional, y algunos aditivos.

En el electrodo de grafeno se evitan las fibras metálicas de litio, conocidas como dendritas, que pueden causar una explosión en la batería, si las dendritas crecen demasiado y pueden producir el cortocircuito. El aire atmosférico contiene además de oxígeno, dióxido de carbono, nitrógeno y humedad, que perjudican al electrodo metálico.
Los investigadores creen que pese a los resultados tan prometedores, la nueva batería experimental tardará todavía en fabricarse unos cinco años, o más, pasando a ser así un competidor viable de la gasolina. La tecnología electrónica cada año nos presenta nuevos productos cada vez más pequeños, más rápidos, con la notable excepción de las baterías.
En la batería de Litio convencional con iones el electrodo negativo es el grafito, y el positivo es un óxido de metal (óxido de litio-cobalto). Una sal de litio disuelta en un disolvente orgánico es el electrolito. Los iones de Litio se mueven entre los electrodos. La densidad de carga es relativamente baja, y hay que recargar con frecuencia. Su capacidad se deteriora con el tiempo pero una pérdida del 40% ya no es útil para el automóvil. Esta tecnología de litio-ión rinde una energía de 1500Wh/kg y cómo máximo se podrá duplicar.
Propiedades del litio
El litio es un sólido no magnético, que reacciona al agua, en la que flota por tener menos densidad ( 535kg/m3). En algunos casos emite luz, y reacciona violentamente produciendo gran cantidad de energía, una reacción que produce hidrógeno e hidróxidos. El litio tiene aspecto blanco plateado, y pertenece al grupo de los alcalinos (Li, Na, K, Rb, Ce y Fr). Lo descubrió J. Arfvedson. Se corroe rápidamente en contacto con el aire. En estado libre no se encuentra en la Naturaleza, sino solamente formando compuestos. El número atómico del litio es 3. Su punto de fusión es de 181,54 °C. Tiene un solo átomo de valencia +1 por átomo de Li en el orbital s. Es un metal blando y reacciona con la mayoría de los no metales.

Las salinas de los Andes de Bolivia, el salar de Uyuni, son las mejores reservas de litio del planeta. Separar la sal del litio es más económico que excavar litio de la roca. El Tibet y Chile también tienen minería de litio.
Su masa atómica es de 7,016 u, la forman protones y neutrones. Tiene un total de solo 2 electrones en una configuración de (He)2s1. Es una base fuerte con estructura química cúbica, centrada en el cuerpo (calor de fusión: 3kj/mol). Tiene una electronegatividad de 0.98 Pauling. El litio se encuentra en la composición de muchas estrellas. A partir de compuestos de litio se pueden crear fuegos artificiales y bengalas de color rojo. El litio se usa para absorber neutrones en la fusión nuclear. El peróxido de litio reacciona con el CO2 para producir oxígeno. El litio y sus hidruros se usan como aditivos energéticos para propulsión de cohetes.
























