La potente batería de litio-aire
La principal diferencia entre la bacteria Litio-ión y Litio-aire consiste en reemplazar el cátodo tradicional por el oxígeno atmosférico. Ha sido desarrollada por el Dr. Nobuyuki Imanishi, de la Universidad Mie de Japón. Los problemas entre el agua y el litio se han solucionado en parte con un electrolito de capas: un polímero membrana de alta conductividad y un electrolito sólido, que separa el electrodo litio del electrolito acuoso. El resultado ha sido una batería que almacena el doble de energía y pesa lo mismo que la batería Litio-ión. La capacidad de almacenamiento energético se mide en Vatios-hora/kg. (Wh/kg). La densidad de la nueva batería es de 300 Wh/kg; la de Litio-ión, sólo unos 150 Wh/kg. Se puede cargar y descargar 100 veces y tiene, de momento, una vida corta.
IBM en Almadén Institute, EE UU, está desarrollando la Litio-aire desde 2009, con autonomía de 800 km. La llama ‘Battery 500’, que respira como un pulmón. En el cátodo emplea finas láminas de carbono que absorben el oxígeno atmosférico. La energía eléctrica surge al combinar las moléculas de oxígeno con los iones de litio. La reacción es totalmente reversible: basta aplicar una corriente eléctrica (cargar la batería) para separar de nuevo el oxígeno y expulsarlo al exterior.
La validez de las baterías litio-aire ya se ha podido comprobar en el laboratorio; el problema es que todavía queda mucho por hacer. En primer lugar el litio podría incendiarse de modo violento al contacto con la humedad del aire, hace falta desarrollar nuevas membranas y electrolitos. ¿Cuándo llegarán al mercado esas nuevas baterías? Nadie se atreve a dar fechas. Básicamente durante la descarga de la batería, el oxígeno atmosférico reacciona con el litio, y forma el peróxido de litio. Al cargar la batería con energia eléctrica, se rompe el peróxido de litio en litio metálico y oxígeno, que regresa a la atmósfera.

Una historia de 44 años
La batería de litio-ión fue presentada en 1970 por el químico S.Whittingham. Le interesaba el litio, un elemento que permite gran densidad de carga (Relación energía/masa), que varía entre 160 y 300 Wh/kg, o sea, 9 veces mejor que la batería de plomo. Otros opinan que la densidad de carga supera el 10. Pero todavía queda lejos de los 10.000 Wh/kg de los combustibles líquidos. Gran capacidad de descarga, en cuestión de minutos. Tiene una tasa de autodescarga aceptable. Como toda batería tiene tres componentes: ánodo, cátodo y el electrolito.
El litio chileno
En la tabla de los Elementos de Dimitri Ivanovitch Mendeleviev no encontramos nada mejor para la batería. Su mejor cualidad, su potencial electroquímico: -3,05, el más negativo de todos los elementos. Tiene un electrón de valencia, que lo cede con facilidad, para formar un catión. Tiene dos isótopos, de peso 6 y 7. Con una densidad de 0,534 g/cm3. Es el más ligero de todos los elementos sólidos. Flota en los hidrocarburos. Expuesto al agua y al aire se enciende. Muy reactivo, incluso con gas nitrógeno a temperatura ordinaria. Es blando y se puede cortar con un cuchillo. Es relativamente abundante en el planeta en forma de compuestos. En la industria se obtiene por electrólisis de una mezcla de cloruro de litio y cloruro potásico. El país más productor de litio es Chile. Su precio no crea problemas.
Litio-Aire
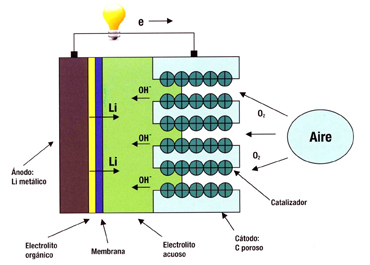
Esta nueva batería utiliza la oxidación del litio en el ánodo (polo negativo) y la reducción del oxígeno atmosférico en el cátodo (polo positivo), para inducir un flujo de corriente. En el ánodo hay peróxido de litio (batería descargada) y litio metálico (batería cargada). El litio metálico se convierte en iones litio y en electrones. Estos se dirigen por el circuito externo al cátodo de carbono poroso.
En el cátodo hay carbono poroso, de gran superficie. El oxígeno atmosférico, como material activo, entra y sale en los poros de carbono, pero éstos a veces se bloquean. No sabemos bien qué tamaño han de tener los poros, y cómo distribuirlos en el electrodo.
Estos iones-oxígeno circulan por el electrolito, el circuito interno, desde el cátodo de carbono al ánodo con iones de litio. Con los iones de oxígeno se forma óxido de litio, o peróxido de litio, podemos escoger, (batería descargada). Al cátodo se añaden catalizadores metálicos, que aceleran la reducción del oxígeno y aumentan la capacidad energética del cátodo. Los catalizadores son óxido de manganeso, cobalto, rutenio, platino, plata. Hay catalizadores de manganeso en el cátodo con capacidad de 3137 mA.h/g carbono.

El electrolito es muy complejo, con capas, y hay varios tipos, sólido (poco usado por baja conductividad), líquido, con químicas diferentes. Aquí no lo describimos, continúa su investigación en la bateria Litio-Aire. Hay electrolitos cerámicos, de vidrio, apróticos (sin agua), polímeros, poliestireno, poliacrilonitrilo, fluoruro de polivinildeno, con sales de litio. Sirve un electrolito orgánico líquido, que disuelve las sales de litio: fluoruros de litio con fósforo, arsénico o nitrógeno.
El peróxido de litio es insoluble en un electrolito aprótico, lo cual produce coágulos en el cátodo. El electrolito puede contener agua, pero sin entrar en contacto con el litio, con riesgo de incendio y explosión. También hay riesgo de cortocircuito ánodo-cátodo. Con electrolito ácido el litio más oxígeno e hidrógeno se forma agua, algo que hay que evitar. Por otro lado, con electrolito básico litio más oxígeno más agua se forma LiOH. Otro electrolito investigado mezcla las ventajas de la batería acuosa y aprótica con una membrana que separa ambos electrolitos.
Al descargar la batería, la producción de óxido y peróxido de litio puede causar coágulos que obstruyen los poros del carbono en el cátodo. Tiene éxito el carbono de doble poro: un poro sirve para oxidar el litio, y el 2º poro transporta oxígeno al ánodo.
El voltaje de célula es de 2,91 V. El principal atractivo de la batería Li-aire es la altísima densidad de energía almacenada. En teoría una batería litio-aire tiene una densidad de energía por kg comparable a la tradicional de la gasolina por kg. Esa ventaja se basa en el uso del oxígeno del aire, como cátodo, en lugar de almacenar un oxidante internamente. Por eso son preferibles a las baterías de Litio-ión. La alta densidad de energía del litio respecto al aire es de 3.840 mAh/g.
En automoción la densidad de energía de la gasolina suministrada a las ruedas es de 1,7 kWh/kg. Se ha teorizado que los mismos 1,7 kWh/kg pueden llegar a las ruedas mediante la bateria Litio-Aire, gracias también a la mejor eficiencia de los motores eléctricos del automóvil.

El vehículo eléctrico Litio-Aire no contamina, no emite CO2 a la atmósfera, pero no se podrá usar para el gran transporte de carretera, autobús, camión.
Virus para la batería Litio-Aire
Journal Nature Communications nos informa del recurso del MIT a los virus genéticamente modificados, M-13, para solucionar problemas de la nueva batería Litio-Aire. Se trata de mejorar el cátodo, en el ánodo no hay problemas: recurrir a la biología nos indica lo mucho que promete la nueva batería para aumentar la densidad de potencia sin incremento de peso, y aumentar también el número cargas-descargas, hasta miles de veces, la vida útil. Los virus escogidos producen nanohilos tridimensionales de 80 nm de espesor, de igual tamaño que una célula roja de la sangre humana, servirán como electrodos de gran superficie de la batería.
Cada virus M13 puede capturar moléculas metálicas en el agua e incorporarlas a la batería. Se trata de copiar la conducta de la Oreja de mar, Haliotis tuberculata, que capta el calcio del agua de mar, para construir su concha. Añadir paladio a los nanohilos aumentará mucho la conductividad eléctrica. La densidad de energía superará en 2 o 3 veces a la batería Litio-ión convencional.
Todas estas investigaciones están subvencionadas por U.S.Army y National Science Foundation y a pesar de que el coste de la batería de litio sigue alto, las investigaciones comienzan con optimismo.

Referencias
Aurbach, M. Selected electrode solution interactions for Li and Li Ion batteries. Journal of Power Sources, 206. 2013.
Bates, J. Thin film lithium and lithium ion batteries. Solid State Ionics, 135, 2013.
Bullis, K. Longer lasting batteries for laptops. MIT Technology Review 2012.
Kumar, B. Cathodes for solid state lithium-Oxigen cells. Journal of the Electrochemical Society 162, 2012.
Sadoway, D. Nanobatteries. Valence Technology Inc. 2013.



















