AseBio muestra su preocupación por la capacidad de España para certificar productos sanitarios
En mayo de 2022 entraba en vigor el Reglamento (UE) 2017/746 del Parlamento Europeo y del Consejo, sobre los productos sanitarios de diagnóstico in vitro (IVDR, por sus siglas en inglés). A través de este se establecieron nuevas directrices y requisitos para que los organismos evaluadores de la conformidad (OEC) puedan actuar de acuerdo con esta norma.
En enero de 2024 se publicó una nueva propuesta de enmienda a los reglamentos (UE) 2017/745 y (UE) 2017/746 que amplía los periodos de transición dos años y medio para ciertos productos IVDR. Esta ampliación se estima que será la última que se apruebe y aún debe recibir luz verde por parte del Parlamento y el Consejo europeos.
De acuerdo con la propuesta de enmienda, el periodo de transición sólo se amplía para los fabricantes que tengan contrato en curso con los organismos notificados. De este modo, se pretende que los organismos notificados cuenten con el tiempo adicional necesario para finalizar la tramitación de las evaluaciones de conformidad antes del final del periodo transitorio.
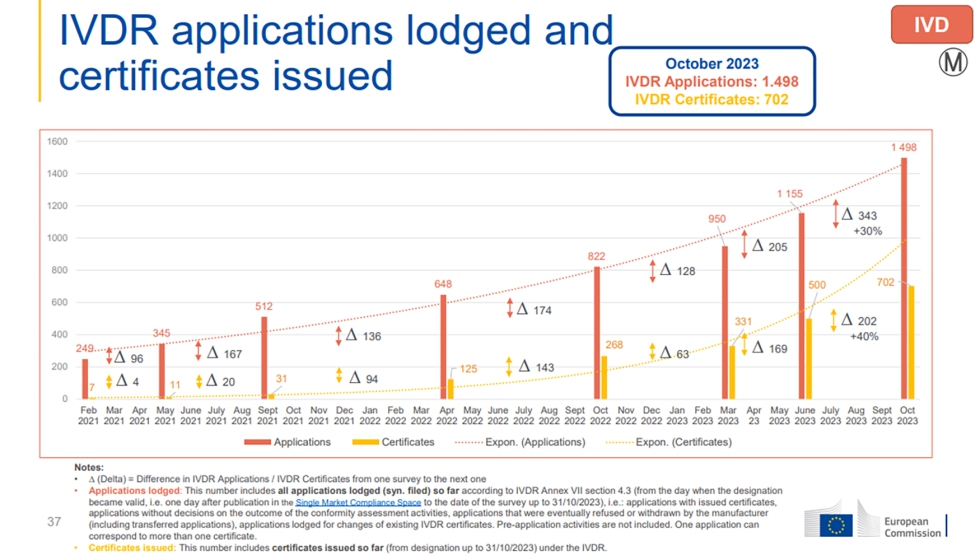
Actualmente en Europa sólo 12 organismos evaluadores de la conformidad han conseguido ser organismos notificados para el reglamento (UE) 2017/746 y 44 para el reglamento (UE) 2017/745. Con el nuevo reglamento, todos los productos de diagnóstico in vitro de la Unión Europea, tanto los nuevos como los aprobados bajo la directiva anterior, deben pasar por uno de estos organismos notificados para recibir el visto bueno que les permita su salida al mercado. Lo anterior ha producido un incremento de las necesidades de certificación, muy por encima de las capacidades de los organismos notificados actuales, escasos en número para dar respuesta a la demanda existente.
En el caso de España, contamos con el Centro Nacional de Certificación de Productos Sanitarios como organismo notificado para productos sanitarios de acuerdo con el Reglamento (UE) 2017/745. En julio de 2021 se inició la solicitud para ser designado como organismo notificado por el Reglamento (UE) 2017/746 para productos IVD, pero todavía no lo ha logrado.
El escenario que observamos refleja un preocupante cuello de botella que se traduce en un perjuicio para los productos biotecnológicos innovadores. El marco actual retrasa de forma indefinida su acceso al mercado en detrimento de los ciudadanos europeos y de las pequeñas compañías, cuyo futuro depende exclusivamente de la comercialización de un único producto. Como se puede apreciar en el informe publicado este mes de marzo por la Comisión Europea, ya sea para productos sanitarios o para productos IVD, la mayoría de los clientes de los organismos notificados son pequeñas empresas, lo que implica un mayor riesgo para estas.
Si bien el ritmo de certificación se ha incrementado a más velocidad que el crecimiento de solicitudes, la diferencia neta entre solicitudes y certificaciones concedidas continúa aumentando. Lo que hace que continúen acumulándose solicitudes y que el cuello de botella siga manteniéndose.
Esta encuesta pone también de relieve que el tiempo para alcanzar el certificado de Diagnóstico In Vitro oscila entre 13 y 18 meses en un 60% de los organismos notificados, entre 19 y 24 meses para el 30% y más de 24 para el 10%. Además, varias empresas socias de AseBio han compartido su preocupación ante la falta de respuesta de algunos organismos notificados ante peticiones de oferta para trabajar con ellos, o retrasos en hacerlo debido a la acumulación de trabajo.
Desde la industria se considera una prioridad a nivel nacional la aprobación por parte del Congreso de los Diputados del Real Decreto de Productos de Diagnóstico in vitro, así como acelerar la designación del Centro Nacional de Certificación de Productos Sanitarios como organismo notificado. Una vez el centro disponga de la designación, se necesitan vías de priorización para los productos innovadores desarrollados por empresas españolas y/o aquellos que estén dirigidos a enfermedades huérfanas.
La designación en nuestro país del CNCPS como organismo notificado para IVDR contribuiría a reducir el referido cuello de botella, pero no será la solución al problema actual por lo que se debería valorar la designación de nuevos organismos notificados en nuestro país, así como contemplar la posibilidad de dotar al Centro Nacional de Certificación de Productos Sanitarios con más recursos públicos para hacer frente a las necesidades de certificación actuales.
Además, debido a las dificultades que una parte importante de las empresas está teniendo para poder completar sus solicitudes, sería recomendable apoyar y formar a las empresas sobre la documentación necesaria que deben presentar ante los organismos notificados para la evaluación de sus productos, a fin de evitar respuestas negativas que retrasen el avance de las innovaciones en perjuicio de los ciudadanos.




























