Un nuevo catalizador que produce 3 veces más hidrógeno al romper la molécula de agua
El método se ha publicado en Nature June 23, 2015. Es un catalizador de voltaje bajo que a partir del agua genera oxígeno e hidrógeno con una batería de litio. Yi Cui, autor, es profesor de ciencia de los materiales en Stanford University. El hidrógeno es un gas que no produce emisiones y es una alternativa a la gasolina.
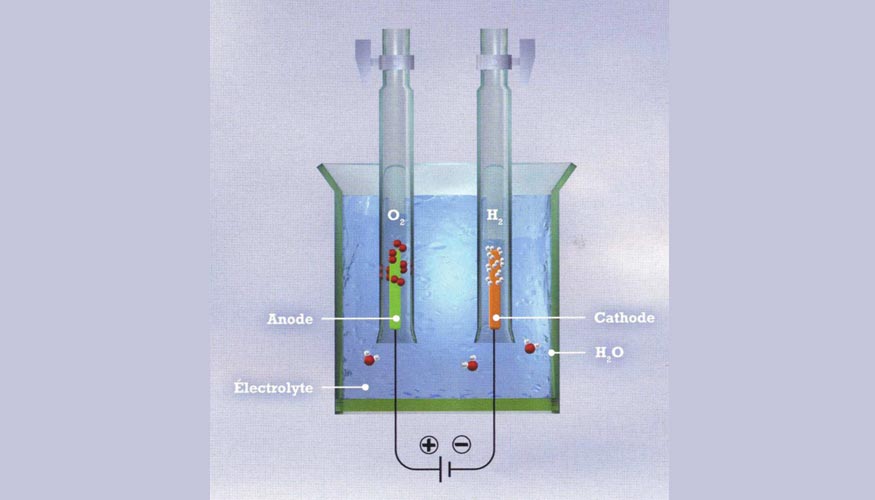
El hidrógeno normalmente lo conseguimos a partir del gas natural, un gas que aumenta la temperatura del clima. Yi Cui lo obtiene con una batería y dos electrodos, que genera burbujas de gas hidrógeno en un electrodo y burbujas de oxígeno en el otro.

En la batería convencional cada electrodo está envuelto en un catalizador diferente, normalmente platino e iridio, dos metales caros. Pero en 2014, Hongije Dai, de la Stanford, consiguió romper el agua con una batería de níquel y hierro, económicos, para los dos electrodos y una tensión de 1.5V. Es un catalizador bifuncional, que rompe el agua con una eficiencia del 82%, a temperatura ambiente. El catalizador es una substancia que promueve reacciones químicas sin ser consumido. Con el nuevo catalizador los investigadores de Stanford han dado importancia al punto en que los átomos de oxígeno se aparean, y forman burbujas. Antes ese punto era difícil de lograr.
En la batería convencional para el agua con producción de gas hidrógeno y de oxígeno, hacen falta diferentes electrolitos, con diferente pH, uno ácido y el otro alcalino. Hace falta una barrera cara para separar los dos electrolitos. Pero el nuevo catalizador descubierto funciona con un solo electrolito y con un pH uniforme; producirlo es económico, y más estable que otros electrolitos, creados a base de metales caros.
Para lograrlo, se han usado iones de litio para romper químicamente el catalizador de óxido metálico en partículas muy pequeñas. Según Cui, esas partículas incrementan el área superficial y crean partículas diminutas, que son elementos activos en la reacción catalítica de romper el agua. Son partículas muy unidas, que dan al catalizador muy buena conductividad eléctrica y estabilidad. Partículas con orificios en la superficie, para activar la reacción. Los metales del catalizador deben estar distribuidos con mucha uniformidad, sin formar grumos. Esa distribución uniforme es difícil de conseguir, repartir los óxidos metálicos, pero se ha logrado: convertir el electrolito en un gel.

Es un sondeo electroquímico, inducido por el Litio, que da carácter catalítico a varios óxidos metálicos. El tungsteno también será útil según Suncat para aumentar la eficiencia. El tungsteno es un átomo de grandes dimensiones comparado con los otros dos metales del catalizador, que expande la red atómica, y eso afecta a la reacción no solo desde un punto de vista geométrico, sino también electrónico. Hemos de entender a escala atómica cómo funciona el nuevo catalizador.
Cui ha descubierto que el óxido de níquel-hierro cataliza con gran eficacia la reacción hidrógeno-oxígeno, es el mejor. El níquel-hierro rebaja mucho los costes, con la ventaja de que solo hay un catalizador. En la reacción hay varias etapas, cada una de las cuales requiere su catalizador
El sondeo electroquímico se podrá usar para lograr otros combustibles químicos más allá del hidrógeno. El mérito es no solo del Dr Yi Ciu, sino del numeroso grupo de investigadores de la Stanford.
Almacenamiento de la energía solar en luz y viento
Ese problema existe y romper la molécula de agua es la solución, guardar el gas hidrógeno en depósitos, y quemar el hidrógeno como combustible.
El nuevo catalizador es 3 veces más eficiente para extraer hidrógeno del agua, burbujas que salen del electrodo de la izquierda, y las burbujas de oxígeno del electrodo de la derecha en la batería convencional. El hidrógeno es el primer paso para lograr combustible a partir de la energía solar renovable. También se obtiene 3 veces más oxígeno que con la batería convencional, pero no aporta utilidad. El próximo paso es lograr un catalizador para romper la molécula de CO2, en energía el Carbono metaloide es útil, y resolveríamos los problemas de calentamiento climático.
La revista Nature se ha tomado meses desde el pasado 23 de junio hasta el 24 de marzo 2016 para comprobar la solidez del nuevo catalizador. Podemos contar también con el cobalto y el tungsteno, metales económicos para el nuevo catalizador. Suncat Center for Catalysis ha realizado el trabajo teórico. Con el nuevo almacenamiento de la energía solar, no hace falta que brille el sol, para usar su energía, también nos sirve de noche y con viento en calma, por encima de 1.000 bares de presión atmosférica.

Hasta ahora la producción de gas hidrógeno se lograba con combustibles fósiles y alta temperatura, y con la electrólisis convencional del agua, pero a partir de ahora la producción de hidrógeno es limpia y renovable, a temperatura ambiente y a bajo coste.
¿Competidores del gas hidrógeno?
Las empresas que producen energía eléctrica para su red de clientes usarán el gas hidrógeno, es competitivo.
El hidrógeno alimenta la célula de combustible. En ella el hidrógeno alimenta el ánodo y el aire (oxígeno) alimenta el cátodo. La célula produce energía eléctrica y agua más calor, debido a la reacción química Hidrógeno-Oxígeno. La reacción es:
H2 da 2H+ y 2e- O2 más 4H+ da 4e- y 2H20
El hidrógeno en el ánodo se disocia en electrones y protones. Los electrones van al circuito externo y producen energía. Los protones van por electrolito al cátodo. En el cátodo las moléculas de oxígeno reaccionan con los electrones, conducidos por el circuito externo, y reaccionan además con los protones para formar agua. La tensión en el circuito externo es de 1,2 V. Las celdas se agrupan en serie y en paralelo, por eso llamamos 'pila'. En España tenemos la Asociación Española de Células de Combustible, Appice.
En la flota de transporte el combustible líquido es preferible; diésel, gasolina, ocupa en el vehículo menos espacio. También es útil el alcohol de caña de azúcar, aceites de soja, colza, cacahuete, el biodiésel, etc.
























