Resumen de la tesis dirigida por José Ignacio Garate Añibarro, de la Escuela de Ingeniería, EHU/UPV; y Jon Mabe Álvarez, de Tekniker
Dispositivos médicos con electrónica embebida: metodología de diseño y desarrollo para start-ups
Conscientes de la oportunidad que existe en el sector, cada vez son más las denominadas ‘biotech start-ups’ las que se embarcan en el negocio de los dispositivos médicos. Pese a tener grandes ideas y soluciones técnicas, muchas de estas start-ups terminan fracasando por desconocimiento del sector sanitario y de los requisitos regulatorios que se deben cumplir.
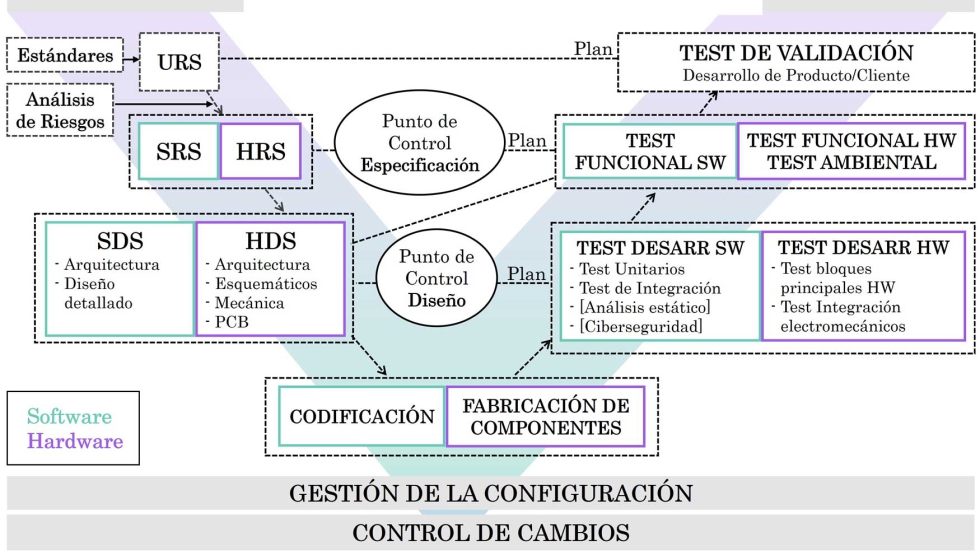
El diseño y desarrollo de dispositivos médicos embebidos está regulado en Europa por dos reglamentos: 2017/745, Medical Device Regulation (MDR) y 2017/746, In Vitro Medical Device Regulation (IVDR). Además, existen otros estándares que definen aspectos como la seguridad funcional (IEC 60601), ciclo de vida del software (IEC 62304), gestión de la calidad (ISO 13485), gestión de riesgos (ISO 14971), usabilidad (IEC 62366) y ciberseguridad (IEC 81001-5-1) entre otros.

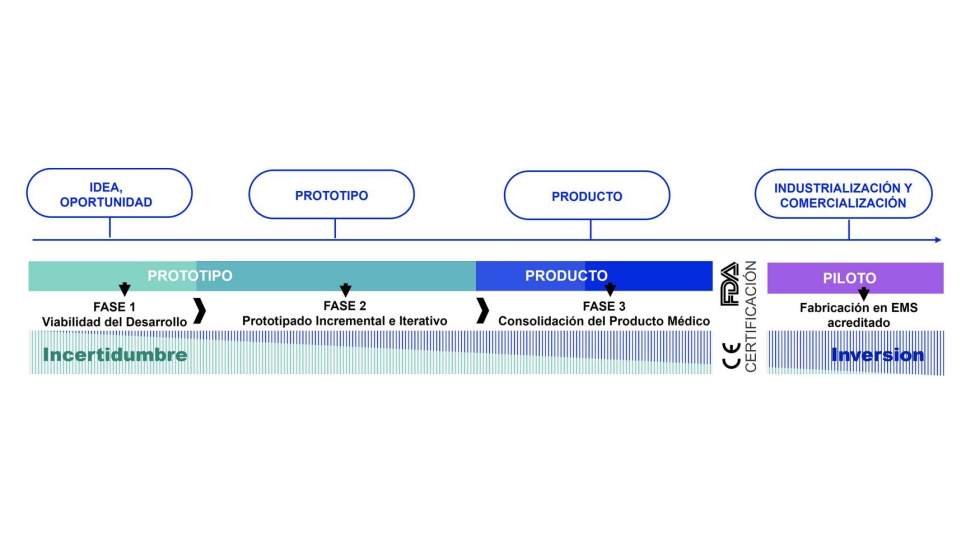
La gran cantidad de requisitos regulatorios hace que sea necesario disponer de una metodología procedimental para ejecutar dichos desarrollos. Tras realizar un análisis de las metodologías de diseño de producto existentes, no se identifica ninguna que se adapte por completo a las necesidades de empresas tipo start-ups que deseen desarrollar dispositivos médicos.
Por ello, como aportación principal, esta tesis presenta una metodología para el diseño y desarrollo de dispositivos médicos embebidos. Al tratarse de una metodología para start-ups, se busca minimizar la inversión económica a realizar en etapas con riesgo tecnológico elevado. Además, se fomenta la evaluación por parte del cliente o gestor del producto en etapas tempranas del desarrollo.
La metodología propuesta, que pretende ser una guía para las empresas de nueva creación del sector médico, se valida mediante su aplicación en los procesos de desarrollo de diferentes dispositivos médicos. Muchos de ellos ya han obtenido el marcado CE, demostrando así la eficacia de la metodología. Asimismo, los procedimientos más críticos de la metodología son validados por la entidad certificadora Société Générale de Surveillance (SGS) dentro del proceso de certificación ISO 13485 llevado a cabo en Tekniker, centro de investigación y desarrollo. Por último, se revisan y presentan diferentes estudios que avalan los principales conceptos de la metodología propuesta.