Hongos saprófitos como herramientas de control biológico de ‘Botrytis cinerea’ en tomate

Para el control de ‘B. cinerea’ se recurre principalmente al empleo de fungicidas. Estos productos de síntesis han sido utilizados con éxito durante largo tiempo, pero al día de hoy los agricultores comprueban controles insuficientes que responden a una alta versatilidad genética del patógeno. (Williamson et al. 2007). ‘B. cinerea’ ha desarrollado en un tiempo relativamente corto resistencia a fungicidas de grupos químicos diferentes como las dicarboximidas, los benzimidazoles, el dietofencarb y los inhibidores de la síntesis del esterol (Yunis y Elad 1989; Gullino 1992; O’Neill et al., 1996; Lamondia y Douglas 1997). Por otra parte, los productos disponibles se enfrentan cada vez más a la sostenida revisión y revocación de sus usos autorizados y a la vez despiertan una creciente inquietud social por los problemas ambientales asociados a su uso (Greer y Diver 1999).
Esta preocupación se vuelve extrema, por otra parte, si consideramos que los fungicidas empleados en el control de enfermedades de poscosecha se aplican sobre un artículo listo para su consumo inmediato (Roberts, 1990). Por este motivo en los últimos años se ha intensificado la prospección de alternativas inocuas que permitiesen controlar las enfermedades de poscosecha asociadas a ‘B. cinerea’. Cabe mencionar, en este sentido, experiencias tales como el uso de tratamientos térmicos (Fallik et al., 1993), la inmersión en soluciones de bicarbonato potásico (Bombelli y Wright, 2006) o lejía (Mahovic et al., 2004), y el empleo de agentes de control biológico (Mari et al., 1996; Kalogiannis et al., 2006). Durante los últimos veinticinco años han sido identificados múltiples microorganismos de alta efectividad contra ‘B. cinerea’ (Janisiewicz 1988; Helbig 2002) y la eficacia de los mismos como herramienta alternativa o suplementaria al control químico ha sido ensayada (Köhl et al., 1995; Janisiewicz y Korsten, 2002).
Metodología
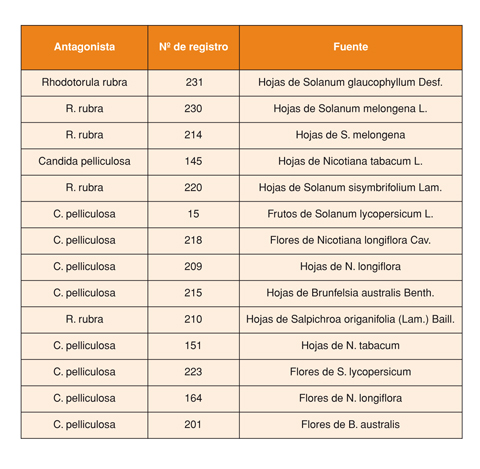
La selección de las levaduras evaluadas en el primer ensayo se efectuó entre 300 cepas diferentes previamente aisladas del filoplano de distintas plantas solanáceas recolectadas en el área del cinturón hortícola de La Plata, Argentina. En esta recolección se privilegiaron ambientes que no hubieran estado sometidos a programas de aplicación de fungicidas y que por lo tanto contaran previsiblemente con micofloras de mayor diversidad. Para el aislamiento se recurrió a la agitación de trozos de hojas y flores en agua destilada estéril, la dilución progresiva logarítmica de la suspensión y la posterior siembra en placas de Petri con medio de cultivo específico para levaduras (NYDA, Zhang et al., 2004).
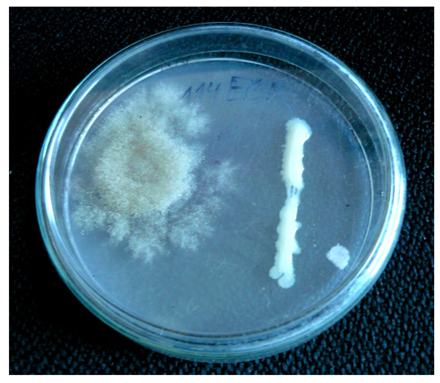
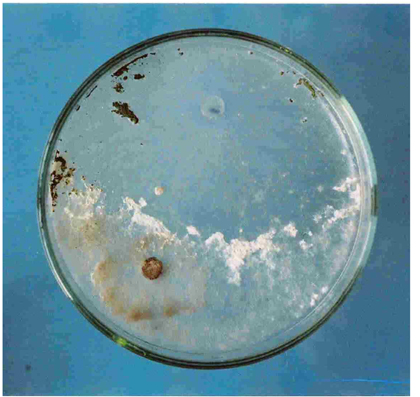
A fin de efectuar una primera selección in vitro entre las levaduras se recurrió a la técnica del cultivo dual (Fig. 2). Para realizar el mismo se sembró sobre una placa de Petri conteniendo PDA un disco de agar de un cultivo de ‘B. cinerea’ en activo crecimiento y transcurridas 24 horas en el extremo opuesto se inoculó la levadura correspondiente sobre la placa mediante la técnica de siembra en estrías. Al cabo de cinco días de incubación el porcentaje de inhibición en el crecimiento diametral de las colonias de ‘B. cinerea’, así como el ancho de la zona de inhibición fueron evaluados y comparados con un testigo.
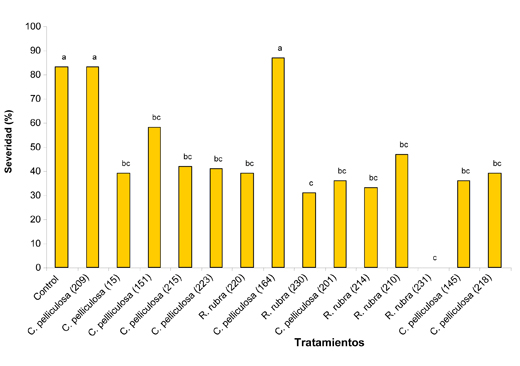
Las pruebas in vivo se realizaron sobre frutos de tomate Dominique F1 (Hazera Genetics Ltd., Israel) que habían sido mantenidos en almacenamiento a 4 °C durante una semana antes del experimento. Los frutos se esterilizaron superficialmente por inmersión en suspensión de lejía durante 15 min, seguida de lavado con agua destilada estéril y secado bajo cámara de flujo. Sobre los tomates preparados de este modo se efectuaron tres heridas de 4 mm de profundidad sobre la región ecuatorial con una aguja estéril. Inmediatamente después sobre cada una de las heridas se aplicó un pequeño disco de papel de filtro estéril embebido en una suspensión acuosa de la levadura correspondiente. Se dejó secar la suspensión sobre la herida durante 30 m a temperatura ambiente y posteriormente encima del disco conteniendo las levaduras se colocó otro de igual diámetro embebido en una suspensión de conidias de ‘B. cinerea’. Se dispusieron sendos testigos –uno solo con ‘B. cinerea’ y otro solo con levaduras– y los frutos se mantuvieron en incubación en cámara húmeda durante siete días a 20 °C. La severidad de los síntomas fue evaluada posteriormente siguiendo una escala diseñada en función del diámetro de las lesiones.
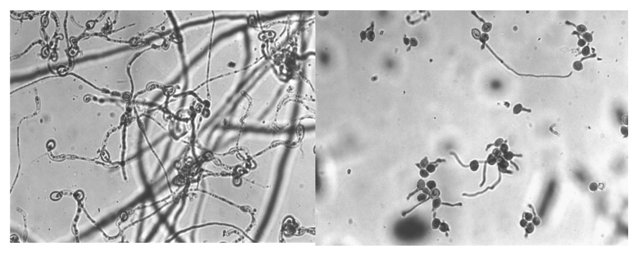
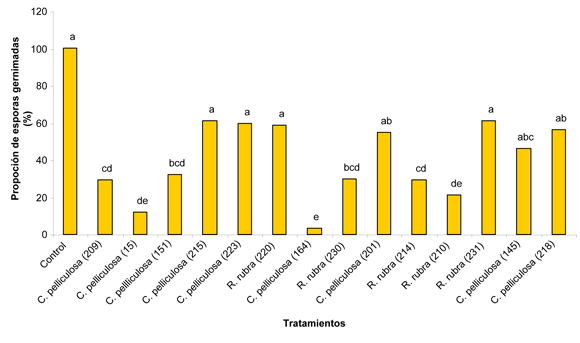
En el segundo de los ensayos que se relata en este trabajo la selección de antagonistas estuvo dirigida a hongos filamentosos. Para ello se efectuaron aislamientos de cepas presentes en filo y fructoplano de tomates cultivados bajo invernaderos comerciales del área hortícola circundante a la ciudad de La Plata. La preselección in vitro se realizó sobre 222 aislados recurriendo a la técnica del cultivo dual. Esto permitió escoger 38 cepas que fueron empleadas en la segunda etapa de ensayo in vivo, efectuada recurriendo a la técnica oportunamente mencionada para el ensayo de las levaduras (Fig. 3). En esta ocasión el ensayo se efectuó sobre frutos de tomate Superman F1 (Seminis Vegetable Seeds, Inc., USA).

Resultados
- Bombelli EC, Wright ER. (2006) Tomato fruit quality conservation during post-harvest by application of potassium bicarbonate and its effect on Botrytis cinerea. Cien Inv Agr 33: 167–172.
- Castoria R, De Curtis F, Lima G, De Cicco V. (1997) ß-1,3-glucanase activity of two saprophytic yeasts and possible mode of action involved as biocontrol agents against postharvest diseases. Postharvest Biol Technol 12: 293–300.
- Dal Bello G, Mónaco C, Rollán MC, Lampugnani G, Arteta N, Abramoff C, Ronco L, Stocco M. (2008) Biocontrol of Postharvest Grey Mould on Tomato by Yeasts. J of Phytopathol 156: 257–263.
- Dean, R, Van Kan, JAL, Pretorius, ZA, Hammond-Kosack, KE, Di Pietro, A, Spanu, PD, Rudd, JJ, Dickman, M, Kahmann, R, Ellis, J & Foster, GD. (2012) The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol 13: 414-430.
- Dick A, Elad Y. (1999) Comparison of antagonists of Botrytis cinerea in greenhouse-grown cucumber and tomato under different climate conditions. Eur J Plant Pathol 105: 123–137.
- Droby S, Chalutz E. (1994) Mode of action of biocontrol agents of postharvest diseases. En: Wilson CL, Wisniewski M (eds), Biological Control of Postharvest Diseases-Theory and Practice, Boca Raton, FL, USA, CRC Press, pp. 63–75.
- Fallik E, Klein J, Grinberg S, Lomaniec E, Lurie S, Lalazar A. (1993) Effect of postharvest heat treatment of tomatoes on fruit ripening and decay caused by Botrytis cinerea. Plant Dis 77: 985–988.
- Greer L, Diver S. (1999) Integrated pest management for greenhouse crops. Pest management systems guide. ATTRA Publication #IP144. Disponible en: http://www.attra.org/attra-pub/PDF/greenhouseipm.pdf [Último acceso 10 Julio 2010].
- Gullino, M. (1992) Chemical control of Botrytis spp. En: Verhoeff K, Malathrakis, N., Williamson B. (eds), Recent Advances in Botrytis Research. Wageningen, Netherlands, Pudoc Scientific Publishers, pp. 217–222.
- Helbig J. (2002) Ability of the antagonistic yeast Cryptococcus albidus to control Botrytis cinerea in strawberry. BioControl 47: 85–99.
- Janisiewicz WJ, Korsten L. (2002) Biological control of postharvest diseases of fruits. Annu Rev Phytopathol 40:411–441.
- Janisiewicz WJ. (1988) Biocontrol of postharvest diseases of apples with antagonist mixtures. Phytopathology. 78:194–198.
- Kalogiannis S, Tjamos SE, Stergiou A, Antoniou PP, Ziogas BN, Tjamos EC. (2006) Selection and evaluation of phyllosphere yeasts as biocontrol agents against grey mould of tomato. Eur J Plant Pathol 116: 69–76.
- Köhl W, Molhoek C, Van Der Plas C, Fokkema N. (1995) Effect of Ulocladium atrum and other antagonists on sporulation of Botrytis cinerea on dead lily leaves exposed to field conditions Phytopathology 85: 393-401.
- Lamondia JA, Douglas SM. (1997) Sensitivity of Botrytis cinerea from Connecticut greenhouses to benzimidazole and dicarboximide fungicides. Plant Dis 81: 729-732.
- Mahovic M, Sargent SA, Bartz JA. (2004) Identifying and Controlling Postharvest Tomato Diseases in Florida, University of Florida/IFAS, Fla Coop Ext Ser, HS866. Gainesville, FL, USA, http://edis.ifas.ufl.edu/pdffiles/HS/HS13100.pdf.
- Mari M, Guizzardi M, Brunelli M, Folchi A. (1996) Postharvest biological control of grey mould (Botrytis cinerea Pers. Fr.) on freshmarket tomatoes with Bacillus amyloliquefaciens. Crop Prot 15: 699–705.
- Mónaco C, Dal Bello G, Rollán MC, Ronco L, Lampugnani G, Arteta N, Abramoff C, Aprea A, Larrán S, Stocco M. (2009) Biological control of Botrytis cinerea on tomato using naturally occurring fungal antagonists. Arch Phytopathol Plant Protect 42: 729-737.
- O’Neill TM, Niv A, Elad Y, Shtienberg D. (1996) Biological control of Botrytis cinerea on tomato stem wounds with Trichoderma harzianum. Eur J Plant Pathol 102: 635–643.
- Roberts R. (1990) Postharvest biological control of grey mould on apple by Cryptococcus laurentii. Phytopathology 80: 526–530.
- Williamson B, Tudzynski B, Tudzynski P, van Kan J. (2007) Botrytis cinerea: the cause of grey mould disease. Mol Plant Pathol 8: 561–580.
- Yunis H, Elad Y. (1989) Survival of dicarboximide-resistant strains of Botrytis cinerea in plant debris during summer in Israel. Phytoparasitica 17: 13–22.
- Zhang H, Fu C, Zheng X, He D, Shan L, Zhang X. (2004) Effect of Cryptococcus laurentii (Kufferath) skinner in combination with sodium bicarbonate of postharvest green mold decay of citrus fuit. Bot Bull Acad Sin 45: 159–164.