Trichoderma es un agente de control biológico de nematodos en tomate
Rubio, M.B., Morán-Diez, M.E., Hermosa, R. y Monte, E.
Departamento de Microbiología y Genética, Instituto Hispano-Luso de Investigaciones Agrarias (CIALE), Universidad de Salamanca, Campus de Villamayor, Calle del Duero 12, 37185 Villamayor, Salamanca. E-mail: belenru@usal.es
21/06/2021Las especies de Meloidogyne, conocidas como nematodos formadores de agallas (en inglés, root-knot nematodes, RKN) constituyen un grupo de nematodos parásitos de plantas de distribución mundial (Jones y col., 2013). Se trata de un grupo polífago de biotrofos obligados altamente adaptados a sus hospedadores, con un estilo de vida endoparásito y sedentario, y con formas infectivas móviles, conocidas como formas juveniles de segundo estadio larval (J2), que son las que invaden las plantas cerca de la punta de las raíces y migran intercelularmente a través de los tejidos radicales hasta las células vasculares en desarrollo. Los RKN establecen una relación íntima con sus hospedadores, ya que inducen la formación de agallas típicas en las raíces, que constituyen los primeros síntomas visibles de esta clase de infección (Kyndt y col., 2013). Las secreciones de las glándulas faríngeas de los RKN pueden actuar como moléculas efectoras para que, una vez reconocidas por receptores situados en la membrana de las células de la planta, puedan subvertir los sistemas de defensa y modificar las funciones de las células hospedadoras (Rehman y col., 2016).

Grupo de Fitopatología y Control Biológico del CIALE.
Los RKN migran de manera sigilosa entre las células de la raíz, evitando durante su migración las respuestas de defensa de las plantas y manipulando a su vez las rutas de señalización de defensa para permitir la infección del tejido de las agallas (Nahar y col., 2011; Rehman y col., 2016). La supresión temporal de la defensa local, que conlleva una fuerte atenuación temprana de la defensa dependiente de ácido salicílico (SA) y de etileno (ET), se ha observado en los sitios especializados que forman los RKN para su alimentación en la raíz de las plantas infectadas (Barcala y col., 2010; Jammes y col., 2005; Kyndt y col., 2013; Portillo y col., 2013). Tal supresión se ve acompañada por la menor expresión de genes de biosíntesis de SA (Kyndt y col., 2012) y de genes que codifican proteínas relacionadas con la patogenicidad (PR) (Barcala y col., 2010; Hamamouch y col., 2011), que son sensibles a SA, en los tejidos de la parte aérea. Se ha propuesto que la ruta del ácido jasmónico (JA) es clave para la defensa contra RKN, siendo activada y modulada eficientemente por ET y por las fitohormonas conocidas como brasinosteroides (Nahar y col., 2013). También se ha visto que ligeros incrementos de los niveles de SA son suficientes para elevar la defensa frente al ataque de RKN en plantas de tomate, ya que la represión de la defensa dependiente de la señalización por SA se ha asociado al ataque exitoso de este patógeno (Molinari y col., 2014).
Base de actuación
La inducción de resistencia sistémica (en inglés, induced systemic resistance, ISR) describe un estado latente de resistencia, que se desencadena en plantas colonizadas por organismos beneficiosos como Trichoderma, protegiendo contra el ataque de patógenos a partes de la planta que no han estado expuestas a tales organismos (Pieterse y col., 2014). De esta manera, la planta se prepara para activar las respuestas de defensa de una manera más rápida y eficiente (un proceso denominado en inglés priming). Se piensa que los factores de señalización de las rutas de defensa permanecen latentes en ausencia del atacante. Un ejemplo bien estudiado es la molécula MYC2, un regulador de genes de la ruta de señalización de JA y ET (Van der Ent y col., 2009), que permite a la planta crecer o defenderse según las necesidades.
El manejo de nematodos a menudo se ha basado en la aplicación de moléculas nematicidas. A pesar de su razonable eficacia, el uso de compuestos químicos nematicidas está siendo una preocupación creciente debido a aspectos ambientales varios, a riesgos para la salud humana y al elevado coste para los agricultores (Molinari, 2011). En los últimos 20 años, los estudios que exploran el uso de microorganismos antagonistas y competitivos contra los RKN han ganado gran atención (Dong y Zhang, 2006), principalmente por su capacidad de inducir defensas locales y sistémicas en diferentes plantas (Hao y col., 2012; Schouteden y col., 2015; Siddiqui y Shaukat, 2005). Entre ellos, agentes de biocontrol de hongos y oomicetos del género Trichoderma y sus enzimas hidrolíticas (Lorito y col., 2010) han demostrado su potencial de biocontrol por su acción directa contra RKN (Sahebani y Hadavi, 2008; Sharon y col., 2001; Suárez y col., 2004; Windham y Pederson, 1993). Se sabe que Trichoderma interfiere los diferentes estados de desarrollo de RKN, desde la eclosión de huevos hasta la formación de J2 y de nematodos adultos. Así, se caracterizó la serin proteasa PRB1 de Trichoderma atroviride (Ta) y se demostró su papel para controlar al RKN Meloidogyne javanica (Mj), en la penetración y colonización de las masas gelationosas de huevos y en el ataque directo de J2 (Sharon y col., 2001). En nuestro laboratorio también hemos caracterizado la serin proteasa PRA1 de T. harzianum y hemos demostrado que la acción combinada de quitinasas y proteasas de los sobrenadantes de cultivo libres de células de este hongo fueron capaces de destruir la masa de huevos del RKN M. incognita (Suárez y col., 2004). Sin embargo, esta habilidad no ha sido suficientemente explotada a nivel práctico.
Antecedentes
Además de matar a los hongos, oomicetos y nematodos en el suelo, algunas cepas de Trichoderma competentes en la rizosfera han demostrado tener efectos directos en las plantas, aumentando su crecimiento y la absorción de nutrientes, el porcentaje y tasa de germinación de las semillas, y la estimulación de las defensas de las plantas contra los daños bióticos y abióticos (Brotman y col., 2013; Hermosa y col., 2012; Shoresh y col., 2010). Se sabe que T. harzianum incrementa la actividad enzimática y la acumulación de fitohormonas en tomate, dando lugar a un aumento de la resistencia sistémica frente al RKN Mj (Naserinasab y col., 2011; Sahebani y Hadavi, 2008). También se ha observado que el ataque del RKN implica una bajada de la expresión del gen de defensa PR1, cuya expresión sistémica es dependiente de SA, en raíces de tomate, aunque la expresión de este gen parece aumentar con el tiempo en plantas tratadas con T. harzianum (Leonetti y col., 2014). Por otro lado, el ataque de RKN hace que la planta se defienda aumentando la expresión de genes como JERF3, que dependen de JA/ET, cuya expresión se ve aumentada en raíces de tomate colonizadas por T. harzianum. En los últimos años se ha comprobado que la resistencia sistémica dependiente de SA y de JA, inducida por Ta (Medeiros y col., 2017) y por T. harzianum (Martínez-Medina y col., 2017) frente a RKN en plantas de tomate, se adapta en la planta en función del estado y dinámica de desarrollo del ciclo infectivo del nematodo.
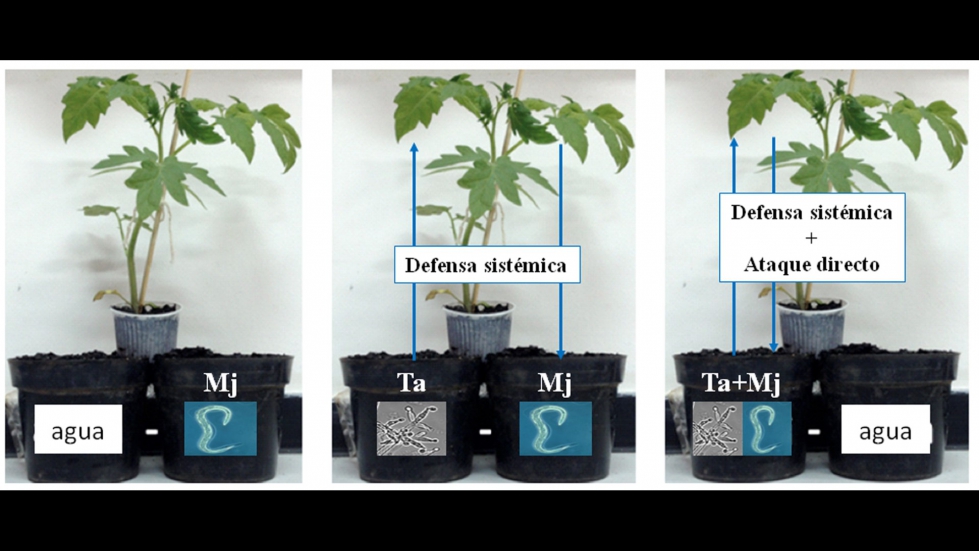
Figura 1. Modelo de plantas de tomate dispuestas en 'split-root', con separación de la raíz de una misma planta en dos macetas. Ta: Trichoderma atroviride; Mj: Meloidogyne javanica.
A continuación, explicaremos este hecho en el modelo tomate-Ta-Mj, destacando la importancia de Trichoderma en el biocontrol directo y sistémico, a través de la planta (Figura 1). Para ello, hemos desarrollado un diseño experimental utilizando un sistema de separación de las raíces de una misma planta en dos macetas (split-root) (Hao y col., 2012; Martínez-Medina y col., 2016; Moreno y col., 2009; Rubio y col., 2019) para analizar las respuestas de defensa de la planta inducidas inequívocamente por Trichoderma, sin existir contacto con el RKN. La metodología ‘split-root’ ofrece excelentes posibilidades a la hora de estudiar la respuesta de defensa sistémica por microorganismos beneficiosos que, al igual que los patógenos rizosféricos, colonizan la planta a través de la raíz.
Modelo experimental
En nuestro modelo experimental, el ‘priming’ ejercido por Trichoderma sobre la planta se evaluó colocando la mitad de las raíces en una maceta inoculada con Ta y la otra mitad de las raíces en una maceta inoculada con Mj (tratamiento Ta/Mj). Se realizó una comparación con plantas de tomate control infectadas con el nematodo (Mj) y con la confrontación directa (Ta+Mj), aplicando agua a una maceta con la mitad de las raíces e inoculando conjuntamente Ta y Mj en la otra maceta (Medeiros y col., 2017). En la Figura 2 se representan los resultados de ese ensayo, en forma de número de agallas en la raíz de tomate, número de masas de huevos del RKN, número total de nematodos en las raíces, y reducción del número del cuarto estado juvenil (J4) y número de nematodos adultos, 15 días después de la inoculación con 300 unidades de juveniles J2. Se puede ver cómo en confrontación directa Ta+Mj se redujo en un 42% el número de agallas y en un 60% el número de masas de huevos de Mj. Además, en el tratamiento Ta/Mj el número de agallas fue un 20% inferior al desarrollado en el control de inoculación con Mj (a/Mj), lo que demuestra que Ta induce resistencia sistémica a Mj, resultando en menor número de sitios de alimentación para el nematodo agallador. No obstante, la defensa sistémica por sí sola no pareció ser suficiente para afectar la reproducción del nematodo, ya que los valores del número de masas de huevos en la raíz entre los tratamientos Ta/Mj y control (a/Mj) no fueron significativamente diferentes. Para explorar la acción de biocontrol de Ta frente a Mj se determinó el número total de nematodos en las raíces y el número de juveniles J4 y de adultos. Los menores valores se obtuvieron en la condición de confrontación directa Ta+Mj, lo que demuestra que Ta redujo significativamente la infección por el nematodo. Además, Ta redujo a través de la inducción de la defensa sistémica de la planta el número de nematodos adultos (87%) en el tratamiento Ta/Mj, lo que demuestra que Trichoderma puede controlar a nematodos RKN sin que exista contacto directo entre ellos.
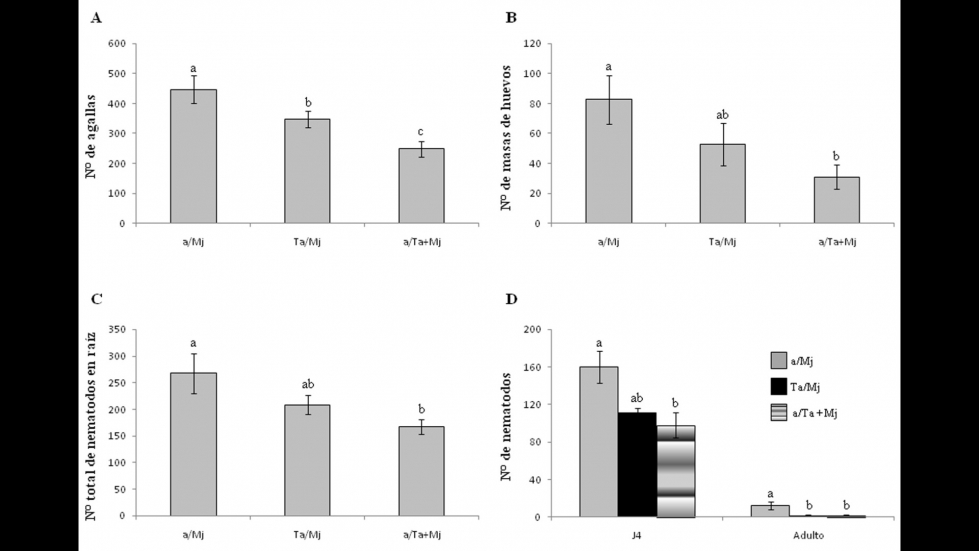
Figura 2. Control biológico de T. atroviride (Ta) frente a M. javanica (Mj) en plantas de tomate dispuestas en 'split-root'. A) Número de agallas, B) Número de masas de huevos, C) Número total de nematodos en raíz, y D) Número de nematodos en estados juvenil J4 y adulto. Los datos se obtuvieron a los 30 días de aplicar Mj en plantas de tomate de seis semanas, a partir de tres plantas por tratamiento de dos experimentos independientes (n = 6). Para cada conjunto de datos, barras con diferentes letras indican diferencias significativas (P < 0,05). a: agua; a/Mj: control de infección; Ta/Mj: biocontrol indirecto a través de la defensa sistémica de la planta; a/Ta+Mj: biocontrol directo.
Conclusión
Cada vez son más las cepas de distintas especies de Trichoderma que se comercializan en España y en la UE como:
- i) agentes de control biológico (lista de materias activas positivas incluida en el anexo I de la Directiva 91/414), principalmente por su acción directa frente a hongos y oomicetos fitopatógenos,
- ii) bioestimulantes (Real Decreto 999/2017), por la activación de distintos procesos biológicos de la planta que mejoran la eficiencia de ésta en la absorción o en el uso de nutrientes, su tolerancia al estrés abiótico o la calidad de la cosecha.
Sin embargo, la capacidad de Trichoderma para controlar enfermedades causadas por nematodos no está siendo explotada comercialmente.
En el presente artículo hemos querido destacar esta habilidad que, sin ser novedosa – se conoce desde hace 20 años–, propone el uso de cepas de este género en el biocontrol de nematodos, bien por ataque enzimático directo sobre las masas de huevos y estados juveniles y adultos, bien por la estimulación hormonal de la defensa sistémica de las plantas. De cualquier forma, queremos destacar que muchas cepas de Trichoderma colonizan la raíz y ayudan a la planta a equilibrar el coste de energía empleada en crecer o defenderse frente al ataque de patógenos, por lo que en ausencia de enfermedad no debemos olvidar que Trichoderma también actúa como un excelente promotor del crecimiento.
Agradecimientos:
Fondo Europeo de Desarrollo Regional (FEDER) con el apoyo de la Junta de Castilla y León (proyectos SA094P20 and Escalera de Excelencia CLU-2018-04), el Plan Estatal de I+D+i “Retos Investigación” (RTI2018-099986-B-I00) y la Diputación de Salamanca (proyectos-2018).
Referencias bibliográficas
-Barcala, M. y col. Early transcriptomic events in microdissected Arabidopsis nematode-induced giant cells. Plant J. 61, 698–712 (2010).
-Brotman, Y. y col. Trichoderma-plant root colonization: escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance. PLoS Pathog. 9, e1003221 (2013).
-Dong, L. Q. y Zhang, K. Q. Microbial control of plant-parasitic nematodes: a five-party interaction. Plant Soil. 288, 31–45 (2006).
-Hamamouch, N. y col. Expression of Arabidopsis pathogenesis-related genes during nematode infection. Mol. Plant Pathol. 12, 355–364 (2011).
-Hao, Z. y col. Local and systemic mycorrhiza-induced protection against the ectoparasitic nematode Xiphinema index involves priming of defence gene responses in grapevine. J. Exp. Bot. 63, 3657–3672 (2012).
-Hermosa, R. y col. Plant-beneficial effects of Trichoderma and of its genes. Microbiology 158, 17–25 (2012).
-Jammes, F. y col. Genome-wide expression profiling of the host response to root-knot nematode infection in Arabidopsis. Plant J. 44, 447–458 (2005).
-Jones, J. T. y col. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol. Plant Pathol. 14, 946–961 (2013).
-Kyndt, T. y col. Comparing systemic defence-related gene expression changes upon migratory and sedentary nematode attack in rice. Plant Biol. 14, 73–82 (2012).
-Kyndt, T. y col. Nematode feeding sites: unique organs in plant roots. Planta 238, 807–818 (2013).
-Leonetti, P. y col. How fungi interact with nematode to activate the plant defence response to tomato plants. Commun. Agric. Appl. Biol. Sci. 79, 357–362 (2014).
-Lorito, M. y col. Translational research on Trichoderma: from ‘omics to the field. Annu. Rev. Phytopathol. 48, 395–417 (2010).
-Martínez-Medina, A. y col. Shifting from priming of salicylic acid- to jasmonic acid-regulated defences by Trichoderma protects tomato against the root knot nematode Meloidogyne incognita. New Phytol., 213, 1363–1377 (2017).
-Medeiros H. A. y col. Tomato progeny inherit resistance to the nematode Meloidogyne javanica linked to plant growth induced by the biocontrol fungus Trichoderma atroviride. Sci. Rep. 7, 40216 (2017).
-Molinari, S. Natural genetic and induced plant resistance, as a control strategy to plant-parasitic nematodes alternative to pesticides. Plant Cell Rep. 30, 311–323 (2011).
-Molinari, S. y col. Expression of tomato salicylic acid (SA)-responsive pathogenesis-related genes in Mi-1- mediated and SA-induced resistance to root-knot nematodes. Mol. Plant Pathol. 15, 255–264 (2014).
-Moreno, C. A. y col. Biological and molecular characterization of the response of tomato plants treated with Trichoderma koningiopsis. Physiol. Mol. Plant Pathol. 74, 111–120 (2009).
-Nahar, K. y col. The jasmonate pathway is a key player in systemically induced defense against root knot nematodes in rice. Plant Physiol. 157, 305–316 (2011).
-Nahar, K. y col. Brassinosteroids suppress rice defense against root-knot nematodes through antagonism with the jasmonate pathway. Mol. Plant Microbe Interact. 26, 106–115 (2013).
-Naserinasab, F. y col. Biological control of Meloidogyne javanica by Trichoderma harzianum BI and salicylic acid on tomato. Afr. J. Food Sci. 5, 276–328 (2011).
-Pieterse, C. M. J. y col. Induced systemic resistance by beneficial microbes. Annu. Rev. Phytopathol. 52, 347–375 (2014).
-Portillo, M. y col. Distinct and conserved transcriptomic changes during nematode-induced giant cell development in tomato compared with Arabidopsis: a functional role for gene repression. New Phytol. 197, 1276–1290 (2013).
-Rehman, S. y col. Identification and functional analysis of secreted effectors from phytoparasitic nematodes. BMC Microbiol. 16, 48 (2016).
-Rubio, M. B. y col. A split-root method to study systemic and heritable traits induced by Trichoderma in tomato plants. En: Meth. Rhizosphere Biol. Res. vol. 1, 151-166. Ed. Springer (2019).
-Sahebani, N. y Hadavi, N. Biological control of the root-knot nematode Meloidogyne javanica by Trichoderma harzianum. Soil Biol. Biochem. 40, 2016–2020 (2008).
-Schouteden, N. y col. Arbuscular mycorrhizal fungi for the biocontrol of plant-parasitic nematodes: a review of the mechanisms involved. Front. Microbiol. 6, 1280 (2015).
-Sharon, E. y col. Biocontrol of the root-knot nematode Meloidogyne javanica by Trichoderma harzianum. Phytopathology 91, 687–693 (2001).
-Shoresh, M. y col. Induced systemic resistance and plant responses to fungal biocontrol agents. Annu. Rev. Phytopathol. 48, 21–43 (2010).
-Siddiqui, I. A. y Shaukat, S. S. Phenylacetic acid-producing Rhizoctonia solani represses the biosynthesis of nematicidal compounds in vitro and influences biocontrol of Meloidogyne incognita in tomato by Pseudomonas fluorescens strain CHA0 and its GM derivatives. J. Appl. Microbiol. 98, 43–55 (2005).
-Suárez, B. y col. Isolation and characterization of PRA1, a trypsin-like protease from the biocontrol agent Trichoderma harzianum CECT 2413 displaying nematicidal activity. Appl. Microbiol. Biotechnol. 65, 46–55 (2004).
-Van der Ent, S. y col. Jasmonate signaling in plant interactions with resistance-inducing beneficial microbes. Phytochemistry 70, 1581–1588 (2009).
-Windham, G. L. y Pederson, G. A. Interaction of Trichoderma harzianum, Meloidogyne incognita and Meloidogyne arenaria on Trifolium repens. Nematropica 23, 99–103 (1993).
















