La roya amarilla del trigo: características, situación actual y claves para el control
Introducción
La roya amarilla del trigo está causada por el hongo Puccinia striiformis Westend. f. sp. tritici Erikson, que pertenece al orden Uredinales, de la clase de los Basidiomicetos. Es una de las enfermedades vegetales más ampliamente distribuidas por todo el mundo, y también la que produce mayores pérdidas en este cultivo (Bayles et al., 2000). Fue descrita por primera vez el año 1777 en Europa (Eriksson y Henning, 1896) y en1915 en Estados Unidos (Carleton, 1915) y se ha extendido ampliamente por todas las zonas templadas de cultivo de trigo del planeta (Ali et al., 2014; Chen, 2005). Su gran capacidad de dispersión a largas distancias es debida a su aptitud de causar infecciones sucesivas de un campo a otro a lo largo de las estaciones de clima más favorable y a su característica de ser una enfermedad policíclica (Kolmer, 2005).
En España es una enfermedad poco conocida cuya ocurrencia se producía principalmente en forma de epidemias locales o regionales muy localizadas y tan sólo muy ocasionalmente en epidemias severas de forma generalizada (GENVCE, 2014). El uso de variedades con genes de resistencia efectivos contra las razas de roya amarilla presentes en nuestro territorio (Almacellas et al., 2013) y la falta de condiciones ambientales para el desarrollo de la enfermedad, explicaban su baja incidencia en nuestro país. La situación de contención de la enfermedad en España se ha ido manteniendo hasta el año 2011 con la introducción de una nueva raza del patógeno denominada Warrior/Ambition, previamente identificada en 2009 y 2010 en Alemania y los países escandinavos (de Vallavieille-Pope et al., 2012). La aparición de nuevas razas del hongo adaptadas a climas más templados y con reconocida mayor agresividad (Milus et al., 2009) supone un cambio de paradigma en el manejo de la enfermedad, puesto que la estructura varietal establecida hasta ahora no es tan apta para conseguir buenos rendimientos por su compatibilidad y susceptibilidad a la raza introducida.

Fotografía 1. Pústulas alargadas características de la roya amarilla rompiendo la cutícula de la hoja y liberando uredósporas. Autor: J. Almacellas.
Sintomatología y desarrollo epidémico de la enfermedad
Los síntomas de roya amarilla se manifiestan en cualquier estado fenológico del cultivo mediante pústulas alargadas en el haz de la hoja, de 0,5 a 1 mm de longitud, que rompen la cutícula para desprender las esporas (Fotografía 1). Estas pústulas son los llamados uredios o uredosoros y sus esporas las urediniósporas o uredósporas, las cuales tienen un color amarillo o anaranjado. Las lesiones se disponen normalmente alineadas entre los nervios a lo largo de la hoja confiriendo el aspecto característico de este patógeno (Fotografía 2). El tamaño y la longitud dependerán del tipo de infección y la variedad, y pueden producirse tanto en las hojas basales como en las superiores. Con infecciones medias o severas, superiores al 50% (Fotografía 3), las hojas se secan de forma prematura y completa.
Los síntomas iniciales de roya amarilla se suelen circunscribir a una parte de la parcela, pero a partir de los primeros focos la enfermedad se dispersa rápidamente al resto. Los focos y los síntomas iniciales en hoja, de poca severidad (Fotografía 4), son los indicios que pueden permitir al agricultor anticiparse a síntomas de mayor gravedad para realizar tratamientos fungicidas si se superan los umbrales establecidos.

Fotografía 2. Aspecto de la disposición alineada de las pústulas de roya amarilla a lo largo de los nervios de la hoja. Autor: A. López.

Fotografía 3. Infección severa de roya amarilla, que puede producir el secado final de la hoja. Autor: J.M. Llenes.
Si bien la infección se produce principalmente en los limbos foliares, también puede observarse en las vainas de las hojas y las espigas (Fotografía 6). En casos de infecciones de elevada intensidad, el hongo puede extenderse por las cubiertas del grano, provocando un color diferente de la espiguilla, muy evidente, porque quedará recubierta de esporas (uredósporas).

Fotografía 4. Síntomas iniciales de roya amarilla en hoja de trigo. Autor: J. Almacellas.

Fotografía 5. Aspecto de la roya amarilla al final del ciclo del cultivo de trigo. Se observan puntuaciones de color negro llamadas teliosoros. Autor: J. Almacellas.

Fotografía 6. Infección de roya amarilla en espiga de trigo. Autor: D. Villegas.
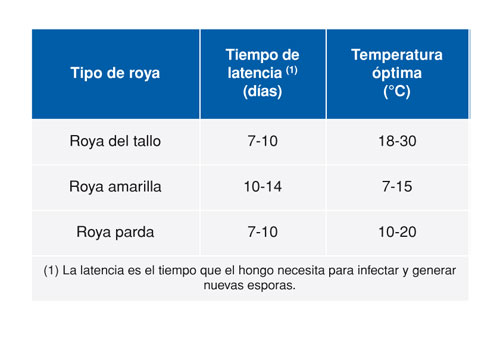
La roya amarilla del trigo es un parásito obligado, lo que significa que solamente vive en tejido vegetal vivo y muere cuando muere la planta que infecta. Su ciclo tiene una fase asexual y una fase sexual. Es un hongo heterohecio (coloniza más de una especie huésped) y macrocíclico, con cinco estadios diferentes conocidos de esporulación: uredinio, telio, basidio, picnio y ecio (Figura 1). Las royas suelen tener un huésped alternativo, de diferente especie vegetal, para completar su ciclo. No ha sido hasta muy recientemente que se ha identificado a Berberis spp. (Agracejo) (Jin et al., 2010) en condiciones de campo en EE UU y más tarde, bajo condiciones experimentales, a Mahonia aquifolium (Rodríguez-Algaba et al., 2014), ambos pertenecientes a la familia Berberidaceae, como huéspedes alternativos de P. striiformis.
De este modo, el patógeno pasa la primavera y el verano en su forma asexual, la que conocemos habitualmente como roya amarilla típica que coloniza el trigo, formando primero los uredosoros, las pústulas amarillas alineadas, y después los teliosoros, que son los puntos negros que vemos en las hojas hacia el final del cultivo. Las teliósporas producidas por los teliosoros colonizarían opcionalmente el huésped alternativo, Berberis spp., originando la fase basídica. Se considera que la telióspora es la fase perfecta de las Uredinales, puesto que es precisamente en esta estructura en donde tiene lugar la cariogamia y la meiosis responsables de la recombinación genética y de la variabilidad intraespecífica. En Berberis se desarrollaría pues su fase sexual, que se produciría durante el otoño y el invierno. Aparte de colonizar Berberis spp., el hongo, a finales de verano y en otoño, suele colonizar de nuevo el cultivo de trigo recién sembrado, los ricios o bien otras gramíneas espontáneas, pasando el invierno en los tejidos vegetales mientras la planta permanece viva.
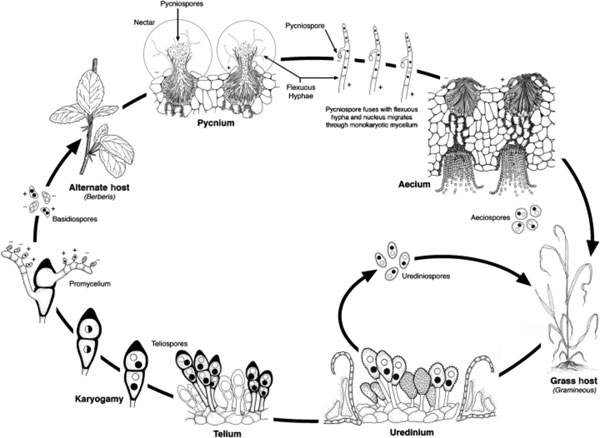
Durante el invierno, el hongo puede morir si las temperaturas son inferiores a los -10 °C (Chen, 2013), lo cual explica el bajo nivel epidémico registrado la mayor parte de los años en España, sobre todo en zonas de interior con inviernos rigurosos. Durante la primavera, con presencia de lluvias intermitentes, de mucha humedad y de temperaturas entre 10 y 15 °C, se iniciará la liberación de las uredósporas desde los ricios a otros huéspedes, y comenzarán los ciclos infectivos en el trigo de forma continua mientras se den condiciones favorables. Las uredósporas necesitan al menos 3 horas de humedad continua en la superficie de la hoja para germinar e infectar la planta, pero también tienen una alta viabilidad si permanecen secas, hecho que sucede cuando las infecciones se producen en los trigos más tardíos y en los ricios (Chen, 2005). Esta es la fase más agresiva del patógeno ya que si la infección es grave puede acabar secando la planta y producir la muerte precoz del cultivo. Por encima de los 15 °C las esporas (uredósporas) empiezan a perder su viabilidad y por encima de los 20 °C se inhibe claramente la enfermedad. A partir de los 25 °C el proceso de infección suele detenerse. A pesar del rango de temperaturas óptimas mencionado, se ha de tener en cuenta que las uredósporas de roya amarilla son capaces de germinar e infectar en un rango de temperatura más amplio, entre 0 y 21 °C. Las pérdidas finales que provoca la enfermedad son debidas principalmente al descenso de la producción causado por la reducción del número de granos por espiga, el descenso del peso específico y una menor calidad del grano.
Incidencia de la enfermedad: situación actual
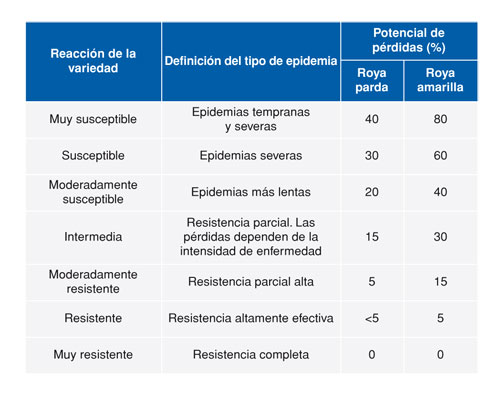
El hongo causante de la roya amarilla puede aparecer por todas las áreas productoras de cereal del mundo donde existan huéspedes susceptibles, cultivados o bien espontáneos. Este hongo tiene la característica de especializarse para cada especie vegetal que infecta, estas especializaciones reciben el nombre de formas especiales. El principal huésped y en el cual la enfermedad tiene más importancia es el trigo. La forma especial que solamente se da en el cultivo del trigo y triticale se denomina P. striiformis f. sp. tritici. Otros huéspedes son la cebada, el centeno, el triticale y muchas otras gramíneas cultivadas o silvestres. A su vez, es también un hongo muy especializado dentro de la misma especie vegetal huésped, formando razas, las cuales pueden infectar unas variedades respecto a otras. Cada raza de roya supone una combinación de un conjunto de genes de virulencia en una subpoblación que se comporta de una determinada manera al infectar una variedad. En el caso del trigo se han encontrado numerosas razas del hongo, ya que cada nuevo estudio realizado caracteriza más razas que suponen nuevas combinaciones de genes de virulencia. Chen (2005) cita 109 razas detectadas solamente en Estados Unidos hasta la fecha de la publicación. El mismo autor cita 78 genes de virulencia distintos capaces de infectar las variedades de trigo. Más recientemente, Sørensen et al. (2014) citan 89 genes de resistencia detectados en trigo, que serían equivalentes a otros tantos genes de virulencia pertenecientes al patógeno. Estos datos sumados a los que se relacionan con la resistencia cuantitativa codificada en Quantitative Trait Loci (más conocidos como QTL) (Chen y Line, 1995a, 1995b; Sørensen et al., 2014) o los genes Hight Temperature Adult-Plant (HTAP) (Chen, 2005; 2013) nos muestran la complejidad de comportamiento que puede tener la roya amarilla frente al cultivo del trigo y por ello también la posible dificultad de manejo para la obtención de variedades resistentes a la enfermedad. Entre todas las especies de royas que afectan a los cereales, ésta es la más agresiva, es decir, la que puede provocar mayores pérdidas de cosecha con la misma intensidad de los síntomas. Hay estudios que atribuyen a la roya amarilla el doble de agresividad y pérdidas que las que provoca la roya parda (Tabla 2).
En situaciones extremas de epidemias muy severas, las pérdidas de producción pueden ser prácticamente del 100% de la cosecha, tal como se observó en los ensayos de recomendación varietal de 1997 del IRTA en Girona, aunque el rango habitualmente varía entre el 10% y el 70% (Chen, 2005). Económicamente supone una preocupación para los agricultores ya que causa daños importantes en muchos países de Europa, así como en los grandes productores Rusia y Estados Unidos. En estos países, son frecuentes pérdidas anuales de entre el 5 y el 10%, y se cita que pueden alcanzar el 40 y 50% de la cosecha en años de clima favorable y en variedades susceptibles (Chen, 2005; HGCA, 2014; Roelfs et al., 1992).
La mayor incidencia de la enfermedad se produce en las regiones templadas, húmedas y frescas. En las zonas de clima semiárido, como son la mayor parte de nuestras zonas productoras, solamente las variedades con un comportamiento más susceptible a la enfermedad pueden ser afectadas significativamente por la roya amarilla durante los períodos húmedos en primavera. Sin embargo, en el sur de Francia se ha observado la adaptación local al huésped a pesar a las condiciones climáticas, en este caso más cálidas y menos lluviosas, que no se explica solamente mediante adaptaciones de virulencia del patógeno a las poblaciones locales (Enjalbert et al., 2005; Mboup et al., 2012). Por otra parte existe una evidencia clara de incremento de agresividad de las nuevas poblaciones de P. striiformis a partir del año 2000, debido también a la adaptación a condiciones más cálidas (Milus et al., 2009).
En estos últimos años se han producido epidemias muy importantes de roya amarilla en el oeste y centro de Europa debidas a los cambios en la dinámica poblacional del hongo. La variación en las proporciones relativas de los genes de virulencia han causado que gran parte de las variedades cultivadas hayan perdido su resistencia. Desde el año 2000 se han descrito dos nuevas razas en Estados Unidos, Australia, Europa, zona este de África y zonas centrales y oeste de Asia, que muestran una mayor agresividad, aumentando con ello la severidad de las epidemias incluso en zonas más cálidas y no habituales para este patógeno (Hovmøller et al., 2008; Milus et al., 2009), una de ellas es la ya mencionada raza Warrior/Ambition. Ésta se ha extendido por el continente europeo desde el Reino Unido y países escandinavos hacia Europa central y del sur. En el año 2012 fue detectada en epidemias muy importantes en Navarra (Zúñiga et al, 2012), lo que hizo suponer que se podría extender rápidamente hacia otras zonas productoras españolas.
En España la roya amarilla no había provocado hasta ahora pérdidas de importancia de manera sistemática, aunque se recuerdan los episodios de los años 1957, 1960 y 1976 (Aparicio et al., 2014). Solamente en las comarcas litorales de Cataluña, en la provincia de Girona y en los regadíos de la provincia de Lleida se habían registrado epidemias de cierta importancia en algunas parcelas con cierta regularidad (IRTA, datos no publicados), así como en algunas zonas productoras andaluzas como la Vega de Jerez en la provincia de Cádiz, en Sevilla y en Córdoba. Ocasionalmente también se habían detectado episodios epidémicos debidos a la introducción de alguna variedad especialmente susceptible, como es el caso de la variedad Victo, de origen francés, que se mostró muy susceptible durante los años 1997 y 1998. Estos episodios coincidieron con procesos epidémicos importantes en la misma variedad en el sur de Francia (de Vallavieille-Pope et al., 2012). Actualmente el problema es de primera magnitud ya que durante las campañas 2013 y 2014 se han detectado epidemias severas de roya amarilla en la zona del Valle del Ebro, Castilla y León y Andalucía. Además, la distribución de la enfermedad dentro de las zonas afectadas ha sido amplia en cada territorio lo cual ha supuesto un cambio importante en el manejo del cultivo.
Medios de control de la enfermedad
En cualquier caso, las recomendaciones siempre se incluirán en tres estrategias básicas: a) prácticas agronómicas para producir el mayor escape posible a la enfermedad o mitigar sus efectos, b) manejo de la resistencia de las variedades con un sentido agronómico y/o económico y c) control químico, teniendo en cuenta que este siempre será el último recurso por el amparo de la normativa Europea de la Directiva de uso sostenible que incluye la Gestión Integrada de Plagas. El agricultor o el técnico deberán escoger la o las estrategias que sean más adecuadas a la situación de su explotación.
Prácticas agronómicas
Estas medidas son poco eficientes para evitar epidemias de roya amarilla en nuestras zonas y condiciones. El hongo no infecta la semilla pero puede haber sin embargo infestaciones de esporas (uredósporas) que se mezclen con ésta. Parte de las esporas que infestan la semilla pueden perderse en los procesos de manejo y otra parte puede perder fácilmente su viabilidad en este camino. Por estas razones, la cantidad de inóculo que se puede evitar con el tratamiento de la semilla de siembra es muy baja. De todas formas, el tratamiento de la semilla de siembra es una medida que recomendada para variedades de comportamiento moderadamente susceptible o susceptible en zonas o países que pueden tener problemas graves de la enfermedad (Australia, EE UU), con el objetivo de evitar una vía más de entrada y para evitar infecciones muy tempranas en plántula (Beard et al., 2005; Duff et al., 2006; Hollaway, 2014; McLean et al., 2010; Murray et al., 2005; Wolf, 2010).
La roya amarilla no es un hongo capaz de sobrevivir en los residuos de la cosecha anterior (Hollaway, 2014), ya que al ser un organismo biótrofo obligado, necesita siempre de tejido vegetal vivo. Según esto, la gestión de los restos de la cosecha anterior, en el caso de los rastrojos o de los restos de la paja, no contribuirá en la generación de las epidemias siguientes en la parcela. Tampoco la gestión de los sistemas de manejo del suelo (tradicional, mínimo laboreo, siembra directa) no ha de suponer ninguna diferencia en la posibilidad de tener epidemias de esta enfermedad.
Una medida propuesta en otros países donde la enfermedad es importante, es procurar la interrupción del ciclo del hongo, que consiste en eliminar los rebrotes o ricios, lo que los anglosajones denominan el puente verde ('Green bridge') (Ali et al., 2010; Beard et al., 2005; Hollaway, 2014; Murray et al., 2005) que mantiene la continuidad del ciclo de P. striiformis en condiciones más cálidas como las nuestras y sin necesidad de huésped alternativo (Berberis spp.). Esta es una práctica poco habitual en nuestro país debido a nuestras diferentes condiciones climáticas por lo que es más recomendable en otras latitudes como los países del centro y norte de Europa. Sin embargo, en las zonas de secanos frescos, donde la maduración del cultivo del trigo es más tardía, es interesante evitar las siembras tempranas y eliminar el posible rebrote mediante labores de enterrado en el terreno.
Resistencia varietal
Con la introducción de la nueva raza europea de roya amarilla, se ha producido una ruptura de la resistencia que afecta a las recomendaciones sobre las variedades para la siembra. El INTIA de Navarra citaba que tanto las variedades Anza, Badiel o Bokaro, tradicionalmente susceptibles a la raza española como las variedades Andelos, Berdún, Nogal y Paledor, que hasta entonces se mostraban resistentes se vieron afectadas por la nueva raza Warrior/Ambition en 2012 (Zúñiga et al., 2013). En los ensayos agronómicos llevados a cabo por la red GENVCE durante la campaña 2013-14, las variedades más atacadas han sido Sarina, Tiépolo, Paledor, Akim, Ciprés y Guadalete, mientras que otras como Artur Nick, Gazul, Valbona, Algido, Alhambra, Belsito o Candelo, mostraron valores bajos de infección (GENVCE 2014). Para tomar una decisión sobre la variedad a sembrar, es importante tener en cuenta la información disponible sobre el comportamiento de la variedad ante la enfermedad en distintas condiciones y años. Esta información suele estar disponible en los resultados de los ensayos repartidos por el territorio nacional que establecen la Red GENVCE (ver página web en bibliografía), y en los resultados de las diferentes redes de ensayo y recomendación varietal autonómicas.
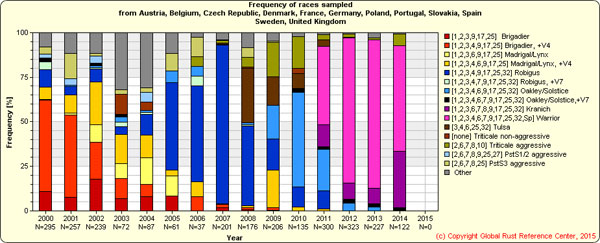
En el año 1994 se observó la rotura de la resistencia del gen Yr17 en el Reino Unido y Dinamarca, y en el año 1997 en Francia y Alemania (Bayles et al., 2000; de Vallavieile-Pope et al., 2012). A partir de ese período, la pérdida de eficacia de este gen se ha ido extendiendo por otros países europeos, incluida España (datos no publicados pero incluidos en la página web del GRRC). Las plataformas web del Global Rust Reference Center (GRRC, 2014) y del EuroWheat (2014), ofrecen información actualizada sobre la evolución de los genes de virulencia de las poblaciones de P. striiformis y de sus razas, de gran utilidad para el diseño de cruzamientos y la obtención de nuevas variedades resistentes. Los datos recogidos en estas plataformas muestran cómo a partir del año 2011 predomina la raza Warrior/Ambition en los países muestreados (Figura 2), caracterizada por contener un elevado número de genes de virulencia (Vr1, Vr2, Vr3, Vr4, Vr6, Vr7, Vr9, Vr17, Vr25, Vr32 y Sp) y por ser, además, virulenta frente a los cultivares Robigus, Solstice, Timber, Ambition y Cadenza (cultivar Warrior incluido) (AHDB, 2012). Así mismo, en los últimos años ha aumentado también la incidencia de la raza Kranich, con un grupo de genes de virulencia parecida a Warrior. La raza Warrior aparece en Europa en el año 2011, más probablemente debido a la importación de inóculo foráneo a la zona europea que a una mutación. Su rápida propagación por el oeste y centro del continente ha sido debida, en parte a la amplia utilización de cultivares susceptibles que contienen los genes de resistencia equivalentes a los de virulencia de esta raza (Bayles et al., 2000), poniendo de manifiesto la importancia del desarrollo y cultivo de variedades resistentes.
Control químico
Para poder valorar los umbrales de intervención, es necesario evaluar la enfermedad en las parcelas, observando la intensidad de los síntomas en hoja, normalmente medidos mediante la severidad o % de superficie foliar afectada. Los umbrales de enfermedad conocidos hasta ahora sobre roya amarilla pueden ser discutibles con la aparición de la nueva raza por lo que los tratamientos solamente curativos podrían llegar demasiado tarde. Se sugiere por ello una estrategia preventiva y tener en cuenta que en la campaña 2014 se detectaron las primeras infecciones muy pronto, a primeros de marzo, por lo que los umbrales de intervención deberán ser bajos si se repite esta situación en próximas campañas. Ante esta situación, se recomiendan umbrales alrededor del 1% de severidad en hoja (toda la planta) que sería equivalente, aproximadamente, a la presencia de roya en 35 hojas de cada 100 (McLean et al., 2010).
Para establecer el momento adecuado de aplicación debemos tener en cuenta que la contribución de las hojas a la producción total del grano es del 43% la hoja bandera, 23% la hoja-1 y 7% la hoja-2, siendo la espiga y el tallo un 22% (HGCA, 2014), o sea, que la hoja bandera y la espiga juntas contribuyen aproximadamente un 65% a la producción final y, por lo tanto, cualquier estrategia debe pasar por mantener libre de enfermedad, al menos, esta hoja, si bien es preferible mantener libres las tres hojas superiores (Duff et al., 2006). Respecto a los productos fungicidas, disponemos fundamentalmente de substancias activas del grupo triazoles y de las estrobilurinas. Los triazoles tienen un mayor efecto curativo que las segundas por lo que se debe tener en cuenta esta capacidad (Wolf, 2010). Así pues los tratamientos a base de estrobilurinas serán preventivos y los de triazoles pueden ser preventivos o curativos, considerando que la mezcla triazol más estrobilurina será altamente eficaz en ambas situaciones.
Existe una dificultad en las recomendaciones de aplicaciones fungicidas según variedades. En general se considera la idea de que se deben tratar las variedades muy susceptibles, susceptibles o de comportamiento moderado a la enfermedad y olvidarse de las resistentes, puesto que no manifestarán la enfermedad aunque la presión de ésta sea elevada. La cuestión es que la catalogación de resistencia/susceptibilidad de las variedades que hasta los años 2011-2013 era válida, actualmente no lo es. El cambio de las poblaciones de la roya amarilla y la rotura de la resistencia efectiva hasta este momento nos conduce a plantear nuevos estudios en España que informen adecuadamente sobre el comportamiento de las variedades.
Referencias bibliográficas
- AHDB. 2012. Annual Project Report 2012. Agriculture and Horticulture Development Board, HGCA oilseeds an cereal division, United Kingdom Cereal Pathogen Virulence Survey.
- Ali S, Leconte M, Walker A-S, Enjalbert J y de Vallavieille-Pope C. 2010. Reduction in the sex ability of worldwide clonal populations of Puccinia striiformis f.sp. tritici. Fungal Genetics and Biology, 47:828-838.
- Ali S, Gladieux P, Leconte M, Gautier A, Justesen AF, Hovmøller MS, Enjalbert J y de Vallavieille-Pope C. 2014. Origin, Migration Routes and Worldwide Population Genetic Structure of the Wheat Yellow Rust Pathogen Puccinia striiformis f. sp. tritici. PLoS Pathog 10(1): e1003903. doi:10.1371/journal.ppat.1003903.
- Almacellas J, López A, Álvaro F, Serra J, Capellades G y Marín JP. 2013. La roya amarilla de los trigos, un problema emergente. Vida Rural, 370: 32-42.
- Aparicio N, Caminero C y Puertas J.2014. El desarrollo de la roya amarilla en los trigos de Castilla y León. Instituto Tecnológico Agrario, Junta de Castilla y León, Consejería de Agricultura y Ganadería, Informe 2014.
- Bayles RA, Flath K, Hovmøller MS y de Vallavieille-Pope C. 2000. Breakdown of the Yr17 resistance to yellow rust of wheat in northern Europe – a case study by the yellow rust sub-group of COST 817. Agronomie (Paris) 20: 805-811.
- Beard C, Loughman R y Thomas G. 2005. Managing stripe rust and leaf rust. Farmnote núm. 43/2005. Department of Agriculture. Government of Western Australia.
- Carleton M.A. 1915. A serious new wheat rust in this country. Science 42: 58-59.
- Chen XM. 2013. Hight-temperature adult-plant resistance, key for sustainable control of stripe rust. American Journal of Plant Science, 4: 608-627.
- Chen XM. 2005. Epidemiology and control of stripe rust Puccinia striiformis f. sp. tritici on wheat. Can. J. Plant Pathol. 27: 314-337.
- Chen XM y Line RF. 1995a. Gene action in wheat cultivars for durable high-temperature adult-plant resistance and interactions with race-specific, seedling resistance to stripe rust caused by Puccinia striiformis. Phytopathology, 85: 567–572.
- Chen XM y Line RF. 1995b. Gene number and heritability of wheat cultivars with durable, high-temperature, adult-plant resistance and race-specific resistance to Puccinia striiformis. Phytopathology, 85: 573–578.
- de Vallavieille-Pope C, Ali S, Leconte M, Enjalbert J, Delos M y Rouzet J. 2012. Virulence dynamics and regional structuring of Puccinia striiformis f. sp. tritici in France between 1984 and 2009. Plant Dis. 96:131-140.
- Duff C, Hamnblin P y Poole N. 2006. Stripe rust management in wheat. Grains Research & Development Corporation (GRDC). Australia.
- Enjalbert, J., Duan, X., Leconte, M., Hovmoller, M., Pope de Vallavieille, C. (2005). Genetic evidence of local adaptation of wheat yellow rust (Puccinia striiformis f.sp.tritici) within France. Molecular Ecology, 14 (7), 2065-2073. DOI: 10.1111/j.1365-294X.2005.02566.x
- Eriksson J y Henning E. 1896. Die Getreideroste. Nortstedt & Söner, Stockolm.
- EuroWheat. 2014. http://www.eurowheat.org/EuroWheat.asp
- GENVCE. 2014. Grupo para la Evaluación de Nuevas Variedades de Cultivos Extensivos en España. Fichas relativas a las variedades de trigo. http://www.genvce.org/
- GRRC. 2014. Global Rust Reference Center page web: http://wheatrust.org/
- HGCA. 2012. Yellow rust management in wheat. Topic sheet 119/Autum 2012.HGCA Publications.
- HGCA. 2014. Wheat disease management guide. Enero de 2014. HGCA Publications. http://www.hgca.com/
- Hollaway G. 2014. Stripe rust of wheat. Victorian Government Department of Environment and Primary Industries, Melbourne, Australia.
- Hovmøller MS, Yahyaoui AH, Milus EA, Justesen AF. 2008. Rapid global spread of two aggressive strains of a wheat rust fungus. Molecular Ecology 17: 3818–3826.
- Jin Y, Szabo LJ y Carson M. 2010. Century-old mystery of Puccinia striiformis life history solved with the identification of Berberis as an alternate host. Phytopathology 100: 432-435.
- Kolmer JA. 2005. Tracking wheat rust on a continental scale. Current Opinion in Plant Biology 8: 441-449.
- Kolmer JA. 2013. Leaf rust of wheat pathogen biology, variation and host resistance. Forests, 4: 70-84. doi:10.3390/f4010070
- Mboup M, Bahri B, Leconte M, de Vallavieille-Pope C, Kaltz O y Enjalbert J. 2011. Genetic structure and local adaptation of European wheat yellow rust populations: the role of tgemperature_specific adaptation. Evolutionary Applications, 5 341-352.
- McLean M, Henry F y Hollaway G. 2010. Stripe rust management in wheat. BCG Season Research Results, Victoria, Australia.
- Milus EA, Kristensen K y Hovmøller MS. 2009. Evidence for increased aggressiveness in a recent widespread strain of Puccinia striiformis f. sp. tritici causing stripe rust of wheat. Phytopathology 99: 89-94.
- Murray G, Wellings C, Simpfendorfer S y Cole C. 2005. Stripe rust: Understanding the disease in wheat. Department of Primari Industries, State of New South Wales, Australia.
- Rapilly F. 1979. Yellow rust epidemiology. Annu. Rev. Phytopathol. 17: 59-73.
- Rodríguez-Algaba J, Walter S, Sørensen CK, Hovmøller MS y Justesen AF. 2014. Sexual structures and recombination of the wheat rust fungus Puccinia striiformis on Berberis vulgaris. Fungal Genetics and Biology, 70: 77-85.
- Roelfs AP, Sing RP, Saari EE, Broers LHM y Hettel GP. 1992. Rust diseases of wheat. Concepts and methods of disease Management. CIMMYT México DF, 81 p.
- Salazar J. 1956. Las royas del trigo. Ministerio de Agricultura, Publicaciones de Capacitación Agrícola, Madrid, Julio 1956, Nº. 13-56 H, cuadernillo de 12 p.
- Sørensen CK, Hovmøller MS, Leconte M, Dedryver F y de Vallavieille-Pope C. 2014. New races of Puccinia striiformis found in Europe reveal race specificity of long-term effective adult plant resistance in wheat. Phytopathology 104: 1042-1051.
- Wolf E. 2010. Wheat stripe rust. Kansas State University Agricultural Experiment Station and Cooperative Extension Service. EP-167. April 2010.
- Zúñiga J, Lezaún JA, Biurrun R y Garnica I. 2012. Roya amarilla. Enfermedad antigua, problemas modernos. Navarra Agraria, 7-13.

























