El CHMP recomienda la aprobación de ixekizumab (Taltz) de Lilly para el tratamiento de la psoriasis en placas de moderada a grave
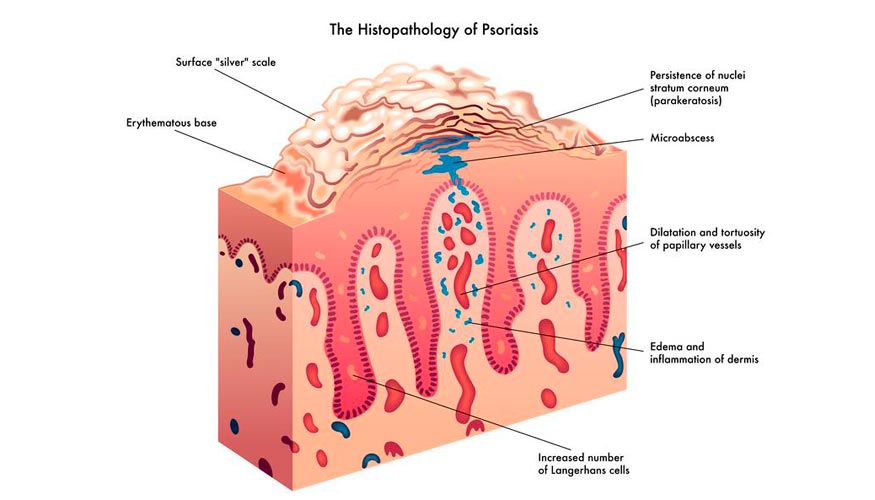
Lilly ha anunciado que ixekizumab (Taltz) ha recibido la opinión positiva del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) para el tratamiento en Europa de pacientes adultos con psoriasis en placas de moderada a grave candidatos a terapia sistémica. Ixekizumab se ha diseñado para intervenir específicamente contra la citoquina inflamatoria interleucina 17A (IL-17A), una proteína que juega un papel clave en el proceso inflamatorio subyacente de la psoriasis.
“La psoriasis es una enfermedad crónica, que puede tener manifestaciones graves, causar un impacto social y psicológico importante, e incluso llegar a ser discapacitante en algunas ocasiones”, señaló Andrew Hotchkiss, presidente de Lilly BioMedicinas en Europa y Canadá. “Esta opinión positiva del CHMP es un hito importante en nuestra búsqueda para ofrecer a los médicos una nueva opción terapéutica para sus pacientes con psoriasis en placas de moderada a grave”.
La opinión del CHMP está basada en los resultados del mayor programa de ensayo clínico fase III, en psoriasis de moderada a grave evaluado hasta la fecha. Este programa de desarrollo clínico incluye tres estudios Fase III multicéntricos y doble ciego -UNCOVER-1, UNCOVER-2 y UNCOVER-3- que demuestran la eficacia y la seguridad de ixekizumab en más de 3.800 pacientes con psoriasis en placas de moderada a grave en 21 países.
Éste es el primer paso hacia la aprobación de ixekizumab en Europa. La opinión positiva del CHMP se remite ahora a la Comisión Europea, que tiene la autoridad para aprobar medicamentos en la Unión Europea. Se espera una decisión final sobre la autorización de comercialización en los próximos tres meses.