Nuevas estrategias para la mejora genética del contenido en compuestos bioactivos en hortalizas: la berenjena como ejemplo
En muchos cultivos hortícolas, los programas de mejora genética han atendido principalmente a aspectos como la productividad, resistencia a enfermedades, uniformidad del producto y la calidad externa, haciéndose poco énfasis en el contenido en compuestos beneficiosos para la salud. Sin embargo, en los últimos años, existe un interés creciente por parte de los consumidores en productos vegetales más sanos y que protejan frente a enfermedades. Es por ello que los programas de mejora genética van paulatinamente incorporando la mejora del contenido en compuestos bioactivos beneficiosos para la salud humana y que prevengan enfermedades entre sus objetivos.

Introducción
Entre los objetivos más importantes de mejora del contenido en compuestos bioactivos se encuentra el de incrementar el contenido en sustancias con poder antioxidante. En este sentido, los polifenoles están adquiriendo un interés creciente por sus múltiples efectos beneficiosos, habiéndose demostrado que muchos de ellos tienen un alto poder antioxidante (Crozier et al., 2009; Dai y Mumper, 2010). Además, muchos de los compuestos fenólicos tienen una gran estabilidad térmica, por lo que la degradación de los mismos es mínima incluso después de ser cocinados o procesados (Friedman y Jürgens, 2000; Lo Scalzo et al., 2010).
Dentro de las especies hortícolas, la berenjena (Solanum melongena L.) es una de las más ricas en compuestos fenólicos (Prohens et al., 2007; Kwon et al., 2008; Raigón et al., 2008; Luthria et al., 2010), lo cual le confiere un alto poder antioxidante (Tabla 1). Es por ello que el desarrollo de nuevas variedades con un mayor contenido en polifenoles es un objetivo de mejora en este cultivo.
La utilización de herramientas genómicas puede dar lugar a un importante impulso y a mejorar la eficiencia de los programas de mejora del contenido en polifenoles (Diamanti et al., 2011). A este respecto, en nuestro grupo trabajamos en el desarrollo de herramientas y metodologías modernas, así como en la obtención de material vegetal para la mejora del contenido en polifenoles de la berenjena. Así, el desarrollo de líneas de introgresión, la piramidación de genes implicados en la ruta de acumulación de compuestos fenólicos en berenjena (ácido clorogénico) y el desarrollo de nuevos marcadores que permitan una selección asistida más eficaz facilitarán la explotación de la variación intraespecífica e interespecífica, así como la aplicación de metodologías de mejora genética que permitan conseguir el desarrollo de nuevas variedades con mayor contenido en compuestos bioactivos.
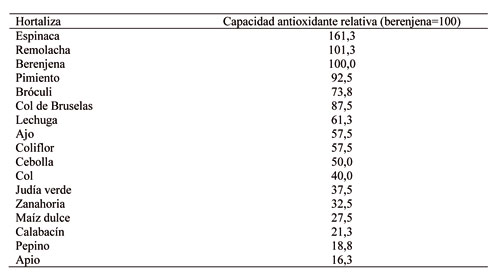
Tabla 1. Comparación de la capacidad antioxidante (en base a peso seco) de la berenjena (valor relativo 100) y de otras hortalizas según el método ORACROC (modificado de Cao et al., 1996).
Los compuestos fenólicos de la berenjena
Los principales compuestos fenólicos de la berenjena consisten en conjugados del ácido hidroxicinámico, los cuales se encuentran en la carne del fruto (Stommel y Whitaker, 2003; Whitaker y Stommel, 2003; Luthria et al., 2010). Las antocianinas presentes en la piel del fruto y responsables del color morado representan una parte relativamente menor en lo que respecta a su contribución a las propiedades bioactivas del fruto de berenjena (Azuma et al., 2008).
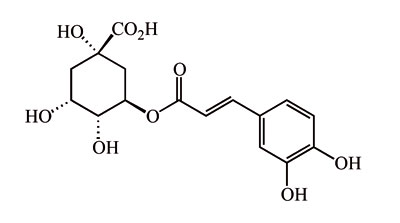
El principal compuesto fenólico de la carne de la berenjena es el ácido clorogénico (Figura 1) constituyendo entre un 70 y un 95% de los polifenoles totales de la carne de la berenjena, por lo que en berenjena el contenido en polifenoles totales presenta un alto nivel de correlación con el contenido en ácido clorogénico (Stommel and Whitaker, 2003; Luthria et al., 2010). El ácido clorogénico es un potente antioxidante, y se ha demostrado que retrasa el envejecimiento, tiene actividad antitumoral, presenta propiedades cardioprotectoras, actuando como hipotensor e hipolipemiante, y a nivel metabólico es capaz de regular los niveles de glucosa en sangre, inhibir la acumulación de grasa y muestra propiedades hepatoprotectoras (Sawa et al., 1998; Triantis et al., 2005; Fernández-Pachón et al., 2008; Kwon et al., 2008; Akanitapichat et al., 2010; Dai y Mumper, 2010; Das et al., 2011; Ma et al., 2014; Zheng et al., 2014; Huang et al., 2014; Onakpoya et al., 2014; Naso et al., 2014; Oboh et al., 2014).
A este respecto, el ácido clorogénico presenta una buena biodisponibilidad, tiene un poder antioxidante superior al de la vitamina C o vitamina E y es muy termoestable, de forma que su después del procesado de alimentos, incluyendo la cocción, fritura, asado, etc., su concentración no disminuye de forma significativa e incluso en algunos casos, como en berenjena, aumenta (Gazzani et al., 1998; Lo Scalzo et al., 2010). Es por ello que el desarrollo de variedades de berenjena con una mayor concentración en polifenoles, y en particular de ácido clorogénico, en la carne del fruto es de interés en la mejora de la calidad nutracéutica de la berenjena.
Variación para el contenido en polifenoles en berenjena
Nuestros trabajos previos y los de otros autores muestran que existe una considerable variación en berenjena para el contenido en ácido clorogénico, así como en polifenoles totales, con diferencias de más de cinco veces dentro de la especie cultivada, y con valores mucho más elevados en algunas especies silvestres (Figura 2) que en la cultivada (Stommel y Whitaker, 2003; Whitaker y Stommel, 2003; Hanson et al., 2006; Prohens et al., 2007; Raigón et al., 2008; Okmen et al., 2009).
En nuestro grupo hemos realizado una evaluación del contenido en polifenoles totales en la carne de berenjena en un amplio número de variedades de berenjena, de forma que hemos encontrado importantes diferencias en el contenido en polifenoles totales en la especie cultivada que varían desde menos de 200 mg/kg hasta más de 800 mg/kg en peso fresco (Prohens et al., 2007; Raigón et al., 2008, 2010). En otros estudios más recientes hemos encontrado que los niveles de ácido clorogénico, medidos mediante HPLC, muestran niveles similares de variación (Figura 3). Esto indica que, tal como hemos comprobado con anterioridad, estos materiales presentan una alta diversidad no sólo morfológica y genética (Prohens et al., 2005; Muñoz-Falcón et al., 2008, 2009a, 2009b, 2011), sino también para el contenido en ácido clorogénico.
Es de destacar que el valor medio del contenido en polifenoles en las variedades comerciales es, como media, menor que el de los materiales tradicionales (Stommel y Whitaker, 2003; Whitaker y Stommel, 2003; Prohens et al., 2007; Raigón et al., 2008). Este hecho probablemente sea debido a que uno de los criterios de selección de las variedades comerciales es que presenten un bajo pardeamiento de la carne del fruto (Figura 4). Dado que los polifenoles al oxidarse dan lugar al pardeamiento de la carne (Macheix et al., 1990), es probable que la selección por bajo pardeamiento haya resultado en la selección indirecta en las variedades modernas por bajo contenido en polifenoles. En consecuencia, por su menor contenido en polifenoles, las variedades modernas presentan, como media, un menor valor nutracéutico que las variedades tradicionales (Stommel y Whitaker, 2003; Whitaker y Stommel, 2003; Prohens et al., 2007; Raigón et al., 2008).

Figura 2. Materiales de variedades tradicionales de berenjena con amplia diversidad para el contenido en polifenoles (arriba) y de especies silvestres relacionadas con alto contenido en polifenoles (S. incanum: abajo izquierda; S. dasyphyllum: abajo derecha).
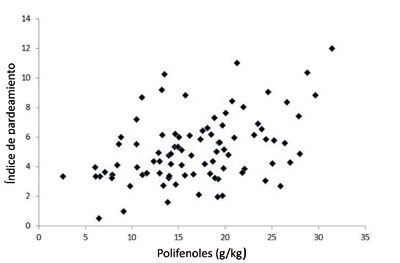
Estos resultados muestran que existen fuentes de variación de gran interés para el desarrollo de nuevas variedades de berenjena con un mayor contenido en polifenoles. No obstante, el éxito de una nueva variedad de berenjena rica en polifenoles dependerá también de conseguir aúnar esta característica deseable con una apariencia atractiva, en este caso un grado de pardeamiento bajo. A este respecto, hemos encontrado que existe una correlación positiva entre el contenido en polifenoles y el grado de pardeamiento. Sin embargo, el porcentaje de variación total del grado de pardeamiento debido al contenido en polifenoles (parámetro r2) es bajo, usualmente inferior al 20%, indicando que otros factores contribuyen de forma sustancial a la variación en el grado de pardeamiento (Prohens et al., 2007). Así, varios autores han encontrado diferencias entre variedades de berenjena para la actividad polifenoloxidasa (Dogan et al., 2002; Shetty et al., 2011), lo cual puede dar lugar a diferencias en el grado de pardeamiento de la carne del fruto entre variedades con contenidos similares en polifenoles totales o en ácido clorogénico. Así, es posible encontrar variedades con valores altos para el contenido en polifenoles y moderados para el pardeamiento (Figura 5).
Por otra parte, es conveniente indicar que aunque algunos compuestos fenólicos tienen sabor amargo (Macheix et al., 1990), el amargor y retrogusto de algunas variedades de berenjena es causado por saponinas y glicoalcaloides (Aubert et al., 1998; Sánchez-Mata et al., 2010) y no por el ácido clorogénico, el cual no posee sabor amargo a las concentraciones presentes en berenjena (Nagel et al., 2006).
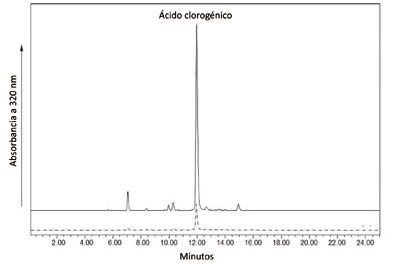
Figura 3: Cromatogramas (HPLC) representativo en el que se aprecia que el ácido clorogénico es el principal compuesto fenólico de la carne de berenjena.
Estrategias modernas de mejora de la calidad nutracéutica en berenjena
Las estrategias convencionales de mejora de la calidad nutracéutica en berenjena se han basado en la obtención de híbridos entre materiales con alto contenido en polifenoles o el desarrollo de líneas obtenidas a partir de cruzamientos complementarios o transgresivos que permiten obtener materiales con un mayor contenido en polifenoles totales y en ácido clorogénico. Por otra parte, las generaciones de retrocruzamiento de la especie silvestre S. incanum hacia S. melongena también muestran que es posible seleccionar materiales con mayor contenido en polifenoles. Sin embargo, varios estudios realizados por nuestro grupo muestran que la heredabilidad del caracter contenido en polifenoles totales es moderada (alrededor de 0.50) (Prohens et al., 2007; Raigón et al., 2008; Prohens et al., 2012). Ello indica que, aunque mediante selección fenotípica es posible obtener materiales con contenidos altos en ácido clorogénico, sería deseable utilizar otro tipo de metodologías, como la selección asistida por marcadores moleculares, que mejoren la eficiencia de la selección. Es evidente que la utilización de aproximaciones que requieren de desarrollos avanzados en el campo de los marcadores moleculares, como el desarrollo de líneas de introgresión, la piramidación de genes, o la disponibilidad de nuevos marcadores, pueden suponer un avance considerable en la mejora de la eficiencia de la selección (Frary et al., 2007; Daunay, 2008; Pérez de Castro et al., 2012).
En este sentido, en nuestro grupo desarrollamos estrategias que pretenden un avance cualitativo en la mejora del contenido en polifenoles en general, y en ácido clorogénico en particular, mediante el desarrollo de herramientas que permitan la selección a nivel genotípico, de forma que se obtenga una mayor eficiencia en el desarrollo de los programas de mejora.

Desarrollo de líneas de introgresión
Una colección de líneas de introgresión es un conjunto de líneas puras con un fragmento de genoma de un donante, habitualmente una especie relacionada, en el fondo genético de un receptor. De esta forma, una colección completa de líneas de introgresión reconstituye el genoma del parental donante en segmentos cromosómicos solapantes y además se considera como 'inmortal', ya que se puede propagar por autofecundación (Lippman et al., 2007). De esta forma, las líneas de introgresión facilitan el análisis genético de los caracteres complejos así como la transferencia de los caracteres de interés propios de las especies silvestres a las especies cultivadas y además son muy efectivas para la identificación y estabilización de QTLs, ya que las diferencias fenotípicas entre una línea de introgresión y el parental recurrente se deben únicamente al fragmento introgresado.
A este respecto, las líneas de introgresión permiten una mejor resolución y detección de QTLs que las poblaciones convencionales (Zamir, 2001). En otros cultivos importantes, como el tomate o el arroz, las líneas de introgresión han sido muy útiles para la mejora de caracteres de interés agronómico (Eshed y Zamir, 1995; Monforte y Tanksley, 2000; Lippman et al., 2007; Fukuoka et al., 2010).
En el caso de la berenjena, la disponibilidad de una colección de líneas de introgresión del ancestro silvestre S. incanum en el fondo genético de S. melongena será de gran utilidad para identificar las regiones genómicas de esta especie silvestre que presentan QTLs o genes que influyen positivamente en el aumento en el contenido de polifenoles y de ácido clorogénico. Por otra parte, la disponibilidad de varias líneas de introgresión que presentan distintos fragmentos cromosómicos de S. incanum y que tienen mayores contenidos en polifenoles permite la realización de cruzamientos entre las mismas, de forma que se puedan obtener nuevos materiales complementarios con un contenido mejorado en dichos caracteres de interés nutracéutico. Esta estrategia ha sido demostrada con otros caracteres en otros cultivos (Lippman et al., 2007).
Para la obtención de una colección de líneas de introgresión es necesario disponer de un mapa genético que cubra el genoma completo, con marcadores distribuidos por el mismo, y con una densidad de marcadores suficiente para alcanzar el objetivo. En nuestro caso disponemos de un mapa genético obtenido a partir del primer retrocruzamiento hacia S. melongena del híbrido entre S. melongena y S. incanum (Vilanova et al., 2010). Este mapa cubre los 12 grupos de ligamiento de la berenjena y nos ha permitido ir seleccionando materiales en las distintas generaciones de retrocruzamiento, de forma que en estos materiales se encuentra representado el genoma completo de S. incanum. A partir del híbrido F1 y del retrocruzamiento hacia S. melongena (Figura 6) estamos desarrollando una colección de líneas de introgresión de S. melongena en la que se encuentre representado el genoma de S. incanum.

Piramidación de genes
La estrategia de piramidación de genes consiste en acumular en un solo genotipo, alelos favorables de genes que afectan a un caracter y que han sido identificados en múltiples parentales (Joshi y Nayak, 2010; Ishii y Yonezawa 2007a). Los esquemas de piramidación presentan varias fases. En una primera fase se trata de la identificación de parentales que presenten alelos favorables para uno o más genes de interés para la piramidación (Ishii y Yonezawa, 2007a). De esta forma, se seleccionan un número mínimo de parentales que presenten los alelos deseados que se desean acumular en un solo genotipo. La siguiente fase es la denominada de pedigree, en la que se trata de acumular todos los alelos favorables en un solo genotipo, que se denomina genotipo raíz. En la tercera y última fase, conocida como fase de fijación trata de la fijación en homocigosis en un único material de todos los alelos de interés (Ishii y Yonezawa, 2007b).
La piramidación de genes ha sido ampliamente utilizada en la resistencia a enfermedades en muchos cultivos. Es habitual que para una determinada enfermedad existan varios genes, cada uno de ellos con distintos alelos, y para los cuales es posible construir un genotipo con alelos de resistencia a distintas razas de un patógeno (Joshi y Nayak, 2010; Pérez de Castro et al., 2012). Sin embargo, un uso todavía no explorado es la piramidación de genes implicados en la ruta de síntesis de un compuesto de interés nutracéutico.
En el caso de la berenjena, como en el resto de solanáceas de fruto (Clé et al., 2008), se conoce la ruta de síntesis del principal compuesto fenólico de la carne del fruto (ácido clorogénico) (Figura 7).
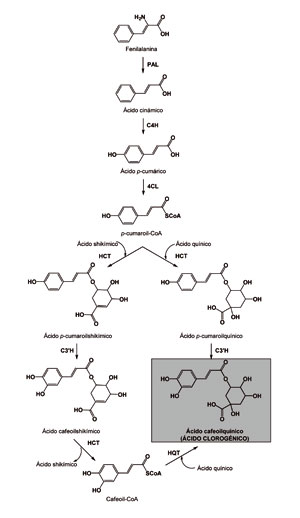
A este respecto, los distintos genes de la ruta de acumulación de ácido clorogénico en berenjena (PAL (fenilalanina amonio-liasa), C4H (cinamato 4-hidroxilasa), 4CL (4-cumarato:coenzima A ligasa), HCT (hidroxicinamoil transferasa), C3’H (p-cumaroil-coA 3’-hidroxilasa) y HQT (hidroxicinamoil CoA quinato transferasa)) son conocidos, estando disponible su secuencia (Niggeweg et al., 2004; Comino et al., 2007, 2009; Mahesh et al., 2007; Jöet et al., 2010; Menin et al., 2010), por lo que la búsqueda de variantes alélicas es posible mediante la secuenciación de los alelos presentes en los distintos materiales de berenjena. En nuestro caso, hemos buscado polimorfismos para estos genes entre la especie cultivada y la especie silvestre S. incanum, lo cual nos ha permitido situar los genes de la ruta de acumulación del ácido clorogénico en el mapa genético que hemos desarrollado. Por otra parte, una vez identificadas distintas variantes alélicas se deben determinar las más favorables, lo cual puede llevarse a cabo mediante análisis de la expresión génica, tal como se ha realizado en café (Lepelley et al., 2007).
Aunque como se ha comentado anteriormente no se han llevado a cabo trabajos de piramidación para caracteres de calidad en berenjena, sí que se dispone de evidencias de que esta estrategia puede ser de efectividad. Así, Niggeweg et al. (2004) han conseguido plantas de tabaco y tomate que sobreexpresan el gen de la HQT, lo cual induce una mayor acumulación de ácido clorogénico en los tejidos de la planta, lo cual indica que mediante la alteración de la expresión génica de los genes implicados en la síntesis de ácido clorogénico sería posible obtener materiales con una mayor concentración en este compuesto.
Conclusión
El uso de estas nuevas estrategias para la mejora genética de la berenjena nos proporcionará una gran cantidad de nuevos recursos genómicos y genéticos que ampliaran de manera cualitativa los ya existentes y que supondrán una herramienta útil para la mejora genética del contenido en compuestos bioactivos. En particular, la obtención de líneas de introgresión y la piramidación de genes nos permitirá obtener materiales de berenjena con un mayor contenido en polifenoles en general y en ácido clorogénico en particular. Estos materiales supondrán material de élite para el desarrollo de una nueva generación de variedades comerciales de berenjena con un mayor contenido en compuestos bioactivos. Esta aproximación moderna puede servir como ejemplo para la mejora de la calidad de otras hortalizas.
Agradecimientos
Los trabajos aquí presentados han sido financiados por el Ministerio de Economía y Competitividad y Feder (proyecto AGL2012-34213) y por la Conselleria d’Educació i Esport de la Generalitat Valenciana (ayuda ACOMP/2014/191). Pietro Gramazio agradece a la Universitat Politècnica de Valencia la concesión de una beca predoctoral.
Bibliografía
Akanitapichat, P.; Phraibung, K.; Nuchklang, K.; Prompitakkul, S. 2010. Antioxidant and hepatoprotective activities of five eggplant varieties. Food and Chemical Toxicology 10:3017-3021.
Alagna, F.; D'Agostino, N.; Torchia, L.; Servili, M.; Rao, R.; Pietrella, M.; Giuliano, G.; Chiusano, M.L.; Baldoni, L.; Perrotta, G. 2009. Comparative 454 pyrosequencing of transcripts from two olive genotypes during fruit development. BMC Genomics 10:399.
Aubert, S.; Daunay, M.C.; Pochard, E. 1989. Saponsides stéroidiques de l’aubergine (Solanum melongena L.) I. Intérêt alimentaire, méthodologie d’analyse, localisation dans fruit. Agronomie 9:641-651.
Azuma, K.; Ohyama, A.; Ippoushi, K.; Ichiyanagi, T.; Takeuchi, A.; Saito, T.; Fukuoka, H. 2008. Structures and antioxidant activity of anthocyanins in many accessions of eggplant and its related species. Journal of Agricultural and Food Chemistry 56:10154-10159.
Barchi L.; Lanteri S.; Portis E.; Stagel A.; Valé, G.; Toppino L.; Rotino, G.L. 2010. Segregation distortion and linkage analysis in eggplant (Solanum melongena L.). Genome 53:805-815.
Barchi, L.; Lanteri, S.; Portis, E.; Acquadro, A.; Valè, G.; Toppino, L.; Rotino, G.L. 2011. Identification of SNP and SSR markers in eggplant using RAD tag sequencing. BMC Genomics 12:304.
Batley, J.; Barker, G.; O'Sullivan, H.; Edwards, K.J.; Edwards, D. 2003. Mining for single nucleotide polymorphisms and insertions/deletions in maize expressed sequence tag data. Plant Physiology 132:84-91.
Batley, J.; Hopkins, C.J.; Cogan, N.O.I.; Hand, M.; Jewell, E.; Kaur, J.; Kaur, S.; Li, X.; Ling, A.E.; Love, C.; Mountford, H.; Todorovic, M.; Vardy, M.; Walkiewicz, M.; Spangenberg, G.C.; Edwards, D. 2007. Identification and characterisation of Simple Sequence Repeat (SSR) markers from Brassica napus expressed sequences. Molecular Ecology Notes 7: 886-889.
Cao, G.; Sofic, E.; Prior, R.L. 1996. Antioxidant capacity of tea and common vegetables. Journal of Agricultural and Food Chemistry 44:3426-3431.
Clé, C.; Hill, L.M.; Niggeweg, R.; Martin, C.R.; Guisez, Y.; Prinsen, E.; Jansen, M.A.K. 2008. Modulation of chlorogenic acid biosynthesis in Solanum lycopersicum: consequences for phenolic accumulation and UV-tolerance. Phytochemistry 69:2149-2156.
Comino, C.; Lanteri, S.; Portis, E.; Acquadro, A.; Romani, A.; Hehn, A.; Larbat, R.; Bourgaud, F. 2007. Isolation and functional characterization of a cDNA coding a hydroxycinnamoyltransferase involved in phenylpropanoid biosynthesis in Cynara cardunculus L. BMC Plant Biology 7:14.
Comino, C.; Hehn, A.; Moglia, A.; Menin, B.; Bourgaurd, F.; Lanteri, S.; Portis, E. 2009. The isolation and mapping of a novel hydroxycinnamoyltransferase in the globe artichoke chlorogenic pathway. BMC Plant Biology 9:30.
Crozier, A.; Jaganath, I.B.; Clifford, M.N. 2009. Dietary phenolics: chemistry, bioavailability and effects on health. Natural Products Reports 26:1001-1043.
Dai, J.; Mumper, R.J. 2010. Plant phenolics: extraction, analysis and their antioxidant and anticancer properties. Molecules 15:7313-7352.
Das, S.; Raychaudhuri, U.; Falchi, M.; Bertelli, A.; Braga, P.C.; Das, D.K. 2011. Cardioprotective properties of raw and cooked eggplant (Solanum melongena L.). Food and Function 7:395-399.
Daunay, M.C. Eggplant, pp. 163-220. En: Prohens, J.; Nuez, F. (eds.). Handbook of plant breeding Vol 2: Vegetables II. Springer, New York, NY, USA.
Deschamps, S.; M.A. Campbell. 2010. Utilization of next-generation sequencing platforms in plant genomics and genetic variant discovery. Molecular Breeding 25:553-570.
Diamanti, J.; Battino, M.; Mezzetti, B. 2011. Breeding for fruit nutritional and nutraceutical quality, pp.: en prensa. En: Jenks, M.A.; Bebeli, P.J. (eds.). Breeding for fruit quality. John Wiley & Sons Inc., Hoboken, NJ, USA.
Dogan, M., Arslan, O.; Dogan, S. 2002. Substrate specificity, heat inactivation and inhibition of polyphenol oxidase from different aubergine cultivars. International Journal of Food Science and Technology 37:415-423.
Doganlar, S.; Frary, A.; Daunay, M.C.; Lester, R.N.; Tanksley, S.D. 2002a. A comparative genetic linkage map on eggplant (Solanum melongena) and its implications for genome evolution on Solanaceae. Genetics 161:1697-1711.
Doganlar, S.; Frary, A.; Daunay, M.C.; Lester, R.N.; Tanksley, S.D. 2002b. Conservation of gene function in the Solanaceae as revealed by comparative mapping of domestication traits in eggplant. Genetic, 161:1713-1726.
Eshed, Y.; Zamir, D. 1995. An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL. Genetics 141:1147-1162.
Fernández-Panchón, M.S.; Villano, D.; Troncoso, A.M.; García-Parrilla, M.C. 2008. Antioxidant activity of phenolic compounds: from in vitro results to in vivo evidence. Critical Reviews in Food Science and Nutrition 48:649-671.
Frary, A.; Doganlar, S.; Daunay, M.; Tanksley, S. 2003. QTL analysis of morphological traits in eggplant and implications for conservation of gene function during evolution of solanaceous species. Theoretical and Applied Genetics 107:359-370.
Frary, A.; Doganlar, S.; Daunay, M.C. 2007. Eggplant, pp. 286-313. En: Kole, C. (ed.). Genome mapping and molecular breeding in plants Vol 5: Vegetables. Springer, Berlin - Heidelber, Alemania.
Friedman, M.; Jürgens, H.S. 2000. Effect of pH on the stability of plant phenolic compounds. Journal of Agricultural and Food Chemistry 48:2101-2110.
Fukuoka, S.; Nonoue, Y.; Yano, M. 2010. Germplasm enhancement by developing advanced materials from diverse rice accessions. Breeding Science 60:509-517.
Fukuoka, H.; Yamaguchi, H.; Nunome, T.; Negoro, S.; Miyatake, K.; Ohyama, A. 2010. Accumulation, functional annotation, and comparative analysis of expressed sequence tags in eggplant (Solanum melongena L.), the third pole of the genus Solanum species after tomato and potato. Gene 450:76-84.
Ganal, M.W.; Altmann, T.; Röder, M.S. 2009. SNP identification in crop plants. Current Opinion in Plant Biology 12:211-217.
Garg, K.; Green, P.; Nickerson, D.A. 1999. Identification of candidate coding region single nucleotide polymorphisms in 165 human genes using assembled expressed sequence tags. Genome Research 9:1087-1092.
Gazzani, G.; Papetti, A.; Massolini, G.; Daglia, M. 1998. Anti- and prooxoidant activity of water soluble components of some common diet vegetables and the effect of thermal treatment. Journal of Agricultural and Food Chemistry 46:4118-4122.
Hanson, P.M.; Yang, R.Y.; Tsou, S.C.S.; Ledesma, D.; Engle, L.; Lee, T.C. 2006. Diversity in eggplant (Solanum melongena) for superoxide scavenging activity, total phenolics, and ascorbic acid. Journal of Food Composition and Analysis 19:594-600.
Huang, K., Liang, X.C., Zhong, Y.L., He, W.Y., Wang, Z. 2014. 5-Caffeoylquinic acid decreases diet-induced obesity in rats by modulating PPARα and LXRα transcription. Journal of the Science of Food and Agriculture: en prensa.
Ishii, T.; Yonezawa, K. 2007a. Optimization of the marker-based procedures for pyramiding genes from multiple donor lines: I. Schedule of crossing between the donor lines. Crop Sience 47:537-546.
Ishii, T.; Yonezawa, K. 2007b. Optimization of the marker-based procedures for pyramiding genes from multiple donor lines: II. Strategies for selecting the objective homozygous plant. Crop Sience 47:1878-1886.
Joët, T.; Salmona, J.; Laffargue, A.; Descroix, F.; Dussert, S. 2010. Use of the growing environment as a source of variation to identify the quantitative trait transcripts and modules of co-expressed genes that determine chlorogenic acid accumulation. Plant, Cell and Envirnoment 33:1220-1233.
Joshi, R.K.; Nayak, S. 2010. Gene pyramiding - a broad spectrum technique for developing durable stress resistance in crops. Biotechnology and Molecular biology Review 5:51-60.
Kim, H; Baek, K; Lee, S; Kim, J; Lee, B; Cho, H; Kim, WT; Choi, D; Hur, CG. 2008. Pepper EST database: comprehensive in silico tool for analyzing the chili pepper (Capsicum annuum) transcriptome, BMC Plant Biology 8:10.
Kwon, Y.I.; Apostolidis, E.; Shetty, K. 2008. In vitro studies of eggplant (Solanum melongena) phenolics as inhibitors of key enzimes relevant for type 2 diabetes and hypertension. Bioresource Technology 99:2981-2988.
Lepelley, M.; Cheminade, G.; Tremillon, N.; Simkin, A.; Caillet, V.; McCarthy, J. 2007. Chlorogenic acid synthesis in coffee: an analysis of CGA content and real-time PCR expression of HCT, HQT, C3H1, and CCoAOMT1 genes during grain development in C. canephora. Plant Science 127:978-996.
Lippman, Z.B.; Semel, Y.; Zamir, D. 2007. An integrated view of quantitative trait variation using tomato interspecific introgression lines. Current Opinion in Genetics and Development 17:545-552.
Lo Scalzo, R.; Fibiani, M.; Mennella, G.; Rotino, G.L.; Dal Sasso, M.; Culici, M.; Spallino, A.; Braga, P.C. 2010. Thermal treatment of eggplant (Solanum melongena L.) increases the antioxidant content and the inhibitory effect on the human neutrophil burst. Journal of Agricultural and Food Chemistry 58:3371-3379.
Luthria, D.; Singh, A.P.; Wilson, T.; Vorsa, N.; Banuelos, G.S.; Vinyard, B.T. 2010. Influence of conventional and organic agricultural practices on the phenolic content in eggplant pulp: plant-to-plant variation. Food Chemistry 121:406-411.
Ma, Y., Gao, M., Liu, D. 2014. Chlorogenic acid improves high fat diet-induced hepatic steatosis and insulin resistance in mice. Pharmaceutical Research:en prensa.
Macheix, J.J.; Fleuriet, A.; Billot, J. 1990. Fruit phenolics. CRC Press, Boca Raton, FL, USA.
Mahesh, V.; Million-Rousseau, R.; Ullmann, P.; Chabrillange, N.; Bustamante, J.; Mondolot, L.; Morant, M.; Noirot, M.; Hamon, S.; de Kockko, A.; Werck-Reichhart, D.; Campa, C. 2007. Functional characterization of two p-coumaroyl ester 3’-hydroxilase genes from coffee tree: evidence of a candidate for chlorogenic acid biosynthesis. Plant Molecular Biology 64:145-159.
Menin, B.; Comino, C.; Moglia, A.; Dolzhenko, Y.; Portis, E.; Lanteri, S. 2010. Identification and mapping of genes related to caffeoylquinic acid synthesis in Cynara cardunculus. Plant Science 179:338-347.
Ministerio de Medio Ambiente y Medio Rural y Marino. 2010. Anuario de Estadística 2010. Ministerio de Medio Ambiente y Medio Rural y Marino, Madrid.
Monforte, A.J.; Tanksley, S.D. 2000. Development of a set of near isogenic and backcross recombinant inbred lines containing most of the Lycopersicon hirsutum genome in a L. esculentum background: a tool for gene mapping and discovery. Genome 43:803-813.
Mueller, L.A.; Solow, T.H.; Taylor, N.; Skwarecki, B.; Buels, R.; Binns, J.; Lin, C.; Wright, M.H.; Ahrens, R.; Wang, Y.; Herbst, E.V.; Keyder, E.R.; Menda, N.; Zamir, D.; Tanksley, S.D. 2005. The SOL Genomics Network: a comparative resource for Solanaceae biology and beyond. Plant Physiology 138:1310-1317.
Muñoz-Falcón, J.E.; Prohens, J.; Vilanova, S.; Nuez, F. 2008. Characterization, diversity, and relationships of the Spanish (Listada) eggplants: a model for the enhancement and protection of local heirlooms. Euphytica 164:405-419.
Muñoz-Falcón, J.E.; Prohens, J.; Vilanova, S.; Ribas, F.; Castro, A.; Nuez, F. 2009a. Distinguishing a protected geographical indication vegetable (Almagro eggplant) from closely related varieties with selected morphological traits and molecular markers. Journal of the Science of Food and Agriculture 89:320-328.
Muñoz-Falcón, J.E.; Prohens, J.; Vilanova, S.; Nuez, F. 2009b. Diversity in commercial varieties and landraces of black eggplants and implications for broadening the breeders gene pool. Annals of Applied Biology 154:453-465.
Muñoz-Falcón, J.E.; Vilanova, S.; Plazas, M.; Prohens, J. 2011. Diversity, relationships and genetic fingerprinting of the Listada de Gandía eggplant landrace using genomic SSRs and EST-SSRs. Scientia Horticulturae 129:238-246.
Nagel, C.W.; Herrick, I.W.; Graber, W.R. 2006. Is chlorogenic acid bitter?. Journal of Food Science 52:213-213.
Naso, L.G., Valcarcel, M., Roura-Ferrer, M., Kortazar, D., Salado, C., Lezama, L., Rojo, T., González-Baró, A.C., Williams, P.A., Ferrer, E.G. 2014. Promising antioxidant and anticancer (human breast cancer) oxidovanadium(IV) complex of chlorogenic acid. Synthesis, characterization and spectroscopic examination on the transport mechanism with bovine serum albumin. Journal of Inorganic Biochemistry 135:86-99.
Niggeweg R., A.J. Michael, C. Martin. 2004. Engineering plants with increased levels of the antioxidant chlorogenic acid. Nature Biotechnology 22:746-754.
Nunome, T.; Yoshida, T.; Hirai, M. 1998. Genetic linkage map of eggplant. Proceedings of the 10th EUCARPIA Meeting on Genetics and Breeding of Capsicum & Eggplant:239-242.
Nunome, T.; Suwabe, K.; Iketani, H.; Hirai, M. 2003. Identification and characterization of microsatellites in eggplant. Plant Breeding 122:256-262.
Nunome, T.; Negoro, S.; Kono, I.; Kanamori, H.; Miyatake, K.; Yamaguchi, H.; Ohyama, A.; Fukuoka, H. 2009. Development of SSR markers derived from SSR-enriched genomic library of eggplant (Solanum melongena L.). Theoretical and Applied Genetics 119:1143-1153.
Oboh, G., Agunloye, O.M., Adefegha, S.A., Akinyemi, A.J., Ademiluyi, A.O. 2014. Caffeic and chlorogenic acids inhibit key enzymes linked to type 2 diabetes (in vitro): a comparative study. Journal of Basic and Clinical Physiology and Pharmacology: en prensa.
Okmen, B.; Sigva, H.O.; Mutlu, S.; Doganlar, S.; Yemenicioglu, A.; Frary, A. 2009. Total antioxidant activity and total phenolic contents in different Turkish eggplant (Solanum melongena L.) cultivars. International Journal of Food Properties 12:616-624.
Onakpoya, I.J., Spencer, E.A., Thompson, M.J., Heneghan, C.J. 2014. The effect of chlorogenic acid on blood pressure: a systematic review and meta-analysis of randomized clinical trials. Journal of Human Hypertension: en prensa.
Pérez de Castro, A.M.; Vilanova, S.; Cañizares, J.; Pascual, L.; Blanca, J.M.; Díez, M.J.; Prohens, J.; Picó, B. 2012. Application of genomic tools in plant breeding. Current Genomics:en prensa.
Prohens J., Blanca, J.; Nuez, F. 2005. Morphological and molecular variation in a collection of eggplant from a secondary center of diversity: implications for conservation and breeding. Journal of the American Society for Horticultural Science 130: 54-63.
Prohens, J.; Rodríguez-Burruezo, A.; Raigón, M.D.; Nuez, F. 2007. Total phenolic concentration and browning in a collection of different varietal types and hybrids of eggplant: implications for breeding for higher nutritional quality and reduced browning. Journal of the American Society for Horticultural Science 132:638-646.
Prohens, J.; Plazas, M.; Raigón, M.D.; Seguí-Simarro, J.M.; Stommel, J.R.; Vilanova, S. 2012. Characterization of interspecific hybrids and first backcross generations from crosses between two cultivated eggplants (Solanum melongena and S. aethiopicum Kumba group) and implications for eggplant breeding. Euphytica: en prensa.
Quackenbush, J.; Cho, J.; Lee, D.; Liang, F.; Holt, I.; Karamycheva, S.; Parvizi, B.; Pertea, G.; Sultana, R.; White, J. 2001. The TIGR Gene Indices: analysis of gene transcript sequences in highly sampled eukaryotic species.Nucleic Acids Research 29:159–164
Raigón, M.D.; Prohens, J.; Muñoz-Falcón, J.E.; Nuez, F. 2008. Comparison of eggplant landraces and commercial varieties for fruit content of phenolics, minerals, dry matter and protein. Journal of Food Composition and Analysis 21:370-376.
Raigón, M.D.; Rodríguez-Burruezo, A.; Prohens, J. 2010. Effects of organic and conventional cultivation methods on composition of eggplant fruits. Journal of Agricultural and Food Chemistry 58:6833-6840.
Sánchez-Mata, M.C.; Yokoyama, W.E.; Hong, Y.J.; Prohens, J. 2010. -solasonine and -solamargine contents of gboma (Solanum macrocarpon L.) and scarlet (S. aethiopicum L.) eggplants. Journal of Agricultural and Food Chemistry 58:5502-5508.
Sawa T., M. Nakao, T. Akaike, K. Ono, H. Maeda. 1998. Alkylperoxyl radical-scavenging activity of various flavonoids and other phenolic compounds: implications for the anti-tumor promoter effect of vegetables. Journal of Agricultural and Food Chemistry 47:397-402.
Shendure, J.; Ji, H. 2008. Next-generation DNA sequencing. Nature Biotechnology 26:1135-1145.
Shetty, S.M.; Chandrashekar, A.; Venkatesh, Y.P. 2011. Eggplant polyphenol oxidase multigene family: cloning, phylogeny, expression analyses and immunolocalization in response to wounding. Phytochemistry 72:2275-2287.
Stommel J.R.; Whitaker, B.D. 2003. Phenolic acid content and composition of eggplant fruit in a germplasm core subset. Journal of the American Society for Horticultural Science 128:704-710.
Todaro, A.; Cimino, F.; Rapisarda, P.; Catalano, A.E.; Barbagallo, R.N.; Spagna, G. 2009. Recovery of anthocyanins from eggplant peel. Food Chemistry 114:434-439.
Triantis, T.; Stelakis, A.; Dimotikali, D.; Papadopoulos, K. 2005. Investigations on the antioxidant activity of fruit and vegetable aqueous extracts on superoxide radical anion using chemiluminiscence techniques. Anal. Chim. Acta 536:101-105.
Vilanova, S.; Blasco, M.; Hurtado, M.; Muñoz-Falcón, J.E.; Prohens, J.; Nuez, F. 2010. Development of a linkage map based on a S. incanum × S. melongena backcross generation, pp. 435-439. En: Prohens, J.; Rodríguez-Burruezo, A. (eds.), Advances in genetics and breeding of Capsicum and eggplant. Editorial de la Universitat Politècnica de València, Valencia.
Vilanova, S.; Manzur, J.P.; Prohens, J. 2012. Development and characterization of genomic simple sequence repeat markers in eggplant and their application to the study of diversity and relationships in a collection of different cultivar types and origins. Molecular Breeding: en prensa.
Wang, W.; Wang, Y.; Zhang, Q.; Qi, Y.; Guo, D. 2009. Global characterization of Artemisia annua glandular trichome transcriptome using 454 pyrosequencing. BMC Genomics 10:465.
Whitaker, B.D., Stommel, J.R. 2003. Distribution of hydroxycinnamic acid conjugates in fruit of commercial eggplants (Solanum melongena L.) cultivars. Journal of Agricultural and Food Chemistry 51:3448-3454.
Yano, K.; Watanabe, M.; Yamamoto, N.; Tsugane, T.; Aoki, K.; Sakurai, N.; Shibata, D. MiBASE: a database of a miniature tomato cultivar Micro-Tom, 2006. Plant Biotechnology 23:195-198.
Zamir, D. 2001. Improving plant breeding with exotic genetic libraries. Nature Genetics Reviews Genetics 2:983-989.
Zheng, G., Qiu, Y., Zhang, Q.F., Li, D. 2014. Chlorogenic acid and caffeine in combination inhibit fat accumulation by regulating hepatic lipid metabolism-related enzymes in mice. British Journal of Nutrition 112:1034-1040.