Evaluación de la tolerancia a Monilia en cultivares de melocotonero
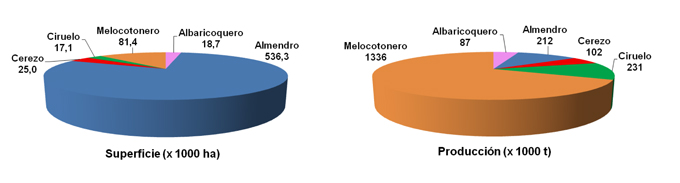
El melocotonero [Prunus persica (L.) Batch] pertenece a la familia Rosaceae, subgénero Amygdalus y género Prunus. Dentro de la familia de las Rosáceas, en el año 2011 fue la tercera especie frutal en importancia a nivel mundial, en términos de producción, por detrás del manzano (75,5 · 106 t). La producción mundial de melocotonero ese año fue de 21,5 · 106 toneladas en una superficie cultivada de 1,57 · 106 hectáreas (Faostat, 2013).
Una de las enfermedades más importantes en melocotonero, la podredumbre parda, moniliosis, o brown rot, está acusada causada por cuatro especies fúngicas del género Monilinia spp (Petróczy et al., 2012): M. laxa (Aderhold & Ruhland) Honey, M. fructigena (Aderhold & Ruhland) Honey, M. fructicola (Winter) Honey y M. polystroma van Leeuwen. En España, la especie más extendida y la que causa las mayores pérdidas en poscosecha es Monilinia laxa (Aderh & Rulh.) Honey (Villarino et al., 2012). Esta especie es la de mayor distribución y mayor diversidad en nuestro país, lo que indica su presencia en nuestros cultivos desde hace varios años (Gell et al., 2007a).
El ataque del hongo se produce tanto en la etapa de floración como en la etapa de maduración de los frutos y la manipulación poscosecha de los mismos. Los síntomas de la podredumbre parda en el fruto consisten en manchas marrones que lo invaden rápidamente, el fruto puede momificarse y quedar fuertemente adherido a la rama durante muchos meses, siendo una fuente importante de inóculo para la cosecha siguiente (Figura 2). En cuanto al grado de susceptibilidad a la infección por Monilinia spp. es variable a lo largo del desarrollo del fruto. La susceptibilidad es elevada durante las primeras etapas del desarrollo del fruto, disminuye durante las etapas de fruta verde y aumenta de nuevo durante el periodo de maduración del melocotón (Gradziel, 1994). Durante el periodo de conservación-comercialización, los daños son también importantes ya que el hongo se ve favorecido por alta humedad relativa y la máxima maduración de los frutos.

Debido a la elevada incidencia de esta enfermedad en España, son numerosas las medidas de control, tanto en la parcela (precosecha), como durante el periodo de conservación-comercialización (poscosecha). Las medidas de control precosecha engloban medidas culturales, tendentes a reducir la cantidad de inóculo en la parcela (poda y eliminación de momias); control químico, mediante el uso de fungicidas; y control biológico mediante la aplicación de hongos antagonistas (Penicillium frequentans y Epicoccum nigrum) (Guijarro et al., 2008, Larena et al., 2010).El control poscosecha consiste en tratamientos físicos, tanto de conservación en frío como tratamientos por calor (Casals et al., 2010); tratamientos químicos con productos de baja toxicidad (chitosan y ácido peracético); y tratamientos biológicos con cepas bacterianas (Bacillus subtilis) (Yanez et al., 2012).
Dado que cada vez existe una mayor preocupación por la aplicación de productos químicos en agricultura, tanto desde el punto de vista medioambiental, como de salud pública, es preciso buscar alternativas con menor riesgo para el consumidor. En este sentido, la disponibilidad de variedades o cultivares más tolerantes y/o resistentes a esta enfermedad fúngica es una de las mejores soluciones para una producción de calidad y sostenible. Aunque la mayoría de los cultivares comerciales de melocotonero son susceptibles a este patógeno (Holb, 2008) es importante buscar cultivares tolerantes a M. laxa y sus enfermedades asociadas.
El objetivo de este trabajo ha sido la puesta a punto de la metodología para la evaluación de la tolerancia a la podredumbre parda causada por Monilinia laxa en cultivares de melocotonero [Prunus persica (L.) Batsch]). Un nuevo protocolo ha sido optimizado para la inoculación de los frutos y su posterior evaluación en condiciones controladas. Además se discutirán los resultados preliminares obtenidos para diseñar las estrategias futuras de evaluación de la colección de germoplasma de melocotonero de la Estación Experimental de Aula Dei.
Metodología para la evaluación de la tolerancia a M. laxa en melocotonero
Los cultivares de melocotonero [Prunus persica (L.) Batsch] estudiados proceden de las colecciones de germoplasma y poblaciones de mejora de la Estación Experimental de Aula Dei-CSIC (Zaragoza). Los genotipos evaluados corresponden a las variedades ‘Catherina’, ‘Venus’ y ‘Calante’, y a descendientes de las poblaciones ‘BabyGold 9’ × ‘VAC-9510’ y ‘BabyGold 9’ × ‘Crown Princess’.
El método consiste en la inoculación in vitro de los genotipos con Monilinia laxa. El inóculo original de M. laxa fue proporcionado por la Unidad de Patología del Irta (Lleida) en placas Petri con medio PDA (Figura 3A).
Para la obtención de esporas se inocularon frutos, previamente desinfectados, con una róndela de 3 mm de medio de cultivo (PDA) de una colonia de M. laxa de 6 días de crecimiento. Los frutos se depositaron en cajas de cartón comerciales cubiertas con una capa de celofán transparente estéril y los extremos ligeramente cerrados con cinta adhesiva. Se incubaron a una temperatura de 23 °C, con 50-60% de humedad relativa, y bajo un fotoperiodo de 12 horas de luz y 12 horas de oscuridad. Posteriormente, se aislaron las esporas y su concentración se midió con un citómetro al microscopio (Figura 3B-C).
En campo, se cosecharon veinticinco frutos sanos y maduros de cada genotipo que se desinfectaron durante 4 minutos por inmersión en una solución al 1,6% alcohol etílico, 1,6% hipoclorito de sodio (comercial), y 0,005% de Tween 80 en agua estéril. Posteriormente, se aclararon con agua estéril y se dejaron secar al aire al menos durante 20 minutos. Para la inoculación con heridas y esporas se realizó una lesión artificial (1 mm x 2 mm) en la posición ecuatorial del fruto, y sobre la herida se inoculó con 25 µL de una suspensión de esporas de concentración 25x103/ml (Figura 3D). Los frutos se depositaron en cajas de cartón comerciales cubiertas con una capa de celofán transparente estéril y los extremos ligeramente cerrados con cinta adhesiva. Se incubaron a una temperatura de 23 °C (12 h día/ 12 h noche) y con 50-60% de humedad relativa (Figura 3E).

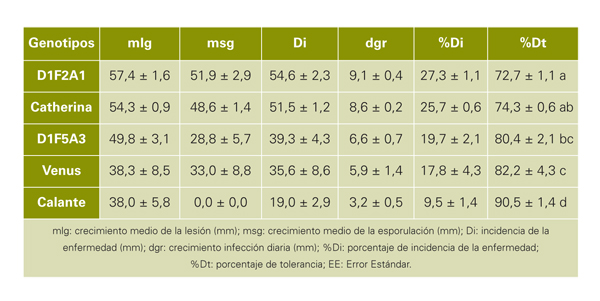
Diariamente se observó la evolución de la enfermedad, y después de seis días de incubación se evaluó la actividad patogénica de la misma. Para cada cultivar se determinó el crecimiento medio de la lesión (mlg) y el crecimiento medio de la esporulación (msg) midiendo los diámetros en dos secciones perpendiculares con un pie de rey digital (Figura 3F, Digimatic Mitutoyo, Alico Equipamientos Industriales, Tamil- Nadu India). El análisis estadístico se realizó con el programa SPSS 19.0 (SPSS Inc.; Chicago, IL).
Resultados y discusión
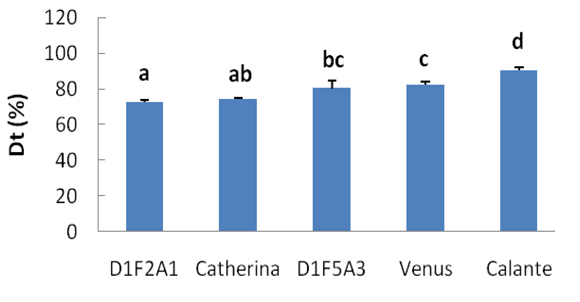
Conclusiones
En este trabajo se describe un método de evaluación de la susceptibilidad a la podredumbre parda causada por Monilinia laxa en frutos de melocotonero. El procedimiento se ha validado con cinco genotipos y se utilizará para la evaluación de la tolerancia o susceptibilidad a la enfermedad del resto de germoplasma de melocotonero de la Estación Experimental de Aula Dei-CSIC. Las diferencias de tolerancia o susceptibilidad encontradas auguran un futuro prometedor para la selección de genotipos tolerantes a Monilinia laxa en los programas de mejora de melocotonero que se están llevando a cabo en la EEAD.
Agradecimientos
A Josep Usall, de la Unidad de Patología del Irta de Lleida, por la cesión del inóculo original de M. laxa. A José Luis Espada, del Departamento de Agricultura del Gobierno de Aragón, que amablemente nos ha proporcionado el genotipo ‘Calante’ y al Centro de Investigación y Tecnología Agroalimentaria de Aragón por el uso de sus instalaciones. Este trabajo ha sido financiado por el Mineco y el Gobierno de Aragón con los proyectos AGL2011-24576 y A44, respectivamente, cofinanciados con fondos FEDER.
Bibliografía
- Casals C., Teixidó N., Viñas I., Cambray J., Usall J. 2010. Control of Monilinia spp. on stone fruit by curing treatments. Part II: The effect of host and Monilinia spp. variables on curing efficacy. Postharvest Biology and Technology, 56: 26-30
- FAOSTAT, 2013. Food and Agricultural Organization of the United Nations. http://www.faostat.fao.org. Acceso Noviembre 2013.
- Gell I., Cubero J., Melgarejo P. 2007a. Two different PCR approaches for universal diagnosis of brown rot and identification of Monilinia spp. in stone fruit trees. Journal of Applied Microbiology, 103: 2629-2637.
- Gell I., Larena I., Melgarejo P. 2007b. Genetic diversity in Monilinia laxa populations in peach orchards in Spain. Journal of Phytopathology, 155: 549-556.
- Gradziel, T.M. (1994) Changes in susceptibility to brown rot with ripening in three clingstone peach genotypes. Journal of the American Society for Horticultural Science, 119: 101-105.
- Gradziel T.M., Wang D. 1993. Evaluation of brown rot resistance and its relation to enzymatic browning in clingstone peach germplasm. Journal of the American Society for Horticultural Science 118: 675-679.
- Guijarro B., Melgarejo P., Torres R., Lamarca N., Usall J., De Cal A. 2008. Penicillium frequentans population dynamics on peach fruits after its applications against brown rot in orchards. Journal of Applied Microbiology, 104 (3): 659-671.
- Holb I.J. 2008. Brown rot blight of pome and stone fruits: symptom, disease cycle, host resistance, and biological control. International Journal of Horticultural Science, 14(3):15-21.
- Jansch M., Frey J.E., Hilber-Bodmer M., Broggini G.A.L., Weger J., Schnabel G., Patocchi A. 2012. SSR marker analysis of Monilinia fructicola from Swiss apricots suggests introduction of the pathogen from neighboring countries and the United States. Plant Pathology, 61(2): 247-254.
- Larena I., De Cal A., Melgarejo P. 2010. Enhancing the adhesion of Epicoccum nigrum conidia to peach surfaces and its relationship to the biocontrol of brown rot caused by Monilinia laxa. Journal of Applied Microbiology, 109(2): 583-593
- MAGRAMA, 2013. Ministerio de Agricultura, Alimentación y Medio Ambiente. http://www.magrama.gob.es. Acceso Noviembre 2013.
- Pascal T., Levigneron A., Kervella J., Ngyen-The C. 1994. Evaluation of two screening methods for resistance of apricot, plum and peach to Monilinia laxa. Euphytica, 77: 19-23.
- Petróczy M., Szigethy A., Palkovics L. 2012. Monilinia species in Hungary: Morphology, culture characteristics, and molecular analysis. Trees, 26: 153-164.
- Villarino M., Melgarejo P., Usall J., Segarra J., Lamarca N., De Cal A. 2012b. Secondary inoculum dynamics of Monilinia spp. and relationship to the incidence of postharvest brown rot in peaches and the weather conditions during the growing season. European Journal of Plant Pathology, 133: 585-598.
- Yanez V., Zeriouh H., Viñas I., Torres R., Usall J., De Vicente A., Pérez-García A., Teixidó N. 2012. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin-like lipopeptides. European Journal of Plant Pathology, 132 (4): 609-619.
- Walter, M.; McLaren, G.F.; Fraser, J.A.; Fampton, C.M.; Boyd-Wilson, K.S.H.; Perry, J.H. 2004. Methods of screening apricot fruit for resistance to brown rot caused by Monilinia spp. Australasian Plant Pathology, 33: 541-547.