Demencias, próxima pandemia

Sinapsis. El origen
Desde los primeros momentos de la vida, las células de nuestro sistema nervioso, las neuronas, reciben una marea de estímulos que gestionar, y lo hacen interconectándose entre ellas y organizándose del modo más eficiente posible para consolidar la nueva información, conformando una huella única. Como dice el verso ‘se hace camino al andar’, y cualquier nuevo aprendizaje desencadena una nueva ruta de conexiones sinápticas que modifican la estructura dendrítica de un entramado de billones de neuronas comunicándose entre sí a velocidades de vértigo. Este jolgorio comunicativo tiene lugar, concretamente, en los espacios interneuronales o espacios sinápticos. Precisamente, la más importante aportación de Ramón y Cajal a la neurología tras ser testigo por primera vez de un proceso de sinapsis en su microscopio, fue demostrar que las neuronas no se tocaban y que, por tanto, no constituían un tejido celular compacto, como se creía. La transmisión se produce por la liberación por parte de una neurona, de sustancias químicas, neurotransmisores principalmente, que interactúan con las moléculas de la neurona receptora, generándose un impulso eléctrico que será el que, específicamente, transporte la información.
Tenemos unos 100 mil millones de neuronas, con infinitas posibilidades de combinación entre ellas y que pueden además formar conexiones, o sinapsis, desde cualquiera de sus partes (dendrita, axón y soma o núcleo). Así, se dan asociaciones del tipo dendrita-soma, axón-axón, dendrita-dendrita, soma-dendrita, etc. El entramado de conexiones avanza velozmente en los primeros años de vida aportando al individuo los recursos con los que adaptarse al medio: realizar todos los procesos biológicos y adquirir capacidades físicas y mentales, tanto básicas como superiores. Pero como la máxima de la naturaleza es ‘no infrautilizar recursos’, y en aras del buen funcionamiento del cerebro, éste optimiza su eficiencia llevando a cabo las llamadas ‘podas sinápticas’. La primera tiene lugar alrededor de los 3 años de edad y la segunda gran poda acontece durante la adolescencia. Las conexiones sinápticas poco utilizadas son eliminadas, mientras que las más usadas se mantendrán o incluso se potenciarán, redundando todo ello en un funcionamiento más efectivo y eficiente del conjunto de procesos cerebrales.
Si bien hasta hace unos años se pensaba que tras las podas, las neuronas no establecían nuevas conexiones hoy se sabe que las sinapsis se siguen produciendo durante toda la vida (aunque la información nueva se guarda cada vez con menos eficiencia), gracias a la capacidad del cerebro de adaptarse, su plasticidad, que le permite reorganizar sus redes neurocognitivas. Algunos de los fármacos y las intervenciones en rehabilitación cognitiva utilizados en pacientes de Alzheimer y Parkinson, por ejemplo, tratan de aprovechar esa plasticidad para reforzar las conexiones que aún no se han deteriorado. Además, recientes investigaciones han demostrado que la inducción artificial de la plasticidad sináptica en una determinada zona del cerebro situada en el hipocampo –el gyrus dentado–, aumenta la producción de neuronas nuevas y mejora la supervivencia de las existentes. Y un consejo del doctor Gurutz Linazasoro, neurólogo y CEO de Vivebiotech en declaraciones recientes: “El envejecimiento y las enfermedades neurodegenerativas, como el Alzheimer o el Parkinson, conllevan la pérdida de sinapsis; por este motivo, una de las mejores maneras de prevenir estas enfermedades es teniendo un excedente de sinapsis como resultado de un aprendizaje continuo a lo largo de la vida”.
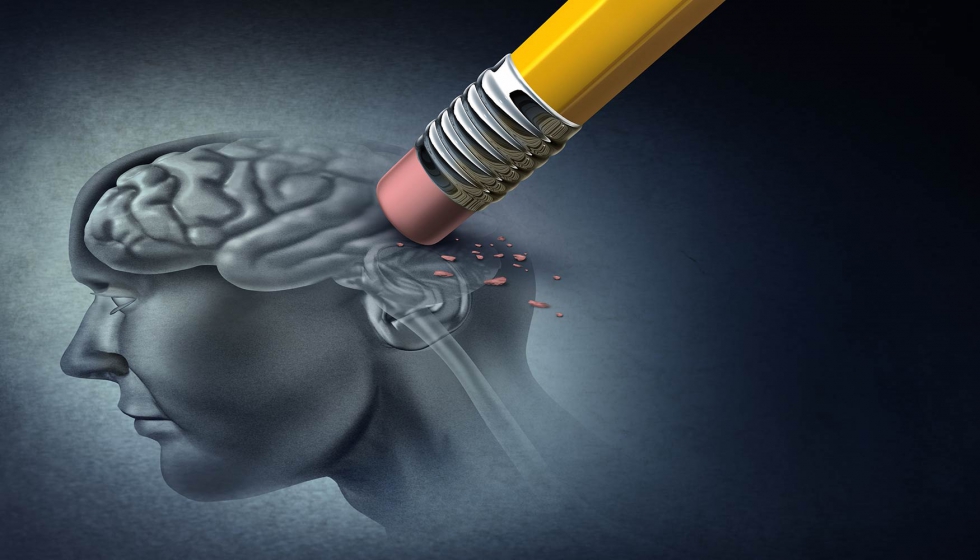
Si los agregados proteicos proliferan a mayor velocidad que los mecanismos de apoptosis encargados de eliminar las células senescentes, defectuosas o los residuos que generan los procesos sinápticos, se rompe el equilibrio y el residuo se acumula –en turquesa en la foto–, resultando tóxico para el sistema y desencadenando diversos y complejos procesos bioquímicos que desembocan en la muerte celular por apoptosis, en el caso de las enfermedades neurodegenerativas. Fuera del ámbito de estas patologías la muerte celular puede producirse por necrosis, como en caso de traumatismo o infección, sin que se pongan en marcha mecanismos de ‘suicidio’ celular.
¿Por qué mueren las neuronas?
Todas las células del organismo, menos las neuronales, se renuevan. Aunque, como se ha mencionado, existen evidencias de neurogénesis adulta en algunas áreas cerebrales, en general las células encargadas de transmitir los impulsos nerviosos viven durante toda la vida del individuo. Pero ¿qué provoca que una neurona degenere hasta morir?
En condiciones normales, que nuestras células, en este caso neuronas, decidan ‘suicidarse’ es bueno. Los procesos de apoptosis, o muerte celular programada, cumplen una función imprescindible para mantener la homeostasis del cerebro, pero sobre qué factores precipitan la pérdida de neuronas en las patologías neurodegenerativas falta mucho por saber. Se sabe que los factores genéticos, en unos casos, y los ambientales, en otros, estarían implicados en distinta medida en función de la patología, pero el abanico de factores es amplio y complejo: desde la agregación proteica hasta el estrés oxidativo, procesos inflamatorios, vasculares, inmunológicos, alteraciones en los mecanismos de la plasticidad sináptica... Así nos los explica el doctor Marc Suárez-Calvet, investigador del Barcelona Beta Brain Research Center, centro de investigación de la Fundación Pasqual Maragall: “En todas las enfermedades neurodegenerativas se da una muerte progresiva de las neuronas, sin embargo las causas y los mecanismos son diferentes en cada una de las enfermedades. En la mayoría de ellas lo que se produce es un acúmulo de algunas proteínas que pueden tener un efecto tóxico sobre estas neuronas; en otros casos puede haber un componente inflamatorio, en ellos tiene lugar una reacción exagerada de las células de la glía; o bien alteraciones de tipo vascular, ya que el sistema vascular tiene también un efecto sobre el cerebro, u otros como el genético o el ambiental.” Por su parte, el investigador y profesor de Farmacia de la UPV/EHU Gorka Orive, describía así el proceso de degeneración neuronal en la enfermedad de Alzheimer en su última conferencia TEDx celebrada en Vitoria-Gasteiz: “La enfermedad de Alzheimer se caracteriza por la acumulación de una clase de proteínas en nuestro cerebro, como la beta-aminoide, que se acumula en forma de placas y también en forma soluble, o la proteína tau, que también se acumula, se fosforila, formando una especie de ovillos compactos. Este depósito va generando un proceso continuo de degeneración: muerte celular, interrupción de la sinapsis o comunicación celular, y en conjunto, una gran toxicidad en el cerebro”. La acumulación de estos agregados proteicos en el interior de la neurona empieza en el hipocampo, lugar donde se ‘fabrica’ la memoria, por eso el primer síntoma de la enfermedad de Alzheimer son los problemas de memoria. A partir de ahí el proceso se va extendiendo a las partes adyacentes, sobreviniendo diversos síntomas como alteración ejecutiva, problemas del lenguaje, orientación, apraxia... Nos encontramos, en definitiva, con una atrofia cerebral progresiva, imparable e incurable.
Mención especial merece el papel de la microglia sobre los factores desencadenantes de la muerte neuronal. Tiene, principalmente, funciones inmunitarias y de ‘limpieza’ –fagocitan los desechos celulares y las células apoptóticas–. En caso de daño o infección estas células gliales facilitan la inflamación del tejido permitiendo que los linfocitos T puedan atravesar la barrera hematoencefálica y reparar las células lesionadas. Disfunciones en la microglía parecen estar implicadas en las enfermedades neurodegenerativas, en las que estas células se activan en exceso y acaban atacando neuronas sanas.

¿Qué sabemos y hacia dónde investigamos?
Uno de los condicionantes fundamentales en las enfermedades neurodegenerativas es su complejo diagnóstico. Se calcula que el 90% de las demencias leves está sin diagnosticar. Teniendo en cuenta que enfermedades como el Alzheimer se manifiestan 20 ó 30 años después de haberse iniciado las alteraciones neuronales, el diagnóstico precoz se convierte en la clave para comprender estos procesos y poder intervenir en ellos, con la creación de fármacos más eficaces. En la actualidad se están desarrollando algunas herramientas de diagnóstico que pueden ayudar a modular la enfermedad. El mayor hándicap de los investigadores es que cuando los pacientes llegan a la consulta es porque los síntomas ya se han manifestado, de modo que las pruebas diagnósticas muestran las consecuencias de la enfermedad; se han desencadenado demasiados procesos para saber cómo y en qué orden se han producido. Poder ‘monitorizar’ los primeros estadios de estas enfermedades explicaría los mecanismos desencadenantes. Además permitiría la administración temprana de fármacos conocidos que muy probablemente sí funcionarían en esas fases iniciales.
Según la Sociedad Nacional de Neurología, el 35% de los casos de Alzheimer se puede atribuir a nueve factores de riesgo modificables: la diabetes, la hipertensión arterial, la obesidad, el tabaquismo, el sedentarismo, la depresión, la inactividad cognitiva, la hipoacusia y el aislamiento social, y controlarlos podría potencialmente prevenir entre 1 y 3 millones de casos de Alzheimer en el mundo. En este sentido, la entidad ha manifestado que “debido a que los fármacos disponibles actualmente para la enfermedad de Alzheimer solo consiguen enlentecer la progresión de los síntomas, y no se dispone en el momento actual de fármacos modificadores de la enfermedad eficaces para reducir su gravedad y restaurar la función cognitiva, la intervención sobre los factores de riesgo modificables de la enfermedad constituye en el momento actual una de las alternativas más eficaces para la prevención activa de la misma y la reducción de su incidencia.”
Ante la sospecha de una patología neurodegenerativa, el procedimiento diagnóstico actualmente es “la realización de un test cognitivo, la búsqueda de biomarcadores mediante punción lumbar, que permite obtener líquido encefaloraquídeo, así como pruebas de neuroimagen, a través de resonancia magnético-nuclear o PET, para detectar estos depósitos de aminoide, y en función de la proteína que se deposite tenemos una u otra enfermedad”, expone el doctor Suárez-Calvet. “En el Beta Brain –prosigue– nos centramos, sobre todo, en la fase preclínica de la enfermedad de Alzheimer, que es la fase en la cual todavía no hay síntomas pero en la que todos los cambios que caracterizan la enfermedad empiezan a ocurrir en el cerebro. En nuestro Estudio Alfa contamos con 3.000 voluntarios a los que estudiamos con análisis de sangre, punciones lumbares, test cognitivos, resonancias magnéticas, etc.”. Pocas certezas pero mucha investigación, y uno de los avances más importantes en el campo de la enfermedad de Alzheimer es el desarrollo de biomarcadores. Al respecto, nuestro interlocutor explica que “hoy tenemos herramientas para diagnosticar la enfermedad de Alzheimer con un análisis de sangre, antes no era posible. Además, con el Estudio Alfa hemos demostrado que estos análisis de sangre también sirven para detectar a aquellas personas que tienen un riesgo elevado de acabar desarrollando la enfermedad en el futuro. Creo que poder diagnosticar la enfermedad de Alzheimer con un análisis de sangre cambiará de manera importante el proceso diagnóstico”. Estas pruebas podrían llevarse a la atención primaria, aunque por el momento permanecen en el ámbito clínico ya que un diagnóstico masivo no parece tener sentido mientras no exista tratamiento efectivo.
En la línea de crear herramientas sencillas que faciliten el diagnóstico encontramos otro ejemplo, el desarrollado por la empresa Geroa Diagnostics, que ha desarrollado un nuevo biomarcador de diagnóstico salival para la enfermedad de Alzheimer. Los investigadores hallaron una sustancia en la saliva, la lactoferrina, cuya medida parece indicar el riesgo de esta enfermedad: a menores niveles de lactoferrina, mayor es el riesgo. Por otra parte, unas semanas antes del cierre de esta edición se anunciaba una nueva prueba creada por neurólogos del hospital Clínic de Barcelona, que predice el riesgo de padecer esta enfermedad de Parkinson y la demencia de cuerpos de Lewy años antes de la aparición de los síntomas, detectando cuándo la proteína sinucleína se presenta en una forma anómala.
Entre las herramientas de diagnóstico más importantes con las que se cuenta en el ámbito de las enfermedades neurodegenerativas figura el conjunto de tecnologías de neuroimagen, destacando la tomografía por emisión de positrones (PET), que se utiliza para medir la presencia y extensión en el cerebro de las principales características neuropatológicas del Alzheimer; detecta las placas de beta-amiloide y los ‘ovillos’ de proteína tau hiperfosforilada, información que hasta ahora solo podía obtenerse post mortem. También forma parte del abanico de pruebas que ayudan al diagnóstico, el estudio de los trastornos del sueño en fase REM. De la relación entre los trastornos del sueño y el Parkinson existen evidencias desde hace tiempo pero recientes investigaciones incluyen otro posible síntoma predictivo: los trastornos del movimiento durante el sueño en forma de espasmos.
Mucho por hacer
En cuanto a tratamientos innovadores, hace tan solo unos días se anunciaba la inminente apertura en Barcelona del primer Ambar Center, el proyecto con el que se llevará a la práctica la terapia de recambio plasmático periódico con albúmina que la farmacéutica Grifols lleva casi dos décadas estudiando y que ha demostrado ralentizar el progreso de la demencia en pacientes con Alzheimer moderado o leve.
Con respecto a los tratamientos farmacológicos, el doctor Suárez nos explica que aunque “es cierto que en los últimos años no se ha aprobado ningún medicamento nuevo para la enfermedad de Alzheimer y todos los tratamientos aprobados son sintomáticos, hay diversos ensayos clínicos, y uno de los fármacos más prometedores son los anticuerpos que eliminan la proteína aminoide, pero la mayoría no han funcionado; con el aducanumab, que está en discusión, se obtuvieron unos resultados prometedores, al parecer ha funcionado en algunos casos y en otros no”.
Otros fármacos en investigación son, por ejemplo, una vacuna contra el Alzeimer o los que indagan en las posibilidades de las sustancias canabinoides. También se está experimentando con las posibilidades que ofrecen las células madre, y se sigue avanzando en neuromodulación y estimulación transcraneal, eléctrica o magnética, técnicas que hoy se aplican en pacientes que no responden a los tratamientos convencionales. En el ámbito de la electroterapia se ha conseguido eliminar los temblores de los pacientes de Parkinson con técnicas de estimulación cerebral profunda, aplicando corriente alterna de baja intensidad. Y como dice el doctor Suárez-Calvet, “el hecho de que no tengamos tratamientos modificadores de la enfermedad de Alzheimer no significa que no podamos hacer nada. Hay toda una serie de cambios en el estilo de vida que ayudan a prevenir la enfermedad, por ejemplo, todo aquello que va bien para el corazón va bien para para el cerebro, eso quiere decir que el control de los factores de riesgo cardiovascular (diabetes, hipertensión, colesterol...), hacer ejercicio físico, etc., todo ello ayuda a prevenir esta y otras enfermedades. Eso lo hemos de hacer todos, no hace falta un análisis de sangre para saber quién lo debe hacer y quién no”.
En cualquier caso, la sociedad en su conjunto se verá afectada por las dolencias neurológicas asociadas al envejecimiento; como enfermos o como cuidadores, la presencia de estas enfermedades en la vida de las personas crecerá. Este incremento, debido claramente a factores demográficos, tendrá en los próximos años un gran impacto económico en los sistemas de salud, que vendrá a añadirse al galimatías de la sostenibilidad de las pensiones. Según la Sociedad Nacional de Neurología, el coste del tratamiento del Alzheimer en España supone el 1,5% del producto interior bruto nacional, y cada año se diagnostican en nuestro país unos 40.000 nuevos casos. Veremos también nuevos debates sociales como consecuencia de las altas cifras de población envejecida, como conflictos generacionales por el uso de los recursos públicos, la demanda de una ética de la ciencia a la que se pedirá que la esperanza de vida avance en paralelo a la esperanza de vida de nuestras neuronas…, u otros como el derecho del individuo a decidir cuándo morir. Se necesitará voluntad, estrategias coordinadas e inversión para acometer acciones desde todos los ámbitos.
Sí, hay mucho trabajo por hacer. No esperemos a tener la pandemia encima. Aún se puede.